多能性幹細胞は,内胚葉,中胚葉,外胚葉の三胚葉へ分化する多能性を持ち,自己複製能を有する未分化な細胞である.胚性幹細胞(ES細胞),人工多能性幹細胞(iPS細胞),マウスエピブラスト幹細胞(エピ幹細胞)などが,これに属する.ES細胞は,1981年にマウスで1, 2),1998年にヒトで3)樹立された.その後,数種類の遺伝子を線維芽細胞などの体細胞に強制発現させることにより,iPS細胞が樹立された4).現在,多能性幹細胞を用いた創薬や再生医療を目指した研究が盛んに行われている.多能性幹細胞の維持や分化は,内因性の転写因子に加え,線維芽細胞増殖因子(FGF),骨形成タンパク質(BMP),Wntなどの細胞外因子からのシグナル伝達が決定している5).
組織幹細胞は,成体で組織維持に働き,造血幹細胞,神経幹細胞,腸幹細胞,生殖幹細胞などがある.自己複製する一方で,分化した細胞種を生み出す.このためには,幹細胞が幹細胞ニッチと接していること,非対称分裂,そして,幹細胞ニッチから幹細胞へのシグナル伝達が必要である6).多能性幹細胞と同様なBMPやWntシグナル,Hedgehog(Hh)やNotchシグナルなどが細胞運命を決定する.
がん幹細胞は,腫瘍組織中に存在する幹細胞の性質を持つ細胞である7).自己複製能を示し,少数から元の腫瘍組織と同じ腫瘍を形成することができるcancer initiation cellである.その幹細胞性の維持には,多能性幹細胞や組織幹細胞と類似したシグナルや幹細胞ニッチが働くと考えられている.
一方,分泌されるタンパク質や細胞膜上のタンパク質は,多くが糖鎖修飾を受けた糖タンパク質である.細胞表面に提示される糖鎖は,生物の発生過程や疾病への過程で,顕著に変化する.約200種の糖転移酵素が,各過程で特異的にその発現を変え,小胞体やゴルジ体でさまざまな糖をタンパク質や脂質に付加し,糖タンパク質や糖脂質の多様な糖鎖を合成する.細胞表面のstage-specific embryonic antigen-4(SSEA-4)などの糖鎖は,ES細胞やiPS細胞のマーカーとして汎用され8, 9),また,シアリルLewis aなどの糖鎖は腫瘍マーカーとして臨床に用いられている.他方,細胞質や核に唯一存在するO-GlcNAc転移酵素(OGT)は,細胞質や核のタンパク質のセリン(Ser),トレオニン残基(Thr)に,N-アセチルグルコサミン(GlcNAc)を1分子付加する.
糖鎖は,このように,細胞や組織の状態を敏感に反映するため,細胞のマーカーとして広く用いられている.しかし,それにとどまらず,細胞外因子からのシグナル伝達も制御している.たとえば,ヘパラン硫酸などの硫酸化された糖鎖は,FGF, BMP, Wnt, Hhに結合し,さまざまな細胞でこれらの因子を安定化したり,共受容体として働いたりしている10–13).幹細胞においても,維持や細胞運命の決定に重要なこれらのシグナルに対し,同様な機能を持つと考えられた.また,OGTは,シグナル構成因子のリン酸化部位やその近傍のSerやThrをO-GlcNAc化し,競合してリン酸化を抑制する.ここでも,また,幹細胞を制御するシグナルへの関与が予測された.我々は,マウスES細胞で,糖鎖合成に関わる遺伝子の発現を網羅的にノックダウンし,幹細胞維持や分化に関わる糖鎖のスクリーニングを行った8, 9, 11, 13–18).現在,多能性幹細胞,組織幹細胞,および,がん幹細胞における糖鎖の役割が明らかにされつつある.本稿では,それらを紹介し,幹細胞における糖鎖の働きを我々の結果を含めて概観する.
1)哺乳類多能性幹細胞の異なる状態:ナイーブ状態とプライム状態
哺乳類の多能性幹細胞は,異なる発生段階に対応する状態にあり,それらを「ナイーブ状態」と「プライム状態」と呼ぶ(表1)5, 9).ナイーブ状態のマウスES細胞は,受精後3.5日目の着床前の胚盤胞の内部細胞塊(ICM)から樹立され,ICMに対応し,単一細胞で培養可能で増殖能が高い.白血病抑制因子(LIF)を培地に添加して,未分化性を維持する.その一方,マウスエピ幹細胞は,受精後5.5日目の着床後の卵円筒胚のエピブラストから樹立されたプライム状態の多能性幹細胞である19, 20).マウスエピ幹細胞の未分化性維持には,LIFではなく,FGF2とNodal/activinが必須である.マウスエピ幹細胞の網羅的な遺伝子発現やエピジェネティックな制御の状態は,マウスES/iPS細胞とはまったく異なっていたが,ヒトES/iPS細胞と酷似していた.このため,ヒトES/iPS細胞も,「プライム状態」にあるとされた.その後の解析から,両状態では,エネルギー代謝の状態やミトコンドリアの活性化も異なることがわかってきた21).プライム状態の多能性細胞は,増殖が遅く,単一細胞では生存性が低く,遺伝子導入効率も低い.機能解析や再生医療への応用に向けて,ヒトES/iPS細胞のナイーブ化が望まれている.
表1 哺乳類多能性幹細胞のナイーブ状態とプライム状態| 項目 | 状態 |
|---|
| ナイーブ状態 | プライム状態 |
|---|
| 対応する発生段階 | 着床前の胚盤胞 | 着床後の胚盤胞 |
| 樹立されている多能性幹細胞 | ES/iPS細胞(マウス) | エピブラスト幹細胞(マウス),ES/iPS細胞(ヒト) |
| 要求される増殖因子 | LIF | FGF2, Nodal/activin |
| 2i*1への反応 | 自己再生能 | 分化 |
| LIF/Stat3への反応 | 自己再生能 | — |
| Fgf/Erkへの反応 | 分化 | 自己再生能 |
| 発現している遺伝子 | Oct3/4, Sox2, Nanog, Rex1, Klf2, Klf4, Tbx3, Tfcp2l1, Gbx2, Esrrb | Oct3/4, Sox2, Nanog, Fgf5, Otx2, Oct6, Sox3, Foxa2, Cer1, branchyury, Sox1 |
| Oct4のエンハンサー*2 | 遠位 | 近位 |
| 表面の糖鎖マーカー | SSEA-1*3, ST6GAL1*4, Gb3*4 | SSEA-3, 4, 5*5, Tra-1-60*5, Tra-1-81*5, R-10G*5, rBC2LCN*5, Globo-H |
| DNAのメチル化 | 低メチル化 | — |
| X染色体の不活性化 | Xa*6Xa | XaXi*7 |
| 代謝 | 酸化的リン酸化,解糖系 | 解糖系 |
| ミトコンドリアの活性 | 高 | 低 |
| テラトーマの形成 | 可 | 可 |
| 分化能 | 多分化能 | 多分化能(生殖細胞を除く) |
| キメラ形成能 | 高 | 低 |
| コロニーの形態 | 丸く盛り上がる | 平い |
| 1細胞への解離 | 可 | 不可*8 |
| 増殖速度 | 速い | 遅い |
| LIF:白血病抑制因子(leukemia inhibitory factor),FGF:線維芽細胞増殖因子(fibroblast growth factor),SSEA:stage-specific embryonic antigen. *1 2i:Wntシグナル促進剤(GSK3阻害剤)とFGFシグナル阻害剤(MEK阻害剤).*2時期組織特異的な発現に関与する,遠位エンハンサーと近位エンハンサー.*3マウスES/iPS細胞に対する糖鎖マーカーであるがナイーブ状態様なヒトiPS細胞でも検出された.*4ナイーブ状態と想定されているヒトES/iPS細胞に対する糖鎖マーカー.*5従来のヒトES/iPS細胞に対する糖鎖マーカー.*6 Xa:活性化しているX染色体.*7 Xi:不活性化しているX染色体.*8 ROCK阻害剤を添加しないとできない. |
ナイーブ状態のマウスES細胞を,LIFの代わりにFGF2とActivin A22),あるいは,FGF2とヤヌスキナーゼ(JAK)阻害剤(LIFシグナル阻害剤)17)を添加して培養し続けると,プライム状態のエピ幹細胞様の細胞に分化する.逆に,プライム状態のマウスエピ幹細胞様の細胞を,FGF2の代わりにFGFシグナル阻害剤(PD0325901, PD03),Wntシグナル促進剤(CHIR99021, CHIR)とLIFを添加して培養すると,ナイーブ状態のES細胞に戻すこともできる17, 23, 24).しかし,ヒトES/iPS細胞をナイーブ化するのは,マウスほど容易ではない.さまざまな方法が開発され,比較検討されている25–27).
なお,最近,ナイーブ状態とプライム状態の中間に位置する状態,Formative状態が提唱されている28).
2)ナイーブ状態とプライム状態の糖鎖マーカー
細胞表面の糖鎖は,発生過程や組織形成の過程で顕著な変化を示す.このため,ES/iPS細胞表面の糖鎖は,ES/iPS細胞マーカーとして汎用されている(表1).SSEA-1はGalβ1,4(Fucα1,3)GlcNAcで表される糖鎖で,Lewis x抗原とも呼ばれ,ナイーブなマウスES/iPS細胞のマーカーとなっている29, 30).マウスES/iPS細胞の糖タンパク質上にも糖脂質上にも見いだされるが,プライムなヒトES/iPS細胞では発現していない30).一方,SSEA-3(3GalNAcβ1,3Galα1,4Gal),SSEA-4(NeuAcα2,3Galβ1,3GalNAc),TRA-1-60抗原,TRA-1-81抗原は,プライムなヒトES/iPS細胞のマーカーとなっている31).SSEA-3とSSEA-4は,グロボ系列の糖脂質上にあり32),RA-1-60抗原とTRA-1-81抗原では,type1ラクトサミン構造を含む糖鎖(Galβ1,3GlcNAcβ1,3Galβ1,4GlcNAc)がムチン型の糖タンパク質上にある33).さらには,質量分析などを用いた網羅的な構造解析により,SSEA-534, 35)やGlobo-H35, 36),R-10G37),rBC2LCNに結合する糖鎖38)などのさまざまな糖鎖構造が,プライムなヒトES/iPS細胞のマーカーとなることがわかり,各々を合成する糖転移酵素も発現していた.これらの多くは,糖脂質やムチン型の糖タンパク質上にあるHType1構造(Fucα1,2Galβ1,3GlcNAc),あるいは,Htype3構造(Fucα1,2Galβ1,3GalNAc)を含むものである.R-10Gはこれらとは異なり,高硫酸化されていないケラタン硫酸であった37).
さらには,既存の表面マーカーを用いた網羅的検索から,2種の異なる方法で作製したナイーブ状態とされるヒトES細胞で,CD75とCD77が特異的に発現することがわかった39)(表1).CD75はα2,6シアル酸転移酵素1(ST6GAL1),CD77はグロボトリアオシルセラミド(Gb3)であるが,通常ゴルジ体に存在するST6GAL1が,なぜ細胞表面にあるかは不明である.また,最近,ヒトの乳歯の歯髄細胞から作製したiPS細胞を,マウス胎仔由来の線維芽細胞をフィーダー細胞として2iの条件下(PD03とCHIRを添加:表1脚注)で培養すると,ナイーブ状態様の細胞になりSSEA-1を発現することが報告された40).
なお,マウスES細胞とヒトES細胞でグライコプロテオーム解析も行われ,糖鎖修飾を受けるアミノ酸の位置と糖鎖構造を含めた情報が蓄積しつつある41).
3)ナイーブ状態の多能性幹細胞における糖鎖の機能:ラックダイナック,ヘパラン硫酸,O-GlcNAcはナイーブ状態の維持に必要である
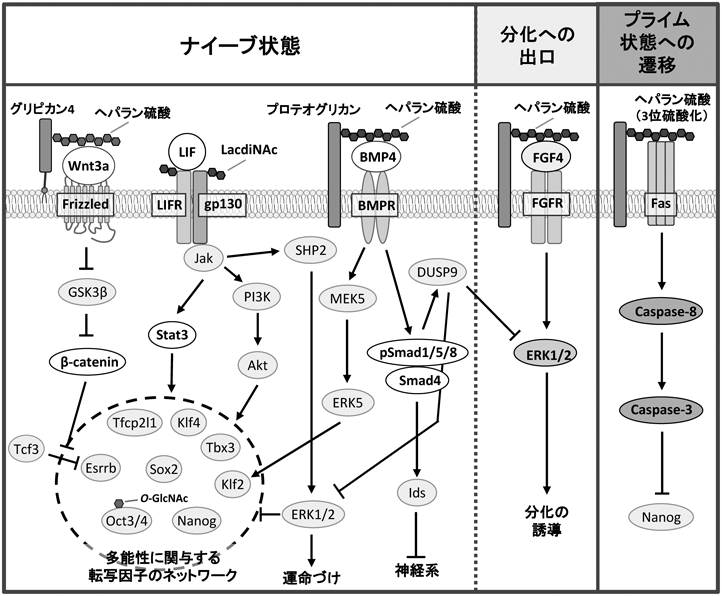
このように,糖鎖はES/iPS細胞マーカーとして汎用されていたが,これらの表面マーカーの機能についての報告はほとんどなく,不明な点が多かった.そこで,我々は,ナイーブなマウスES細胞で,糖鎖合成に関わる糖転移酵素などの遺伝子の発現を網羅的にノックダウンし,アルカリホスファターゼ染色陽性を自己複製能の指標にしてスクリーニングを行った.その結果,ラックダイナック(LacdiNAc)糖鎖構造(GalNAcβ1,4GlcNAc),ヘパラン硫酸,O-GlcNAcがナイーブ状態の維持に必要であることがわかった8, 9, 11, 13–18).これらの糖鎖は,ナイーブ状態の維持に働くLIF, BMP, Wntシグナルや分化の出口となるFGF4シグナルに関与し,ナイーブ状態の維持に必要であった(図1).
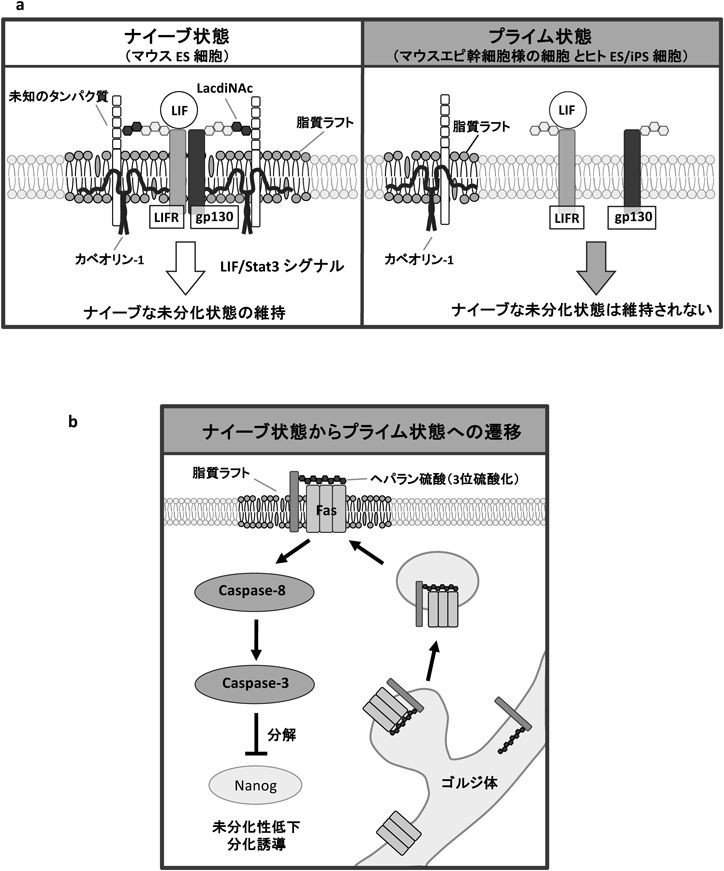
LIF/シグナル伝達性転写因子(Stat)3シグナルは,その下流でナイーブ状態の未分化性,すなわち,多能性と自己複製能の維持に関わる遺伝子の転写を促進している(図1).LacdiNAcはショウジョウバエからヒトまで保存された糖鎖構造であり42),LIF受容体(LIFR)とglycoprotein130(gp130)は,ナイーブ状態ではこの糖鎖修飾を受けている.LacdiNAcは,LIF/Stat3シグナルを介してナイーブ状態を規定し,ナイーブ状態の維持に必要であった14)(図1,図2a).LacdiNAcの発現は,ナイーブ状態のマウスES細胞で高く,分化に伴って低下し,プライム状態のマウスエピ幹細胞様の細胞とヒトiPS細胞では,LIFRとgp130はほとんどLacdiNAcの修飾を受けない.一方,ラフト/カベオラは,スフィンゴ脂質とコレステロールに富んだ細胞膜上の微小領域のうち,カベオリンを含むものである.種々のシグナル受容体がそこに集積し,シグナル伝達の場となっている.LIF/Stat3シグナルの効率的な伝達には,LIFRとgp130がラフトに局在することが必要である(図2a).LacdiNAcの発現が高いナイーブ状態のマウスES細胞では,LIFRとgp130上のLacdiNAcを介して両者はカベオリン-1複合体などのラフト構成因子と結合し,ラフト/カベオラに局在する.このため,LIFシグナル伝達に必要なLIFRとgp130の複合体形成が促進され,効率的にシグナルが伝達されていた.LacdiNAcの発現が低いプライム状態の細胞では,LIFRとgp130はLacdiNAc修飾をほとんど受けず,ラフト/カベオラに局在しない.このため,LIFRとgp130の複合体形成が効率的になされず,強いシグナルが伝達されなかった.なお,カベオリン-1複合体に含まれるLacdiNAcに結合するタンパク質については,解析中である.
LIF/Stat3シグナル以外にも,BMP4/mothers against dpp homolog(Smad)やWnt/β-cateninシグナルがナイーブ状態のマウスES細胞の維持に必要である5, 8, 9)(図1).Wntシグナルは,それのみでは不十分であるが43),LIFシグナルと相乗的に働き,ナイーブ状態を維持する44).一般に,ヘパラン硫酸などの硫酸化された糖鎖は,BMPやWntに結合し,さまざまな細胞でこれらの因子の安定化や共受容体として働いている10–12).ヘパラン硫酸に構造が類似するヘパリンは,Wnt3a(KD=26.0 nM)11)にもBMP4(KD=69.4 nM)13)にも強く結合する.ヘパラン硫酸の伸長に関わる遺伝子も,本スクリーニングで見いだされた11).我々を含むいくつかのグループの解析から,ヘパラン硫酸がWntとBMPシグナルを制御して,マウスES細胞のナイーブ状態の維持に働くことがわかり8, 9)(図1),そこでは,ヘパラン硫酸の硫酸化が必須であった13).さらに,ヘパラン硫酸プロテオグリカンのうち,グリピカン4は,Wntシグナルを選択的に制御していた45).ヘパラン硫酸は,種々のコアタンパク質に結合してヘパラン硫酸プロテオグリカンを形成している.シグナルによってコアタンパク質が使い分けられていると推察された.
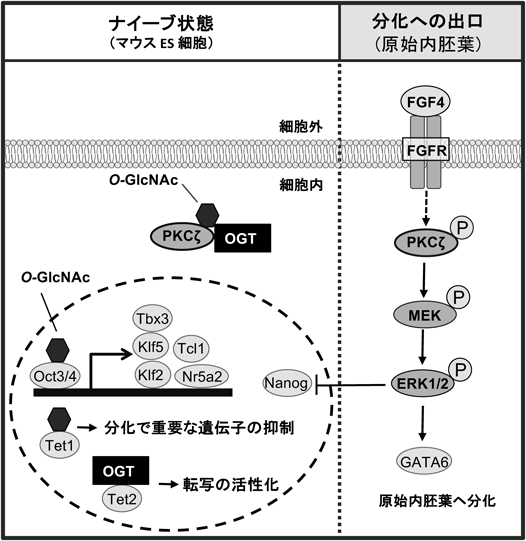
本スクリーニングで三番目に見いだされた糖鎖は,O-GlcNAcであった9, 17, 18).O-GlcNAcは,核やミトコンドリア,細胞質に存在するタンパク質に起こる唯一の糖鎖修飾である.OGTにより,タンパク質のSer/Thr残基にO-GlcNAc修飾が施され,O-GlcNAc分解酵素(OGA)により加水分解・除去される46).リン酸化されるSer/Thr残基やその近傍でO-GlcNAc修飾が行われることが多く,O-GlcNAc修飾とリン酸化修飾は競合関係にあると考えられている47).実際,ナイーブなマウスES細胞においてO-GlcNAcがFGF4シグナルを抑制し,未分化性維持に寄与していた18)(図3).FGF4シグナルは,マウスES細胞の未分化性を抑制し,分化の出口となり,分化を促進する.我々は,未分化性維持のためにFGF4シグナルを抑制する機構が存在すると仮定し,O-GlcNAcによるリン酸化抑制に着目した.FGF受容体の下流でmitogen-activated protein kinase/extracellular signal-regulated kinase(MEK)-ERK1/2経路がリン酸化され,FGF4シグナルは活性化する.リン酸化ERK1/2は未分化性維持に関わる転写因子であるNanogの発現を抑制する.Ogt KDマウスES細胞では,FGF4-MEK-ERK1/2経路が活性化し,未分化性が低下し,分化が促進していた.一方で,ナイーブなマウスES細胞において,FGF4シグナル構成因子のprotein kinase c ζ(PKCζ)のThr410は,O-GlcNAc修飾を受けていた.PKCζはThr410がリン酸化されると活性化し,下流のMEK-ERK1/2経路を活性化する.ナイーブなマウスES細胞では,Thr410がO-GlcNAc修飾を受け,PKCζのリン酸化が阻害され,FGF4シグナルが抑制されていることがわかった18).
リン酸化の抑制以外にもO-GlcNAcは,転写因子の転写活性の制御,タンパク質-タンパク質間相互作用の制御,エピジェネティックな制御などの機能を持つ46).多能性に関与する転写因子であるOct4とSox2がナイーブなマウスES細胞でO-GlcNAc化されており,分化に伴いそれらは除去される48).しかし,O-GlcNAc修飾の機能は,Oct4とSox2で逆のものであった.Oct4のThr228のO-GlcNAc修飾は,Oct4の転写活性を正に制御し,ナイーブ状態の維持に必須な遺伝子,Klf2, Klf5, Nr5a2, Tbx3, Tcl1などの誘導に重要であった48)(図3).一方,Sox2はpoly(ADP-ribose)polymerase 1と複合体を形成し,マウスES細胞の未分化性に寄与するが,Sox2のSer248のO-GlcNAc修飾はこの複合体形成を阻害し,未分化性維持に対し抑制的に働いていた49).O-GlcNAcはエピジェネティックな制御にも関与する.Ten eleven translocation(Tet)1と2は,ナイーブなマウスES細胞に発現しており,シトシンの5位のメチル基をヒドロキシ化し,5-ヒドロキシメチルシトシン(5hmC)に変換する活性を持つ酵素群に属する.5hmCは,DNA脱メチル化への中間体である.Tet1はO-GlcNAc化されると安定化し,この場合,Sin3A, NuRDと抑制型クロマチン構造を形成する複合体を作り,分化で重要となる遺伝子の発現を抑えていた50)(図3).一方,Tet2とOGTは複合体を形成し,転写を活性化している51)(図3).Tet2はOGTをヒストンH2Bへリクルートし,ヒストンH2BのSer112をO-GlcNAc化し,転写を活性化する.Tet2もO-GlcNAc修飾を受けているが,その機能はよくわかっていない52).
以上のように,LacdiNAc,ヘパラン硫酸,O-GlcNAcは,多能性維持に働くLIF, BMP, Wntシグナルの促進や分化の出口となるFGF4シグナルの抑制に機能し,ナイーブ状態の維持に必要であった(図1, 2a, 3).
4)ナイーブ状態からの出口における糖鎖の機能:ヘパラン硫酸は,分化への出口にも必要である
ナイーブ状態のマウスES細胞はFGF4を分泌しているが,FGF4シグナルは分化への出口で働き,分化への引き金を引く53)(図1).ここにも,ヘパラン硫酸が関与することが報告されている54, 55).ヘパラン硫酸の二糖繰り返し領域の骨格を合成するexostosin glycosyltransferase 1(EXT1)をノックアウトしたマウスのES細胞の胚様体は,NanogとOt4の発現が高く,分化への引き金が引かれず,分化した細胞系譜のマーカーが発現しない55).N-deacetylase/N-sulfotransferase(Ndst)は,はじめに硫酸を転移する硫酸転移酵素であり,この酵素が引き続いて起こる硫酸化の起点となる.Ndst1と2のダブルノックアウトES細胞でも,NanogとOt4の発現が高く,エピブラストのマーカーのFGF5を誘導できず,ヘパラン硫酸の硫酸化がこの過程で重要であることがわかる56).
一方,コンドロイチン硫酸がE-カドヘリンと結合することによって,Rhoシグナルをコントロールし,分化へのコミットメントに働くことが報告されている57).ヘパラン硫酸とコンドロイチン硫酸は,ここでは異なる働きをしているようだ.
5)ナイーブ状態からプライム状態への遷移における糖鎖の機能:3位が硫酸化されたヘパラン硫酸はFasシグナルを活性化して遷移を促進している
ナイーブ状態のマウスES細胞を,LIFの代わりにFGF2とActivin A22),あるいは,FGF2とJAK阻害剤(LIFシグナル阻害剤)17)を添加して培養し続けると,プライム状態のエピ幹細胞様の細胞に分化する.我々は,ナイーブ状態からプライム状態への遷移に伴って,HS 3-O-sulfotransferase-5(3OST-5)の発現が上昇することを見いだした.ここでは,その生成物である3位が硫酸化されたヘパラン硫酸が,Fasシグナルを介して働いていた16)(図1, 2b).Fasリガンドがない場合も,受容体のFasが細胞表面の脂質ラフトに集積すると,Fasシグナルは活性化される.ゴルジ体内腔で,3位が硫酸化されたヘパラン硫酸はFasのヘパリン結合配列(KLRRRVH)に結合し,Fasを脂質ラフトに移行させ,Fasシグナルを活性化させる15, 16)(図2b).Fasシグナルはカスパーゼ経路を活性化し,未分化維持因子であるNanogタンパク質を分解してプライム状態への移行を促進させていた16).
同様なナイーブ状態からプライム状態への遷移では,細胞質内のOGAの発現は顕著に増加するが,核と細胞質内のOGTの発現に変化はなかった17).しかし,マウスES細胞のナイーブ状態からプライム状態への移行にOGA阻害剤は影響を及ぼさないと報告されており,この過程におけるO-GlcNAcの役割は明らかではない58).
6)プライム状態の多能性幹細胞における糖鎖の機能:OGT, ST6GAL1,ヘパラン硫酸がプライム状態の多能性幹細胞に必要である
プライム状態の多能性幹細胞においても,糖鎖機能の解析が行われ始めている.我々は,マウスES細胞から誘導されたプライム状態のエピ幹細胞様の細胞では,OGTが未分化性維持には関与しないが,生存に必須であることを明らかにした17).
通常使用されているヒトのES/iPS細胞は,プライム状態の多能性幹細胞である(表1).ヒトES細胞では,高い発現を示すST6GAL1が,Oct4とSox2を制御して多能性の維持に必要であることが示された59).対照的に,NCAM上のポリシアル酸は,内胚葉への運命づけとヒトES細胞からの分化に必要であると報告された60).
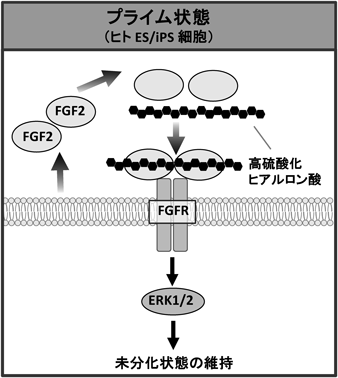
ヒトES/iPS細胞に発現する全糖鎖の種類について絶対量を比較すると,ヘパラン硫酸やコンドロイチン硫酸を含むグリコサミノグリカンが半分以上を占めている35).しかし,プライムなヒトES/iPS細胞上のグリコサミノグリカンの機能はよくわかっていない.それにもかかわらず,実際には,血清なしの培地ではFGF2とヘパリンが加えられ61),フィーダー細胞から分泌されるヘパラン硫酸はFGF2と結合してFGF2を安定化し,増殖と多能性維持に重要である62, 63).我々は,最近,グリコサミノグリカンの一種であるヒアルロン酸を人工的に硫酸化し,硫酸化度を自在に調節することに成功した.高度に硫酸化したヒアルロン酸を加えてヒトiPS細胞を培養したところ,フィーダー細胞なし,FGF2の添加なし,血清なしの条件で多能性を保って培養することができた(図4)64).実際,高硫酸化ヒアルロン酸はFGF2に対してヘパリンより強い結合性を示し,添加によりFGFシグナルの増強が認められた.高硫酸化ヒアルロン酸が複数のFGF2と結合することにより,FGF受容体の二量体形成が促進され,その結果,シグナルが増強したものと考えている.
7)プライム状態からナイーブ状態への遷移における糖鎖の機能:ラックダイナック,OGT, OGAがナイーブ状態への遷移に必要である
プライム状態のマウスエピ幹細胞様の細胞を,FGF2の代わりにFGFシグナル阻害剤(PD03),Wntシグナル促進剤(CHIR)とLIFを添加して培養すると,ナイーブ状態のES細胞に戻すことができる17, 23, 24).我々は,ナイーブ状態の維持に必要なOGTのみならず,その分解酵素であるOGAもが,ナイーブ状態への遷移に必要であることを明らかにした17).この事実から,O-GlcNAc化され機能するタンパク質やタンパク質中のアミノ酸の位置が,ナイーブ状態とプライム状態で異なっていると考えられる.
ナイーブ状態の維持に必要なLacdiNAc糖鎖構造もナイーブ状態への遷移に必要であった14)(図1, 2b).プライム状態の多能性幹細胞では,LIF/Stat3シグナルは未分化性維持に働かない.マウスエピ幹細胞様の細胞とヒトiPS細胞では,LacdiNAcの発現は非常に低く,LIFRとgp130のラフト/カベオラへの局在も非常に低下していた.LacdiNAcを合成するβ1,4-N-acetylgalactosaminyltransferaseをノックダウンすると,マウスエピ幹細胞様の細胞からナイーブ状態のマウスES細胞に戻すことができなくなった.これらの事実から,ナイーブ状態のマウスES細胞とプライム状態のヒトES/iPS細胞やマウスエピ幹細胞のLIF感受性の違いは,LIFRとgp130上のLacdiNAcの発現の違いにも起因していると考えられ,LacdiNAc糖鎖構造がナイーブ状態の誘導にも必要であることがわかった.
3. ショウジョウバエ組織幹細胞における糖鎖の機能
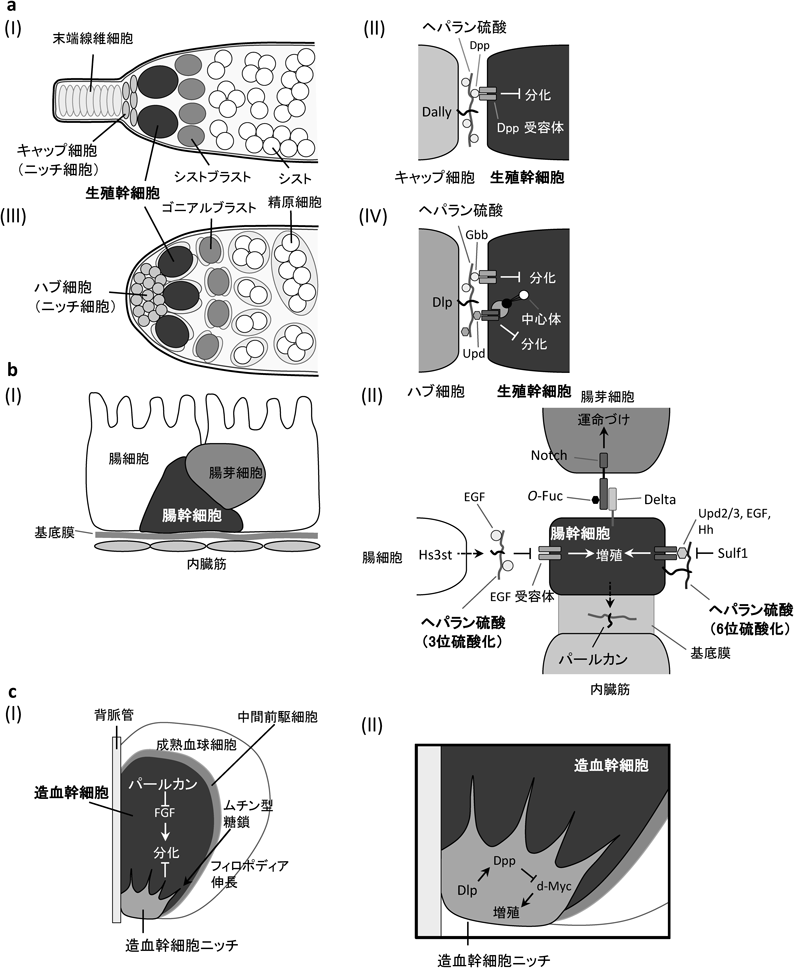
生殖幹細胞,腸幹細胞,造血幹細胞や神経幹細胞などの成体で組織維持に働く組織幹細胞は,自己複製する一方で,分化する細胞種を生み出す.このためには,幹細胞の幹細胞ニッチとの接触,非対称分裂,幹細胞ニッチから幹細胞へのシグナル伝達が必要である6).幹細胞ニッチ側に接触する細胞は組織幹細胞として維持され,ニッチに接触しない細胞はその組織を構成する細胞へと分化する.ショウジョウバエの組織幹細胞は,哺乳類の組織幹細胞のよいモデルを与え,ニッチからのシグナルも共通するものが多いことがわかってきた.BMP, Wnt, Hh, FGF, Notchシグナルなどが働いており,ここでもヘパラン硫酸やO-Fucなどの糖鎖がシグナル制御に関わっている(図5).
1)生殖幹細胞における糖鎖の機能:ヘパラン硫酸プロテオグリカンがBMPシグナルを介して分化を抑制している
細胞表面にある代表的なヘパラン硫酸プロテオグリカンは,グリコシルホスファチジルイノシトールアンカー型タンパク質のグリピカンと膜貫通領域を持つシンデカンである.ショウジョウバエには,Division abnormally delayed(Dally)とDally-like protein(Dlp)のグリピカン2種がある.キャップ細胞は卵巣の幹細胞ニッチで,Dallyを発現している(図5a-I, II).Dallyはキャップ細胞が分泌するBMPホモログのDecapentaplegic(Dpp)をトラップし,隣接する生殖幹細胞に提示してBMPシグナルを入力し,分化を抑制していた12, 65–67).幹細胞が非対称分裂して生じた二つの娘細胞のうち,キャップ細胞に隣接する娘細胞は幹細胞として維持され,もう一方の娘細胞は分化する.ヘパラン硫酸の合成に関わる糖転移酵素の欠損個体では,Dallyはこの機能を持たず,Dally上のヘパラン硫酸が必須であった.一方,精巣のニッチ細胞であるハブ細胞では,Dlp上のヘパラン硫酸が同様な機能を持っていた(図5a-III, IV).ハブ細胞は,もう一つのBMPホモログであるGlass-bottom boat(Gbb)とインターロイキン-6のホモログであるUnpaired(Upd)を分泌する.Dlpはこれらをトラップし,隣接する生殖幹細胞に提示してシグナルを入力し,分化を抑制しているようだ.また,ハブ細胞で発現する6位が硫酸化されたヘパラン硫酸が,生殖幹細胞の中心体の位置決めに関わり,非対称分裂に関与することも報告された68).
2)腸幹細胞における糖鎖の機能:NotchのO-Fucは細胞運命の決定に必要であり,硫酸化の位置が異なるヘパラン硫酸が幹細胞の増殖を制御している
腸幹細胞は分裂後,新たな腸幹細胞と腸芽細胞を生じる(図5b-I).どちらかの娘細胞のDeltaが,他の娘細胞のNotchを活性化して強いシグナルを送り,腸芽細胞への運命づけを行う.Notchシグナルの強い活性化には,NotchのO-Fuc修飾が必要であった69).一方,ヘパラン硫酸プロテオグリカンのパールカンは,腸幹細胞から分泌され,基底膜の構成員となり,腸幹細胞のアイデンティティーと増殖性を維持していた70).3位が硫酸化されたヘパラン硫酸が,腸幹細胞で上皮成長因子(EGF)受容体からのシグナルを阻害して増殖の抑制に働いて恒常性を維持すること71),損傷後の再生過程では,6位が硫酸化されたヘパラン硫酸が,Jak/Stat, EGF, Hhシグナルを介して,腸幹細胞の分裂を活性化し,その収束には6位の硫酸エステル加水分解酵素(Sulf1)が必要なこともわかっている72).
3)造血幹細胞における糖鎖の機能:ヘパラン硫酸プロテオグリカンとムチン型のO-結合型糖鎖が幹細胞維持に機能している
リンフグランドのPrimary lobeは,幼虫の造血器官であり,造血幹細胞ニッチ,造血幹細胞,成熟血球細胞で構成される73)(図5c-I).成熟血球細胞には,プラズマ細胞,クリスタル細胞,ラメロサイトがある74).成熟血球細胞の90~95%はプラズマ細胞で,哺乳類のマクロファージに相当し貪食作用を持つ.細胞外マトリクスの一員であるパールカンは,造血幹細胞から分泌されるが,FGFをトラップしてFGFシグナルを阻害し,造血幹細胞の分化を抑制して幹細胞を維持している75)(図5c-I).Dlpは造血幹細胞ニッチに発現し,BMPシグナルを介してニッチ細胞数を制御していた76)(図5c-II).
一方,血リンパ(体液)中に,プラズマ細胞はさまざまな分子を分泌する.血リンパは,それに浸っている組織細胞の直接の環境であり,血リンパの恒常性の維持は,組織の生理機能に重要である.我々は糖鎖が関わる初めての例として,プラズマ細胞から分泌される血リンパ構成因子がムチン型のO結合型糖鎖であるT抗原を持ち,造血幹細胞を維持するための環境を整えていることを明らかにした77)(図5c-I).この糖鎖の欠損個体では,ニッチ細胞からのフィロポディアの伸長が阻害され,造血幹細胞が消失した.
4)その他の組織幹細胞における糖鎖の機能
他の組織幹細胞においても糖鎖の機能が報告されている.我々は,筋ジストロフィーの原因遺伝子の一つであるO-Man転移酵素の変異体で,筋芽細胞の密度が高くなって筋芽細胞のアポトーシスが亢進することを見いだしている78).また,パールカンが,FGFとHhシグナルを介して神経芽細胞の分裂を促進していること79)も報告されている.