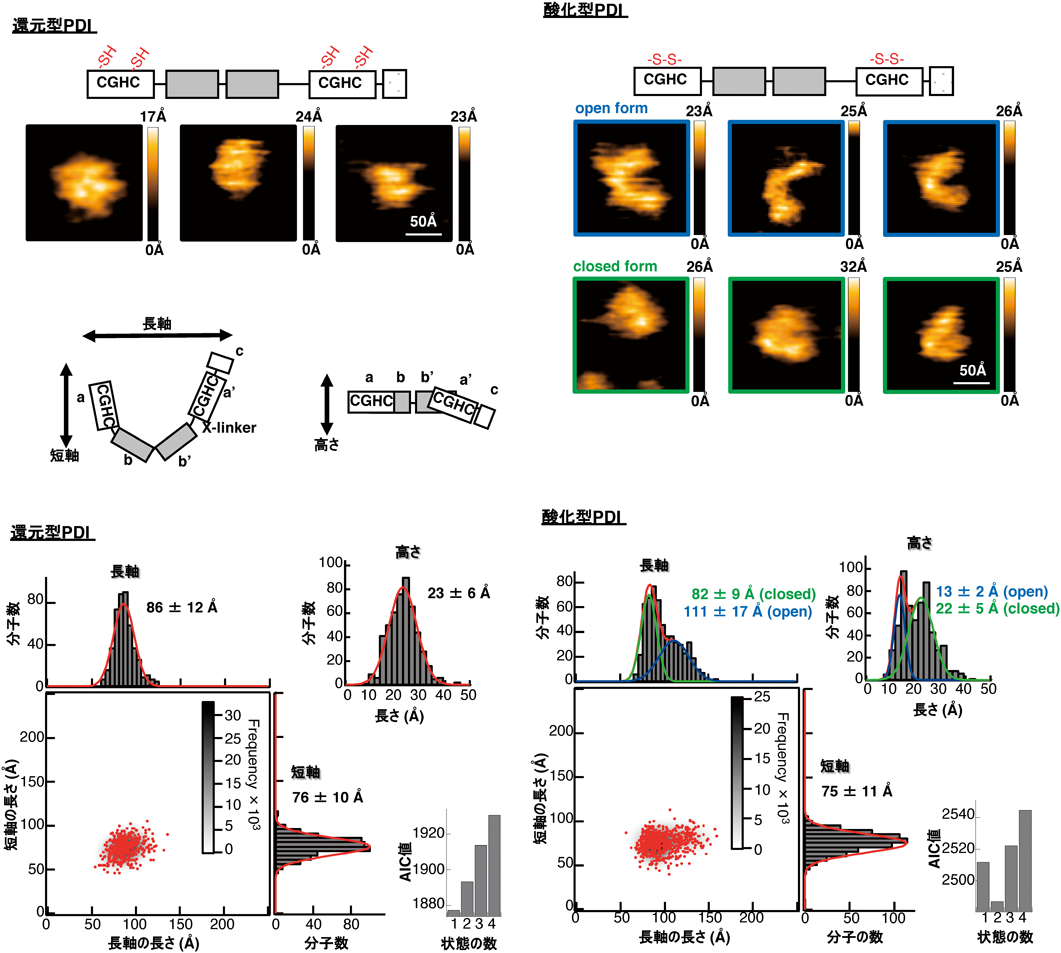
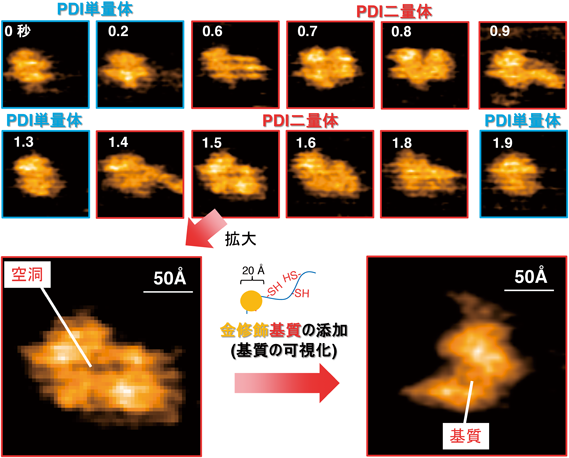
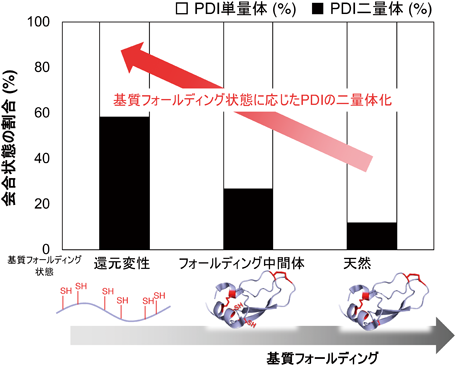
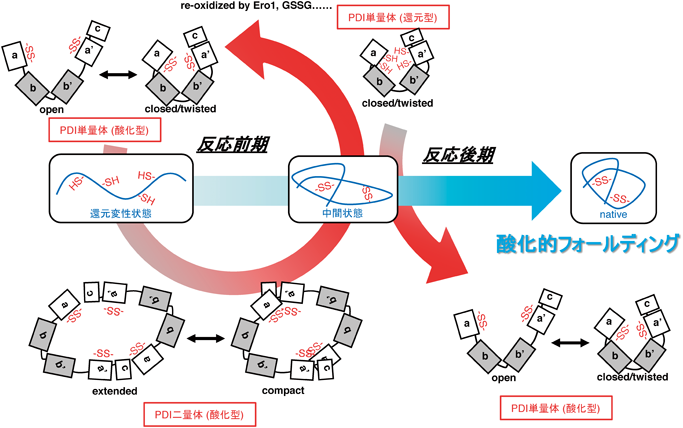
高速原子間力顕微鏡により明らかにされたプロテインジスルフィドイソメラーゼ(PDI)の構造ダイナミクスDirect observation of actions of Protein Disulfide Isomerase in catalysis of oxidative protein folding by high-speed atomic force microscopy
1 東北大学学際科学フロンティア研究所Frontier Research Institute for Interdisciplinary Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区片平二丁目–1–1 ◇ Aramakiaza Aoba 6–3, Aoba-ku, Sendai, Miyagi 980–8578, Japan
2 東北大学多元物質科学研究所Institute of Multidisciplinary Research for Advanced Materials, Tohoku University ◇ 〒980–8577 宮城県仙台市青葉区片平二丁目–1–1 ◇ Katahira 2–1–1, Aoba-ku, Sendai, Miyagi 980–8577, Japan