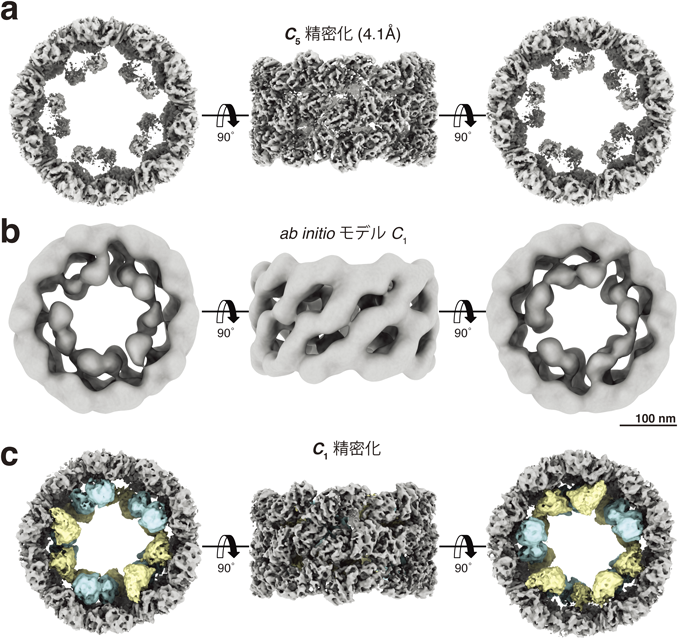
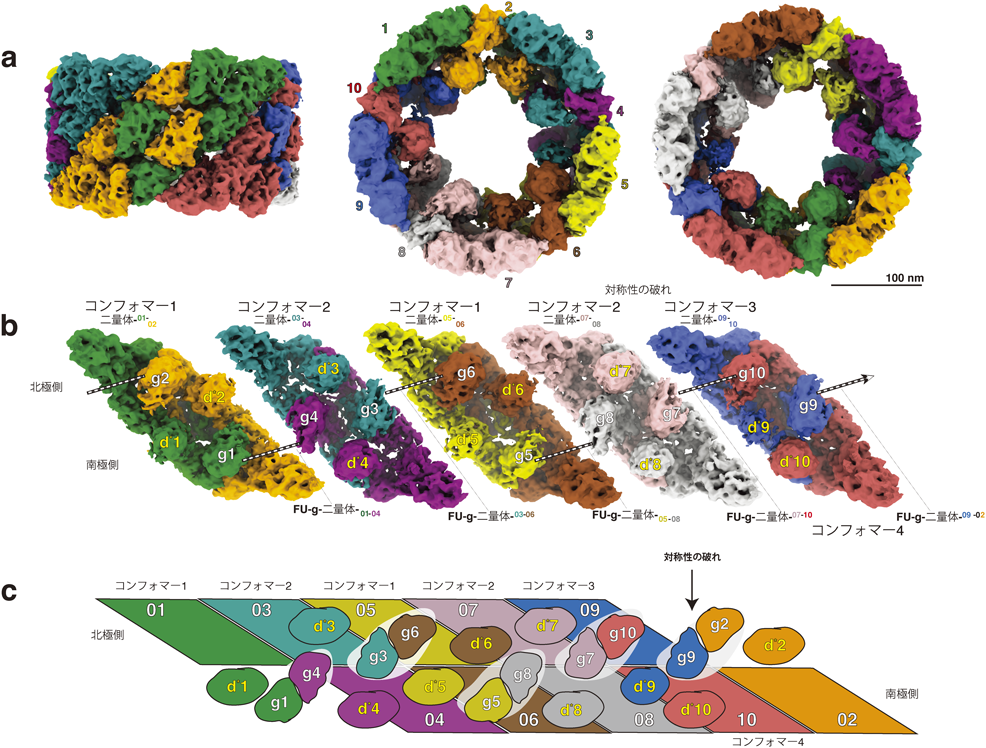
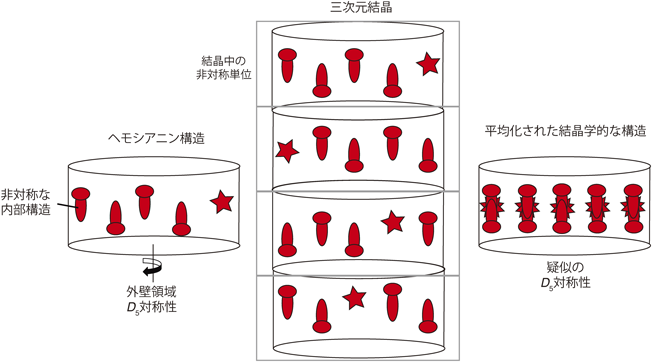
クライオ電子顕微鏡で明らかになった超巨大酸素運搬タンパク質ヘモシアニンの会合構造Three-dimensional reconstruction of 3.8 MDa respiratory protein complex Hemocyanin
1 北里大学理学部School of Science, Kitasato University ◇ 〒252–0373 神奈川県相模原市南区北里1–15–1 ◇ 1–15–1 Kitasato, Minami-ku, Sagamihara, Kanagawa, 252–0373 Japan
2 東北大学大学院生命科学研究科Graduate School of Life Sciences, Tohoku University ◇ 〒980–8577 宮城県仙台市青葉区片平2–1–1 ◇ 2–1–1 Katahira, Aoba-Ku, Sendai, Miyagi 980–8577 Japan
3 鹿児島大学水産学部Faculty of Fisheries, Kagoshima University ◇ 〒890–0056 鹿児島市下荒田4丁目50–20 ◇ 4–50–20 Shimoarata, Kagoshima, Kagoshima 890–0056 Japan