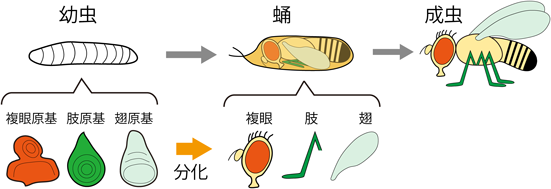
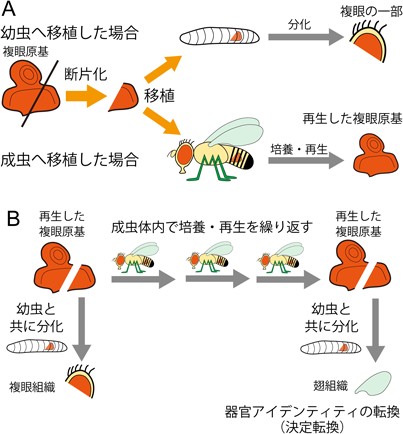
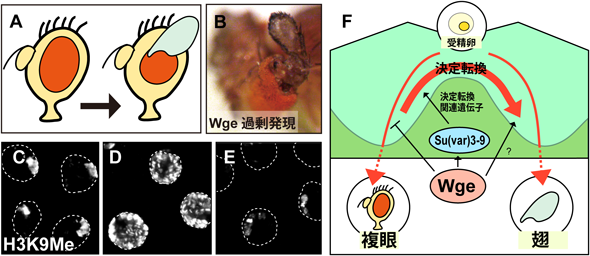
ショウジョウバエ成虫原基の器官運命決定転換におけるクロマチン制御機構Cell fate plasticity and chromatin regulations;a view from Drosophila imaginal disc transdetermination
増子 恵太*1,根本 和也,倉田 祥一朗Keita Masuko*1, Kazuya Nemoto, Shoichiro Kurata
東北大学大学院薬学研究科生命機能解析学分野Molecular Genetics, Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 ◇ Aoba 6–3, Aramaki, Aoba-ku, Sendai, Miyagi 980–8578, Japan
*1現所属;ノースカロライナ大学チャペルヒル校McKay研究室Department of Biology/Department of Genetics/integrative Program for Biological and Genome Sciences, The University of North Carolina at Chapel Hill; 250 Bell Tower Drive, 3344 Genome Science Bldg, Chapel Hill, NC 27599
発行日:2020年2月25日Published: February 25, 2020