大脳皮質のもつ高度な情報処理能力の基盤は複雑かつ精緻に構築された神経回路であり,その基本単位は軸索と樹状突起のシナプス結合である.発達期に神経回路が正確に形成されるためには,情報の送り手である神経細胞から伸びた軸索が標的となる脳領域に向かって正確に投射されるとともに,情報の受け手側の神経細胞が樹状突起を適切な軸索に対し選択的に展開しシナプスを形成することが必要である.樹状突起の形態は神経細胞が受ける入力の種類や性質を決め神経回路の働きを規定するものであり,それが発達期にどのように形成されるかを知ることは,神経回路の成熟メカニズムを理解するために不可欠である.
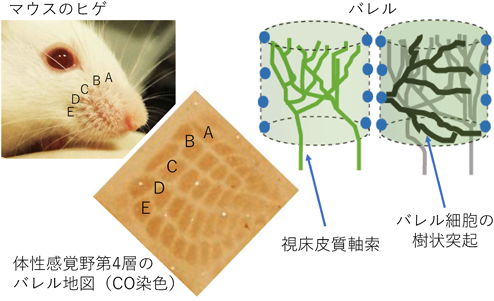
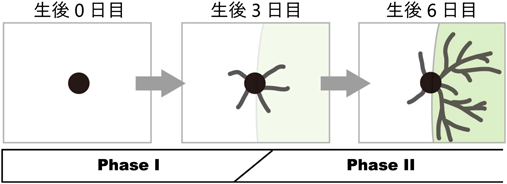
マウスやラットなどげっ歯類の大脳皮質一次体性感覚野に存在するバレル構造は,高等動物の神経回路の発達を理解するための優れたモデルである(図1)1).夜行性動物であるげっ歯類においてヒゲは主要な感覚器であり,ヒゲを激しく震わせて探る行動(whisking)によって周囲の環境を認識する.ヒゲからの体性感覚情報は脳幹と視床のシナプスを経由して,視床皮質軸索によって体性感覚野の第4層へと運ばれる.バレルはげっ歯類の体性感覚野第4層において,頬ヒゲと同じ配置をしており,それぞれのヒゲからの情報を大脳皮質へと伝える視床皮質軸索の終末は対応するヒゲごとにまとまってバレルの中心でクラスターを形成している.一方,情報の受け手である第4層のspiny stellate神経細胞(SS細胞,バレル細胞)の多くは細胞体をバレルの辺縁に配置しバレル壁を構成している.さらに,樹状突起をバレルの内側に選択的に展開し,視床皮質軸索とシナプスを形成することにより,1本のヒゲからの入力のみを選択的に受けることができる(図1)2).こうしたバレル構造の主要な特徴は生後1週間にヒゲからの入力依存的に形成される3–5).
二光子顕微鏡は哺乳類の脳の中を生きている状態で高解像度で観察することを可能とする顕微鏡であり,近年の神経科学の飛躍的な発展に貢献してきた6).二光子顕微鏡の主要な用途の一つとして神経回路が変化するようすの観察があるが,このような研究のほとんどはスパイン形態の変化を対象とするものであった7–9).スパインは樹状突起の興奮性シナプスにみられる棘状の構造であり,成体脳でも記憶・学習などシナプス可塑性に伴いその形態をダイナミックに変化させる.発達期の脳において典型的なスパインが観察されるのは樹状突起や軸索の形態がほぼ完成した後であり,マウス体性感覚野第4層の神経細胞では生後2週目以降である.
より早い時期に起きる軸索や樹状突起の形態変化を観察することは,技術的な難しさのため大きく遅れている.成体での観察で確立された手法の多くをそのまま幼若マウスに適用することはできず,新たな手法の開発が必要であった.たとえば,二光子顕微鏡で観察するためには頭蓋骨に観察窓や観察時に顕微鏡ステージに固定するためのチタンバーを取りつけるなどの手術が必要となる.これらの手法は成体では確立しているが,幼若マウスの頭蓋骨は成体と比較にならないほど軟弱であり,マウス自体も脆弱であるため,マウスの手術や取り扱いにデリケートな操作や工夫が要求される.軸索形態の変化に関しては少数の報告があり,最初期のものとして,Svobodaらによる大脳皮質第1層での視床皮質軸索とCajal-Retzius軸索の観察がある10).しかしながら,この解析ではシナプスを作る相手の細胞は同定されていないため,軸索の動態を回路形成の文脈で理解することにはつながっていない.特定の回路の形成との関連で軸索形態変化を解析した研究としては,テキサス大の西山らによるマウスの小脳登上線維での報告がある11).小脳の唯一の出力細胞であるプルキンエ細胞は生後まもない時期には複数の登上線維に支配されているが,発達の過程で1本のみが勝者となり複雑化し,他は敗者となり消失するという回路の精緻化が起きる.生後2週目[postnatal day(P)8~P11]から3週目までのタイムラプスイメージングによって,プルキンエ細胞の単一登上線維支配が確立する仕組みの一端が解明された.一方,樹状突起に関しては軸索と比較してもさらに研究が遅れており,我々のグループが2014年に報告したのが最初である4).本稿では,我々のグループによるマウス体性感覚野の第4層細胞での樹状突起形態変化のイメージングを中心に,生後発達期の神経回路形成に関する最近の研究を紹介する.
樹状突起イメージングのための技術的な課題として,樹状突起の形態の可視化が難しいことがあった.哺乳類の脳は細胞密度が高いため,一つの細胞の形態を詳細に観察するためには細胞をまばらに明るく蛍光標識する必要がある.細胞をまばらに標識することは成体でも難しく,そのためにさまざまな工夫がされてきた.よく用いられるものとして,Thy1プロモーターの制御下に蛍光タンパク質を発現する特殊なトランスジェニックマウス(Thy1-XFPマウス)がある12).このマウスは,興味深いことに系統によってまったく異なる発現パターンを示す.このことは,トランスジーンの挿入部位とThy1プロモーターの相互作用の効果と思われるが,特にYFP-H系統は大脳皮質第5層の細胞がまばらにYFP標識されるというきわだった特徴を示すことから,第5層錐体細胞のスパイン形態の解析に多大な貢献をしてきた7).しかしながら,この方法は偶然得られた系統の発現パターンの特徴に依存しており,ごく限られた脳領域・細胞にしか用いることができない.すなわち,任意の脳領域の神経細胞を狙うことはできず,たとえば,第4層の細胞をまばらに標識することはできない.他の標識方法としてシンドビスウイルスなどウイルスベクターの利用8, 13)があり,成体脳のような標的領域の同定が容易な場合には有力な方法となる.しかし,新生仔期の大脳皮質は厚みが日々劇的に増加しており,層の分離も不明瞭なため,成体のように脳表からの深さで層を同定することは難しい.したがって,特定の層の細胞を選択的に標識できないウイルスベクターでは,たとえば第4層の細胞に焦点を当てて解析することは困難である.
一方,大脳皮質の特定の層を選択的に標識する手法として,胎仔脳に電気穿孔法で遺伝子を導入する手法が近年広く用いられるようになってきた14–16).この手法では,遺伝子導入を行うタイミングを調節することによって特定の層の神経細胞を優先的に標識することができる.たとえば,胎生13~14日目[embryonic day(E)13~E14]で標識すると第4層の興奮性細胞が多く標識できる.しかし,この手法をそのまま用いると細胞標識の密度が高すぎて樹状突起の形態解析に用いることはできない.そこで標識密度を下げるためのさまざまな工夫がされたが,その多くはベクター濃度を薄め全体的に暗くし,比較的明るい一部の細胞を解析しようというものであり,バックグラウンドが高いという問題があった.一方,金沢大の河崎らはThy1プロモーターを改変したThy1Sの特徴を活かしたベクターを電気穿孔法で導入する手法(PASME法)によって,二光子顕微鏡in vivo観察に適したまばらで明るい標識を達成した17).しかしながら,Thy1Sプロモーターはそれ自体が細胞種特異性を示すため,すべての細胞に適用できるわけではない.さらには,細胞の標識密度を調節することができないため,用途が限られる.
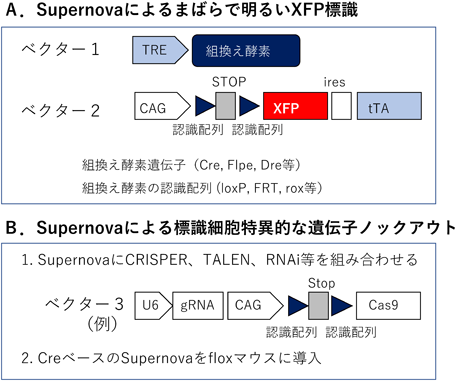
我々は電気穿孔法をベースとして,まったく新しい発想で,胎仔期から成体に至るまで,任意の領域の細胞を任意の密度で明るく標識することができる普遍的で簡便な手法として「Supernova法」4, 18)を開発した(図2A).テトラサイクリン発現誘導系では,tetracycline transactivator(tTA)が結合することによってtetracycline response element(TRE)は下流の遺伝子の発現を強く誘導するが,tTAがなければ発現はまったく誘導されない(はずである).しかし,実際はtTAがなくてもTREからの非常に弱い漏れが存在する.この漏れはシステムの弱点であり本来は歓迎されないものであるが,それを逆手にとって利用したのがSupernova法である.
Supernovaは基本ユニットとしてベクター1とベクター2から構成される4, 18).ベクター1では,TREの下流に組換え酵素(Cre, Flpe, Dre等)の遺伝子が配置されており,ベクター2では,ユビキタスプロモーター(CAGなど)の下流に組換え酵素の認識サイト(loxP, FRT, rox等)で挟まれたSTOP配列,そしてその下流に蛍光タンパク質とtTAの遺伝子が配置されている.この二つのベクターで電気穿孔を行うと,その時期に分裂した細胞の多くに両方のベクターが導入される.そのとき,ごく一部の細胞でのみベクター1の組換え酵素遺伝子の発現の漏れが閾値を超え,その細胞においてベクター2の少数のコピーでSTOP配列が除去されtTAが発現する.そして,それがベクター1のTREに結合し,組換え酵素の発現が強く誘導されることにより,ベクター2の多くのコピーでtTAが発現される,というベクター間でのtTA-TREポジティブフィードバックサイクルが引き起こされる.その結果,その細胞では非常に強く蛍光タンパク質が発現するが,それ以外の細胞では蛍光タンパク質の発現はなく,バックグラウンドが非常に低く抑えられる.ベクター1の濃度を変えることによって,最初に閾値を超える細胞の数を調節でき,細胞標識密度を自在に変えられることが,このシステムの大きな強みである18).さらに,基本ユニットが細胞種を選ばないことから,細胞種特異的プロモーターを組み合わせることによって,細胞種特異性を付与することも容易である19).なお,遺伝子導入には電気穿孔法だけでなくadeno-associated virus(AAV)ベクターなど他の方法も自由に使えるため18),原理的にすべての脳領域,体の部位に適用できる,きわめて汎用性の高い手法である.
3. 大脳皮質における樹状突起精緻化ダイナミクスのタイムラプスイメージング
正確な回路形成には,神経細胞が樹状突起を適切な軸索に向けて展開することが必要だが,そのメカニズムを研究する上でバレル細胞は唯一無二の特長を有している.成熟したマウス体性感覚野の第4層では,1本のヒゲからの入力を伝える一群の視床皮質軸索の終末が1個のバレルの中心にまとまって投射するというきわだった特徴を示す.一方,情報を受ける側のバレル細胞の多くはバレルの縁に細胞体を配置しているため,バレル細胞は樹状突起をバレルの内側だけに選択的に非対称的に配置することによって,正確な回路を作ることができる(図1).すなわち,樹状突起が適切な軸索に向かって展開しているかどうかを,樹状突起のバレル内側への方向性として定量的に解析することが可能である.このバレル細胞の樹状突起が示す高度な非対称性は,ヒゲとバレルの機能的な1対1対応の基盤であり,生後1週間に,視床を経由した末梢からの入力による樹状突起精緻化を経て形成される.
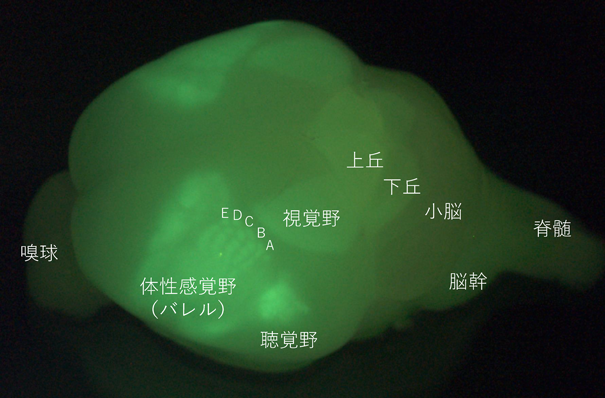
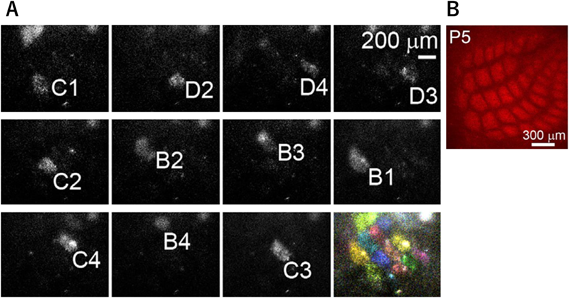
我々は,電気穿孔法を用いて胎生14日目のマウスにSupernovaベクターセットを導入し,体性感覚野第4層の興奮性神経細胞をまばらに標識し,生後5日目(P5)で二光子顕微鏡を用いて樹状突起形態を観察した.そして,4時間半後,9時間後,18時間後に同じ神経細胞の観察を繰り返し,樹状突起の形態変化を観察した4).この実験のために視床皮質軸索(thalamocortical axon:TCA)の終末でenhanced green fluorescent protein(EGFP)を発現するトランスジェニックマウス(TCA-GFPマウス)が作製されたことは特筆すべきである.TCA-GFPマウスは,セロトニントランスポータープロモーターの下流に膜移行型のEGFPを発現するBACトランスジェニックマウスであり,これを用いることにより,生きたマウスでバレルを可視化することが初めて可能となった(図3).
ところで,体性感覚野第4層の興奮性神経細胞は尖端樹状突起を持たないspiny stellate(SS)細胞と,尖端樹状突起を持つstar pyramid(SP)細胞および錐体細胞に分類される20–22).SS細胞は第4層興奮性神経細胞の大半を占める細胞であり,別名バレル細胞と呼ばれる.バレル細胞は樹状突起を1個のバレルの中だけに展開するというきわだった特徴を示し,多くが細胞体をバレルの縁に配置することから,その樹状突起はバレル中心に向いた強い非対称性を示す.一方,SP細胞や錐体細胞の基底樹状突起は細胞体の位置にかかわらず,特定の方向性を持たず放射状に展開することから,本解析からは除外された.
P5のイメージングのデータを,バレル細胞の大半を占めるバレルの縁に細胞体のあるものに焦点を当てて解析を行った結果,18時間にわたる観察中に,細胞全体として樹状突起のバレル中心への非対称性が有意に増加した.一方,個々の樹状突起の先端に注目して解析すると,バレルの内側でも外側でも伸びるものも縮むものも存在した4).従来,バレル細胞の樹状突起のバレル中心への方向性は,バレルの内側にある樹状突起が成長し複雑化する一方で,バレルの外側の樹状突起が刈り込みによって失われることによって形成される,とシンプルに語られてきた.しかし,実際はそのように単純なものではなく,バレルの内側でも外側でも樹状突起の先端は伸びたり縮んだり,枝を作ったり消したり,試行錯誤を繰り返しながら,全体として,適切な軸索の集まるバレル内側への方向性を増大させていることが示唆された.なお,発達に伴う樹状突起の形態ダイナミクスは,これまでオタマジャクシやゼブラフィッシュ稚魚など透明な動物で観察されたことはあるが23, 24),哺乳類での観察はこれが初めての報告である.
4. 樹状突起精緻化の長期間タイムラプスイメージング
バレル細胞の樹状突起はP5ですでにバレル内側への強い方向性を示す.したがって,P5から18時間のイメージングでは,樹状突起の方向性がどのように形成されるのかについては答えることができない.その問題を扱うためには,もっと早い発達段階からのもっと長期のイメージングが必要となる.
バレル中心での視床皮質軸索のクラスターが見え始めるP3ごろにバレル細胞の樹状突起方向性が形成され始めると想定して,P3からP6までの3日間にわたる長期イメージングに挑戦した.そのために技術的にクリアすべき問題として,P3のマウスはP5と比較して頭蓋骨がさらに柔らかく,手術の難度が格段に上がることがあった.同様に難しいのが,3日間のイメージングのためにはイメージングの合間の仔マウスに母親マウスや里親マウスの世話を受けさせる必要があるが,出産間もない時期の母親マウスは不安定であり,観察窓や顕微鏡に固定するためのチタンバーを頭につけた仔マウスは,多くの場合母親マウス(里親マウスを含む)に食殺されたり育児放棄されてしまうことである.この問題を,母親マウスを刺激しないようにチタンバーを小型化すること,および,寛容な母親マウスを選別して使用するなどのきめ細かな対応により解決した.その結果,手術を受けた仔マウスの大半が母親マウスの育児を受けながら正常に成長できるようになった.
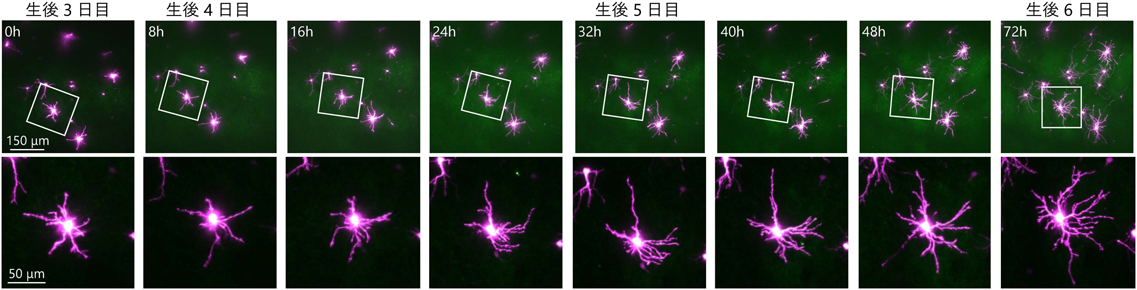
この手法で,体性感覚野第4層の同じ神経細胞の形態を,P3からP5まで8時間ごとにイメージングし,その後,24時間後にP6でもう一度イメージングすることを行った(図4)25).イメージングに用いたマウスの体重は順調に増加し,P6で同腹仔マウスと比較して違いがみられなかった.さらに,P3で手術を受けた後3日間にわたってイメージングに用いたP6マウスと通常に成長したP6マウスで第4層細胞の樹状突起の長さを比較したところ同等であった25).これらの結果は,二光子顕微鏡での長期イメージング自体がマウスおよび神経細胞樹状突起の発達に顕著な悪影響を与える可能性を排除するものである.
長期イメージングのデータ解析を始めるにあたり,最初に,P3の段階のバレル細胞の樹状突起形態に着目した.前述のとおり,体性感覚野第4層の興奮性神経細胞にはバレル細胞とSP細胞があり,尖端樹状突起の有無で区別されている.しかしながら,最近の報告で,マウスの体性感覚野やフェレットの視覚野の第4層細胞の形態を生後の早い発達段階で組織学的に観察したところ,すべての細胞が尖端樹状突起を持っていることが示され,バレル細胞も最初は尖端樹状突起を持っていることが示唆された26).実際に我々のデータでもP3の段階ではほとんどの第4層細胞は尖端樹状突起を有していた25).このことは,組織学などの手法でP3など早い発達段階の一時点を観察するだけではバレル細胞とSP細胞を区別できないことを意味する.一方,我々の長期イメージングでは,P3からP6の間に約8割の細胞で尖端樹状突起が退縮するのに対し,残りの約2割では尖端樹状突起が保持されることが観察され,前者がバレル細胞,後者がSP細胞と区別できた25).このことは,「バレル細胞は最初は尖端樹状突起を持っているが,発達に伴い退縮し消失する」という仮説を直接的に証明するものであると同時に,P3など早い段階でバレル細胞とSP細胞を区別し解析することが初めて可能となったことを意味する.
さらに,P3はバレルがまだ不明瞭な発達段階であり,組織学的解析など一時点の解析では樹状突起の方向性の議論が難しい.しかしながら,我々の長期イメージングデータを用いることにより,P6の明瞭なバレル形態の情報をもとに,P3での樹状突起とバレルの関係を遡及的に解析することも可能となった.
こうした準備状況の上に,P6の段階でバレルの縁にあることが示されたバレル細胞の,P3段階での樹状突起の方向性を解析したところ,予想外のことがわかった.すなわち,P3はバレル形成の最初期であるにもかかわらず,長い尖端樹状突起を持つ(将来の)バレル細胞が(将来の)バレル内側への樹状突起方向性をすでに有していることが示された.このことは,バレル細胞は尖端樹状突起を失うことによってSP細胞と分離してバレル細胞となるわけではなく,長い尖端樹状突起を持っている段階ですでにバレル細胞としての性質を有していることを意味する.バレル細胞とSP細胞が最初から別の細胞なのか,それとも,P3以前に分かれるのかは今後の課題である.
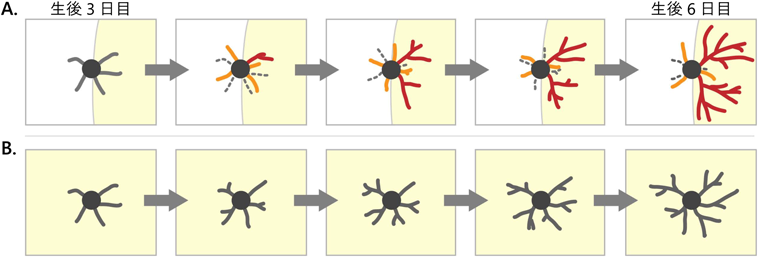
ただし,重要なこととして,P3のバレル細胞が示すバレル内向きの方向性と,P6のバレル細胞が示す内向き方向性は質的に違うものであることが明らかになった.細胞体から生えている一次樹状突起とそこから枝分かれしてできる樹状突起の全体を1本の木になぞらえて樹状突起ツリー(dendritic tree)と呼ぶ.その単位に着目し解析したところ,P3のバレル細胞は,バレルの内にも外にも似たような形の単純で短いdendritic treeを有しているが,バレル内側の方が本数が多かった.すなわち,P3でみられる樹状突起の内向き方向性はバレル内外でのdendritic treeの複雑さの違いではなく,本数の違いによって生じていた(図5).一方,P3とP6を比較すると,バレルの内でも外でもdendritic treeの本数が顕著に変化することはないが,P6では内側にのみ長く複雑なdendritic treeが存在することがわかった.すなわち,生後1週間に起きるバレル細胞の樹状突起方向性形成には少なくとも二つのフェーズがある(図5).細胞移動が完了したP0からP3ごろがPhase Iであり,この時期にシンプルなdendritic treeが作られるが,それがバレルの外側よりも内側に多く作られる.P3からP6ごろがPhase IIであり,この間にはdendritic treeの数はバレルの内外ともに大きく変化することはないが,内側の一部が非常に長く複雑になることによって内向き方向性が増大する.
それでは,Phase IIにあたるP3からP6の間に樹状突起方向性はどのように増大するのであろうか.単純に考えると,P0からP3のPhase Iの間に形成された未熟なdendritic treeのうち,バレルの内側に生えたものの一部が複雑化するが他は単純なままとどまることが想定される.しかしながら,実際に8時間ごとに撮影された樹状突起の形態変化を解析したところ,まったく,異なる様相が明らかとなった.すなわち,P3とP6でdendritic treeの総数はあまり変わらないにもかかわらず,個々のdendritic treeに注目すると多くのものが作られてはすぐに消えるというターンオーバーを繰り返していることが明らかとなった.その中から,一部のdendritic treeがターンオーバーを抜け出し,勝者となって複雑化する(図6A).重要なこととして,勝者になるdendritic treeはバレル内側に優先的に出現する.バレル細胞では複数の樹状突起が勝者となりうるが,決して早いもの勝ちではなく,後で生まれたものから勝者が出現することもあることが明らかとなった.なお,dendritic treeのターンオーバーという現象は,筆者らの知る限りこの研究での報告が最初である.
これらの結果は,バレル細胞の樹状突起方向性はdendritic treeのターンオーバーと選択的な複雑化によって獲得・増強されていくことを示している.つまり,神経細胞は最初から特定の方向にdendritic treeを作ったり伸ばしたりするのではなく,いろいろな方向に作ってみて,たまたま正しい方向に生えた(おそらく適切な軸索とシナプスを作れた)dendritic treeを選択し,安定化・複雑化させるという試行錯誤を繰り返しながら,細胞全体として特定の方向に樹状突起を展開していくという動的メカニズムが明らかとなった(図6A).
生まれたばかりのげっ歯類(マウス,ラット)は目が見えず,耳も聞こえない.一方,ヒゲは出生時にはすでに生えそろっており,ヒゲの感覚があることもわかっている.しかしながら,ヒゲを激しく震わせながら周囲の環境を探るwhisking行動を始めるのは2週目以降であり,2週目でみられるような能動的なヒゲ感覚は生後1週目にはない.生後1週目のヒゲ感覚は受動的なものに限られ,たとえば,床や壁,兄弟や母親マウスとの接触によるものである27).また,新生仔ラットで睡眠時にヒゲが自発的に動くことも観察されていて,その感覚が脳に伝わることも報告がある28).
生後発達早期の感覚野にみられる神経活動として,感覚刺激に依存せず体の中で自発的に発生する“自発活動”も重要である.こうした発達期特異的な自発活動の理解は視覚系での研究に先導されてきた.開眼前の網膜を培養すると自発的に神経活動が発生し,網膜内を波状に伝播することが古くから知られているが29, 30),それが実際にin vivoでも存在し,網膜神経節細胞の軸索によって上丘,および視床を経由して視覚野に伝達されることが,幼若マウス脳の二光子顕微鏡および広視野カルシウムイメージングや幼若ラットの電気生理学実験によって最近明らかになった31–33).聴覚系でも,聴覚がまだ発達していない段階の幼若動物から内耳の蝸牛を摘出し培養すると自発的に神経活動が発生する.そうした自発活動が生体で聴覚野や下丘に伝達され,周波数帯に対応したバンド状のパターンを示すことが,最近,幼若マウスを用いた広視野カルシウムイメージングで示された34, 35).
一方,体性感覚野でも,新生仔期の視床や大脳皮質に同期した自発活動があることが示されていたが,その時空間的パターンはよくわかっていなかった36, 37).最近我々は,カルシウムセンサーGCaMP6sを子宮内電気穿孔法によって体性感覚野の第4層に密に発現させ,二光子顕微鏡を用いた機能的イメージングを行うことにより,新生仔期の体性感覚野の自発活動がパッチワーク型の空間パターンを持つことを明らかにした(図7)38).バレルをRFPで標識するTCA-RFPトランスジェニックマウスを作製・使用したところ,一つ一つのパッチ,すなわち,同時に活動する領域がバレルとぴったり一致することが示された38).このことは,新生仔マウスの体性感覚野では,ヒゲを刺激していないにもかかわらず,あたかも何かがヒゲの1本1本に個別に触れたかのように,バレルの1個1個が発火していることを示す.次に,Supernova法を用いてGCaMP6sを第4層細胞にまばらに発現させて個々の細胞の発火を調べると,同じバレルに属する細胞は同期し,別のバレルに属する細胞はまた別の同期をすることがわかった.さらに,視床皮質軸索でGCaMP6sを発現するマウスを作製・使用して解析したところ,パッチワーク型の活動は視床皮質軸索によって大脳皮質へと伝達されることがわかった.重要なこととして,この自発活動はバレル形成中であるP5で観察されるが,バレル完成後のP11ではみられない.P11の体性感覚野ではバレルと無関係に神経細胞はばらばらの発火をしていた38).これらの特徴は,このパッチワーク型の自発活動が体性感覚系の回路精緻化に重要な役割を担うことを期待させる.
生後発達早期にみられる特徴的な時空間パターンを持つ自発活動の発生機序や回路精緻化での重要性は,視覚系や聴覚系では比較的よく研究されている39).たとえば,網膜の波状自発活動は生後1週目にあたるステージ2ではアセチルコリン受容体が重要な役割を担っており,網膜スターバーストアマクリン細胞(SAC)特異的にニコチン作動性アセチルコリン受容体β2サブユニット(β2-nAcR)をノックアウトすると,ステージ2の自発活動の時空間パターンが障害される.また,通常のマウスでは右眼と左眼から視床や上丘に投射する軸索は出生時には大きく重なる領域に投射しており,生後発達の早い時期に分離するようになるが,ノックアウトマウスではこの両眼投射の分離が障害される40).
一方,体性感覚野で発見されたパッチワーク型自発活動の発生機序や回路形成における重要性は今後の課題である.さらなる研究によって,発生源と発生メカニズムが明らかになれば,パッチワーク型自発活動の操作が可能となり,重要性の解明につながることが期待される.
7. 体性感覚野回路の精緻化における神経活動の役割
バレル細胞の樹状突起の方向性確立を含む体性感覚野神経回路の精緻化に,ヒゲからの入力が重要であることは古くから多くの証拠で示されている41–43).最近では,遺伝学的手法により,視床皮質入力を特異的に止めることが行われた.発達期の感覚系視床に特異的に発現する遺伝子であるセロトニントランスポーターのプロモーターの制御下にCre組換え酵素を発現するマウスを用いて,視床でのVgluT1/VgluT2のダブルノックアウトマウスが作製された.これらのマウスでは視床皮質軸索から第4層細胞への入力が大幅に減少する.それに伴い,バレル構造の形成が完全に障害された44).また,視床特異的Rab interacting molecule(RIM)1/2のノックアウトマウスも作製されたが,このマウスでも視床皮質入力が阻害される45).このマウスはVgluT1/VgluT2ダブルノックアウトより表現型はマイルドであり,バレルのプレシナプス要素である視床皮質軸索のクラスターはある程度形成されるが,ポスト側要素である第4層神経細胞のバレル壁への集積は完全になくなる.この状態のマウスのバレル細胞の樹状突起形態が解析されたが,非対称性が大きく減少していた.この結果は,樹状突起の方向性獲得は視床皮質軸索に由来する神経活動により引き起こされる現象であることを強く示唆する.
古典的には,ヒゲの一部を電気焼灼する方法とともに,ヒゲと三叉神経節を結ぶ眼窩下神経(infraorbital nerve:ION)を外科的に切断する手法が,神経活動を止める方法として広く用いられてきた.出生後間もない時期にこれらの操作を行うと,バレル形成に大きな異常がみられる41, 46, 47).しかし,我々は最近,ION切断に違った意味を与える実験結果を得た.
我々は視床皮質軸索末端でGCaMP6sを発現するトランスジェニックマウス38)を用い,そのIONをP0で切断し,P5でバレルのin vivoカルシウムイメージングを行った25).すると,予想と反して,IONを切断しても視床皮質軸索を経由して伝えられる自発活動は残っており,正常マウスとION切断マウス間で活動頻度に大きな違いはみられなかった.一方,ION切断マウスでは自発活動のパッチワークパターンが壊れ,発火のバレルごとの分離がなくなり互いに重なっていた.すなわち,出生直後のヒゲからの入力は自発活動の発生には必要ないが,自発活動へのパッチワークパターンの付与に必須である.
P0でIONを切断したマウスを用いて,生後3日目から6日目の長期イメージングを行ったところ,dendritic treeのターンオーバーの頻度が著しく低下しており,個々のdendritic treeの形態は全体的に平均的な複雑さになっていた25)(図6B).このことは,正常マウスにおいてバレルの縁に位置するバレル細胞では,複数のdendritic treeの間でその複雑さに大きな格差があり,大部分はシンプルな形態を持つ中で,ごく一部のものが非常に複雑になっている(図6A)ことと対照的である.
P0でIONを切断したマウスでは自発活動のパッチワーク型パターンが失われるが,この状態をバレル細胞の側からみると,本来はバレル内側という一方向でしか適切な視床皮質入力を受けることができないのに対して,このマウスのバレル細胞はあらゆる方向から同期した視床皮質入力を受けられる状態になっているとみることができる(図6).つまり,正常マウスとION切断マウスの違いは,バレル細胞への視床皮質入力の有無ではなく,視床皮質入力の空間的偏りの有無であるということが示唆された(図6).
ところで,正常マウスでは,バレル細胞の多くは細胞体をバレルの縁に配置するが,少数ながら細胞体がバレルの中心にあるバレル細胞も存在する.そうした細胞はすべての方向から同期した視床皮質入力を受けられる状態と考えられる.もし,上記の仮説が正しければ,バレルの中心に存在するバレル細胞とION切断をしたときのバレル細胞は,似た樹状突起ダイナミクスを示す可能性がある.そのことを,検証するためにバレル中心に位置するバレル細胞でP3からP6の長期樹状突起イメージングを行ったところ,予想どおり,dendritic treeのターンオーバーの低下と全体的に中程度の樹状突起の複雑さという,ION切断時の細胞と同様の特徴を示した(図6B).これらの結果は,神経入力の空間的偏りが樹状突起の成長様式に影響を与えるという考えを支持するものである.
視床皮質入力の操作やION切断,ヒゲの電気焼灼などは回路全体に非常に大きな異常を引き起こすので,検出された異常が神経活動操作による直接の影響なのか間接的なものか解釈が難しいという問題がある.それに対して,大脳皮質の神経細胞の一部の細胞でだけ目的の遺伝子をノックアウトする手法が最近開発され,それを用いることにより,よりエレガントな解析ができるようになった.大脳皮質の細胞をまばらにノックアウトする手法としてmosaic analysis with double markers(MADM)と呼ばれる手法が報告され48),それを用いてNMDA型グルタミン酸受容体のNR2Bサブユニットのノックアウトが作製された3).脳全体や大脳皮質全体でNMDA受容体の機能が失われるとバレル形成に大きな異常が生じるが49–52),MADMを用いて少数の細胞でノックアウトしたマウスでは当然のこととしてバレルは正常に形成される.一方,ノックアウト細胞の形態を組織学的に解析したところ,樹状突起の内向き方向性が大きく減少することが明らかにされ,樹状突起精緻化におけるNMDA受容体の細胞自律的な役割が示された.MADMはエレガントな方法であるが,樹状突起形態の解析では蛍光強度を上げるため抗GFP抗体での免疫染色が用いられている3).さらに,この手法を用いるためには,標的とする遺伝子のノックアウトマウス,標的遺伝子の位置する染色体ごとに2種類のトランスジェニックマウス(GRマウス,RGマウス),さらに,目的とする脳領域特異的なCreマウスの4種類を準備して交配する必要があり,マウス飼育スペース,費用,時間が膨大にかかるという弱点がある.
一方,我々は,脳の細胞をまばらにノックアウトできる簡便で普遍的なシステムを開発した.前述のSupernova法がそれであり,任意の密度で細胞を明るく蛍光標識するとともに,標識細胞特異的に目的の遺伝子をノックアウトすることができる(図2B).ノックアウトには,CRISPR/Cas9やTALENを用いることも可能だが18),NMDA受容体の必須サブユニットNR1のノックアウトにはNR1-floxマウスと組み合わせる手法が用いられた4).このマウスではバレルは正常に形成されるが,NR1がノックアウトされたバレル細胞で,NR2Bノックアウト細胞と同様に,樹状突起のバレル内向きの方向性が減弱した4).一方,二光子顕微鏡を用いてP5から18時間にわたってNR1ノックアウト細胞の樹状突起ダイナミクスを観察したところ,バレルの内側でも外側でも正常細胞と比較して樹状突起が激しく伸縮することがわかった4).適切な視床皮質軸索はバレルの内側にのみ存在するので,バレル内側の樹状突起にできたシナプスでNMDA受容体を介したシグナル伝達が起きると,それが局所的に働いてその樹状突起を複雑化させると同時に,細胞全体にも作用して樹状突起の安定化に働くと考えられる.一方,NMDA受容体がなければ,バレル内側の樹状突起が視床皮質軸索からシナプス入力を受けても,適切な細胞内カスケードが惹起されないことにより,P5になっても樹状突起は不安定なまま高いダイナミクスを保ち続け,その結果として適切な入力のあるバレル内側だけでなく外側でも樹状突起を複雑化させてしまうと考えられる.この時期のバレル細胞には典型的なスパインはみられないので,NMDA受容体を持つシナプスが樹状突起のどこにあり,それが,どのような細胞内シグナルを介して樹状突起ダイナミクスを制御しているかは今後の課題である.
本稿では,筆者らが最近開発に成功した,新生仔マウスのin vivoイメージング技術を用いて行った体性感覚野の解析を中心に,大脳皮質神経回路の生後発達機構,特に樹状突起の精緻化について紹介した.今回,我々は3日間の撮影を8時間ごとに行ったが,その間の樹状突起の形態変化は我々の当初の予想を超えて大きく,多くのことを見落としている可能性がある.今後はin vivoでの撮影をさらに短い間隔で行い,より詳細な現象を観察したい.そして,そこに関わる神経入力や分子の可視化,それらの局所的な賦活/抑制を行うことで神経活動や分子の機能と樹状突起動態の因果関係を明らかにしたい.
大脳皮質の急性スライス観察では,視覚野第5層興奮性神経細胞の伸長する樹状突起の先端において(一般に軸索の先端でみられるような)成長円錐様の構造が観察されている53).また,小脳プルキンエ細胞の分散培養系では樹状突起のダイナミクスと,ミトコンドリアやゴルジ体といった細胞小器官の動態の同時観察が行われ,伸展している樹状突起の先端近くにはミトコンドリアが局在しており,ATPを介してアクチン骨格の成長を促進していることが報告されている54, 55).今後は,組織培養で培われてきた定量・数理的アプローチ56)をin vivoでの細胞,ひいては回路へと拡大し,その形成原理へ迫っていくことが可能となるだろう.空間・時間解像度を上げることが容易な組織培養系と,生理的な環境下での振る舞いを観察できるin vivoの知見は,相互に影響を与え合い分野の発展を強力に促進していくことが期待される.
また,他動物との比較も有用である.ゼブラフィッシュの視覚系を用いた研究では,樹状突起が枝分かれを作る際には枝分かれ部位にまずPSD-95が集積することが示された57).また,オタマジャクシの視覚系では,樹状突起の伸展にAMPA受容体,NMDA受容体が関わっていることが示されている58, 59).こうした研究で得られた知見と,哺乳類脳での知見を統合することにより,樹状突起のダイナミクスと各分子の局在の関係,神経活動依存的な回路構築機構を,進化的な観点からも論ずることができるかもしれない.
謝辞Acknowledgments
本稿で紹介した筆者らの研究は,研究室内外の多くの共同研究者とともに行われたものであり,ここに感謝いたします.特に,遺伝研での研究室立ち上げ当初から助教として参加し,二光子顕微鏡システムのセットアップと維持に多大な貢献をしてくれた水野秀信博士(現,熊本大学特任准教授),水野博士とともにSupernovaシステムの開発に貢献してくれた羅ブンジュウ博士(現,チューリッヒ大学ポスドク),多数のマウス系統を適正に管理・供給してくれた佐藤拓也氏に,深く感謝いたします.科学研究費新学術領域研究「スクラップ&ビルドによる脳機能の動的制御」のご支援にお礼申し上げます.
引用文献References
1) Woolsey, T.A. & Van der Loos, H. (1970) The structural organization of layer IV in the somatosensory region (SI) of mouse cerebral cortex. The description of a cortical field composed of discrete cytoarchitectonic units. Brain Res., 17, 205–242.
2) Woolsey, T.A., Dierker, M.L., & Wann, D.F. (1975) Mouse SmI cortex: qualitative and quantitative classification of golgi-impregnated barrel neurons. Proc. Natl. Acad. Sci. USA, 72, 2165–2169.
3) Espinosa, J.S., Wheeler, D.G., Tsien, R.W., & Luo, L. (2009) Uncoupling dendrite growth and patterning: single-cell knockout analysis of NMDA receptor 2B. Neuron, 62, 205–217.
4) Mizuno, H., Luo, W., Tarusawa, E., Saito, Y.M., Sato, T., Yoshimura, Y., Itohara, S., & Iwasato, T. (2014) NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron, 82, 365–379.
5) Rice, F.L. & Van der Loos, H. (1977) Development of the barrels and barrel field in the somatosensory cortex of the mouse. J. Comp. Neurol., 171, 545–560.
6) Svoboda, K. & Yasuda, R. (2006) Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron, 50, 823–839.
7) Grutzendler, J., Kasthuri, N., & Gan, W.B. (2002) Long-term dendritic spine stability in the adult cortex. Nature, 420, 812–816.
8) Lendvai, B., Stern, E.A., Chen, B., & Svoboda, K. (2000) Experience-dependent plasticity of dendritic spines in the developing rat barrel cortex in vivo. Nature, 404, 876–881.
9) Pan, F. & Gan, W.B. (2008) Two-photon imaging of dendritic spine development in the mouse cortex. Dev. Neurobiol., 68, 771–778.
10) Portera-Cailliau, C., Weimer, R.M., De Paola, V., Caroni, P., & Svoboda, K. (2005) Diverse modes of axon elaboration in the developing neocortex. PLoS Biol., 3, e272.
11) Carrillo, J., Nishiyama, N., & Nishiyama, H. (2013) Dendritic translocation establishes the winner in cerebellar climbing fiber synapse elimination. J. Neurosci., 33, 7641–7653.
12) Feng, G., Mellor, R.H., Bernstein, M., Keller-Peck, C., Nguyen, Q.T., Wallace, M., Nerbonne, J.M., Lichtman, J.W., & Sanes, J.R. (2000) Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron, 28, 41–51.
13) Furuta, T., Tomioka, R., Taki, K., Nakamura, K., Tamamaki, N., & Kaneko, T. (2001) In Vivo Transduction of Central Neurons Using Recombinant Sindbis Virus. J. Histochem. Cytochem., 49, 14976–14508.
14) Fukuchi-Shimogori, T. & Grove, E.A. (2001) Neocortex patterning by the secreted signaling molecule FGF8. Science, 294, 1071–1074.
15) Saito, T. & Nakatsuji, N. (2001) Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol., 240, 237–246.
16) Tabata, H. & Nakajima, K. (2001) Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience, 103, 865–872.
17) Ako, R., Wakimoto, M., Ebisu, H., Tanno, K., Hira, R., Kasai, H., Matsuzaki, M., & Kawasaki, H. (2011) Simultaneous visualization of multiple neuronal properties with single-cell resolution in the living rodent brain. Mol. Cell. Neurosci., 48, 246–257.
18) Luo, W., Mizuno, H., Iwata, R., Nakazawa, S., Yasuda, K., Itohara, S., & Iwasato, T. (2016) Supernova: A Versatile Vector System for Single-Cell Labeling and Gene Function Studies in vivo. Sci. Rep., 6, 35747.
19) Lin, R., Wang, R., Yuan, J., Feng, Q., Zhou, Y., Zeng, S., Ren, M., Jiang, S., Ni, H., Zhou, C., et al. (2018) Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat. Methods, 15, 1033–1036.
20) Lübke, J., Egger, V., Sakmann, B., & Feldmeyer, D. (2000) Columnar organization of dendrites and axons of single and synaptically coupled excitatory spiny neurons in layer 4 of the rat barrel cortex. J. Neurosci., 20, 5300–5311.
21) Simons, D.J. & Woolsey, T.A. (1984) Morphology of Golgi-Cox-impregnated barrel neurons in rat SmI cortex. J. Comp. Neurol., 230, 119–132.
22) Staiger, J.F., Flagmeyer, I., Schubert, D., Zilles, K., Kotter, R., & Luhmann, H.J. (2004) Functional diversity of layer IV spiny neurons in rat somatosensory cortex: quantitative morphology of electrophysiologically characterized and biocytin labeled cells. Cereb. Cortex, 14, 690–701.
23) Jontes, J.D., Buchanan, J., & Smith, S.J. (2000) Growth cone and dendrite dynamics in zebrafish embryos: early events in synaptogenesis imaged in vivo. Nat. Neurosci., 3, 231–237.
24) Wu, G.Y. & Cline, H.T. (2003) Time-lapse in vivo imaging of the morphological development of Xenopus optic tectal interneurons. J. Comp. Neurol., 459, 392–406.
25) Nakazawa, S., Mizuno, H., & Iwasato, T. (2018) Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nat. Commun., 9, 3106.
26) Callaway, E.M. & Borrell, V. (2011) Developmental sculpting of dendritic morphology of layer 4 neurons in visual cortex: influence of retinal input. J. Neurosci., 31, 7456–7470.
27) Akhmetshina, D., Nasretdinov, A., Zakharov, A., Valeeva, G., & Khazipov, R. (2016) The Nature of the Sensory Input to the Neonatal Rat Barrel Cortex. J. Neurosci., 36, 9922–9932.
28) Tiriac, A., Uitermarkt, B.D., Fanning, A.S., Sokoloff, G., & Blumberg, M.S. (2012) Rapid whisker movements in sleeping newborn rats. Curr. Biol., 22, 2075–2080.
29) Meister, M., Wong, R.O., Baylor, D.A., & Shatz, C.J. (1991) Synchronous bursts of action potentials in ganglion cells of the developing mammalian retina. Science, 252, 939–943.
30) Wong, R.O., Chernjavsky, A., Smith, S.J., & Shatz, C.J. (1995) Early functional neural networks in the developing retina. Nature, 374, 716–718.
31) Ackman, J.B., Burbridge, T.J., & Crair, M.C. (2012) Retinal waves coordinate patterned activity throughout the developing visual system. Nature, 490, 219–225.
32) Colonnese, M.T. & Khazipov, R. (2010) “Slow activity transients” in infant rat visual cortex: a spreading synchronous oscillation patterned by retinal waves. J. Neurosci., 30, 4325–4337.
33) Siegel, F., Heimel, J.A., Peters, J., & Lohmann, C. (2012) Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Curr. Biol., 22, 253–258.
34) Babola, T.A., Li, S., Gribizis, A., Lee, B.J., Issa, J.B., Wang, H.C., Crair, M.C., & Bergles, D.E. (2018) Homeostatic Control of Spontaneous Activity in the Developing Auditory System. Neuron, 99, 511–524.e515.
35) Tritsch, N.X., Yi, E., Gale, J.E., Glowatzki, E., & Bergles, D.E. (2007) The origin of spontaneous activity in the developing auditory system. Nature, 450, 50–55.
36) Golshani, P., Goncalves, J.T., Khoshkhoo, S., Mostany, R., Smirnakis, S., & Portera-Cailliau, C. (2009) Internally mediated developmental desynchronization of neocortical network activity. J. Neurosci., 29, 10890–10899.
37) Yang, J.W., An, S., Sun, J.J., Reyes-Puerta, V., Kindler, J., Berger, T., Kilb, W., & Luhmann, H.J. (2013) Thalamic network oscillations synchronize ontogenetic columns in the newborn rat barrel cortex. Cereb. Cortex, 23, 1299–1316.
38) Mizuno, H., Ikezoe, K., Nakazawa, S., Sato, T., Kitamura, K., & Iwasato, T. (2018) Patchwork-Type Spontaneous Activity in Neonatal Barrel Cortex Layer 4 Transmitted via Thalamocortical Projections. Cell Rep., 22, 123–135.
39) Kirkby, L.A., Sack, G.S., Firl, A., & Feller, M.B. (2013) A role for correlated spontaneous activity in the assembly of neural circuits. Neuron, 80, 1129–1144.
40) Xu, H.P., Burbridge, T.J., Ye, M., Chen, M., Ge, X., Zhou, Z.J., & Crair, M.C. (2016) Retinal Wave Patterns Are Governed by Mutual Excitation among Starburst Amacrine Cells and Drive the Refinement and Maintenance of Visual Circuits. J. Neurosci., 36, 3871–3886.
41) Harris, R.M. & Woolsey, T.A. (1981) Dendritic plasticity in mouse barrel cortex following postnatal vibrissa follicle damage. J. Comp. Neurol., 196, 357–376.
42) Jeanmonod, D., Rice, F.L., & Van der Loos, H. (1981) Mouse somatosensory cortex: alterations in the barrelfield following receptor injury at different early postnatal ages. Neuroscience, 6, 1503–1535.
43) Ohsaki, K., Osumi, N., & Nakamura, S. (2002) Altered whisker patterns induced by ectopic expression of Shh are topographically represented by barrels. Brain Res. Dev. Brain Res., 1, 159–170.
44) Li, H., Fertuzinhos, S., Mohns, E., Hnasko, T.S., Verhage, M., Edwards, R., Sestan, N., & Crair, M.C. (2013) Laminar and columnar development of barrel cortex relies on thalamocortical neurotransmission. Neuron, 79, 970–986.
45) Narboux-Nême, N., Evrard, A., Ferezou, I., Erzurumlu, R.S., Kaeser, P.S., Laine, J., Rossier, J., Ropert, N., Sudhof, T.C., & Gaspar, P. (2012) Neurotransmitter release at the thalamocortical synapse instructs barrel formation but not axon patterning in the somatosensory cortex. J. Neurosci., 32, 6183–6196.
46) Erzurumlu, R.S. & Gaspar, P. (2012) Development and critical period plasticity of the barrel cortex. Eur. J. Neurosci., 35, 1540–1553.
47) Waite, P.M. & Cragg, B.G. (1982) The peripheral and central changes resulting from cutting or crushing the afferent nerve supply to the whiskers. Proc. R. Soc. Lond. B Biol. Sci., 214, 191–211.
48) Zong, H., Espinosa, J.S., Su, H.H., Muzumdar, M.D., & Luo, L. (2005) Mosaic analysis with double markers in mice. Cell, 121, 479–492.
49) Datwani, A., Iwasato, T., Itohara, S., & Erzurumlu, R.S. (2002) NMDA receptor-dependent pattern transfer from afferents to postsynaptic cells and dendritic differentiation in the barrel cortex. Mol. Cell. Neurosci., 21, 477–492.
50) Iwasato, T., Datwani, A., Wolf, A.M., Nishiyama, H., Taguchi, Y., Tonegawa, S., Knopfel, T., Erzurumlu, R.S., & Itohara, S. (2000) Cortex-restricted disruption of NMDAR1 impairs neuronal patterns in the barrel cortex. Nature, 406, 726–731.
51) Iwasato, T., Erzurumlu, R.S., Huerta, P.T., Chen, D.F., Sasaoka, T., Ulupinar, E., & Tonegawa, S. (1997) NMDA receptor-dependent refinement of somatotopic maps. Neuron, 19, 1201–1210.
52) Lee, L.J., Iwasato, T., Itohara, S., & Erzurumlu, R.S. (2005) Exuberant thalamocortical axon arborization in cortex-specific NMDAR1 knockout mice. J. Comp. Neurol., 485, 280–292.
53) Portera-Cailliau, C., Pan, D.T., & Yuste, R. (2003) Activity-regulated dynamic behavior of early dendritic protrusions: evidence for different types of dendritic filopodia. J. Neurosci., 23, 7129–7142.
54) Fukumitsu, K., Fujishima, K., Yoshimura, A., Wu, Y.K., Heuser, J., & Kengaku, M. (2015) Synergistic action of dendritic mitochondria and creatine kinase maintains ATP homeostasis and actin dynamics in growing neuronal dendrites. J. Neurosci., 35, 5707–5723.
55) Wu, Y.K., Fujishima, K., & Kengaku, M. (2015) Differentiation of apical and basal dendrites in pyramidal cells and granule cells in dissociated hippocampal cultures. PLoS One, 10, e0118482.
56) Fujishima, K., Horie, R., Mochizuki, A., & Kengaku, M. (2012) Principles of branch dynamics governing shape characteristics of cerebellar Purkinje cell dendrites. Development, 139, 3442–3455.
57) Niell, C.M., Meyer, M.P., & Smith, S.J. (2004) In vivo imaging of synapse formation on a growing dendritic arbor. Nat. Neurosci., 7, 254–260.
58) Haas, K., Li, J., & Cline, H.T. (2006) AMPA receptors regulate experience-dependent dendritic arbor growth in vivo. Proc. Natl. Acad. Sci. USA, 103, 12127–12131.
59) Sin, W.C., Haas, K., Ruthazer, E.S., & Cline, H.T. (2002) Dendrite growth increased by visual activity requires NMDA receptor and Rho GTPases. Nature, 419, 475–480.
著者紹介Author Profile
 中沢 信吾(なかざわ しんご)
中沢 信吾(なかざわ しんご)国立遺伝学研究所特任研究員.博士(理学).
略歴2013年慶應義塾大学薬学部卒業.18年総合研究大学院大学生命科学研究科遺伝学専攻修了(指導教官:岩里琢治教授)後,現職.20年4月からは海外学振特別研究員としてジュネーブ大学(Denis Jabaudon研究室)に留学の予定.
研究テーマと抱負細胞同士,ひいては周辺環境との相互作用が生み出す非線形的な振る舞いに着目し,神経回路が自己組織的に構築される仕組みの理解を深めていきたいと考えています.
趣味競技プログラミング.
 岩里 琢治(いわさと たくじ)
岩里 琢治(いわさと たくじ)国立遺伝学研究所教授,総合研究大学院大学遺伝学専攻教授(併任).博士(理学).
略歴1987年京都大学理学部卒業,92年同大学院理学研究科修了.学振特別研究員を経て,93年よりマサチューセッツ工科大学(利根川進研究室)にてポスドク.98年より理化学研究所脳科学総合研究センターにて研究員のちに副チームリーダー.2001年から05年はさきがけ研究者を兼務.08年より現職.
研究テーマと抱負子どもの脳の中で神経回路が発達する仕組みの解明に,マウス遺伝学やイメージングを基盤とする独自アプローチで貢献したいと考えています.
ウェブサイトhttp://iwasato-lab.sakura.ne.jp/
趣味歴史,富士山を眺めること.