「脳」という言葉によって想起される最も一般的なイメージは,おそらくヒトの大脳皮質ではないだろうか.大脳皮質は哺乳類において顕著に発達した脳領域であり,霊長類,特にヒトではことにその肥大化が著しい.大脳皮質の起源と進化については,古今東西さまざまな学者が独自の学説を展開してきた.ポール・マクリーンによって提唱された「三位一体説」はその中でも大きな影響力を持つものであろう.我々ヒトの脳のコアとなる部分は原始爬虫類の脳(脳幹・反射脳)であり,その外側を哺乳類の脳(辺縁系・情動脳),そして最外部をヒト特異的な脳領域(大脳皮質・理性脳)が覆っている,かくして脳の進化は情動性を担う爬虫類の脳から崇高な理性をつかさどるヒトの脳へと直線的に進化したのだ1),というマクリーンの主張はいまだ多くの人々の心を捉えている.しかしながら,近年の遺伝子発現の比較解析によって,脳の基本構造は3億年間変更されておらず,大脳皮質と「等しい」脳領域はすべての脊椎動物に普遍的に存在していることが明らかとなっている.
「等しい」とは一体どういうことだろうか.ヘッケル,オーウェン,そしてダーウィン以降の比較形態学・発生生物学においてこの問題は繰り返し議論されてきた2, 3).ある解剖学的構造に着目したとき,二つの種においてそれらの構造物の発生起源が同一である場合,これらの構造物は「相同」である,進化的文脈で言い換えるなら,共通祖先が持っていた同一の構造に由来することを意味する.進化的に保存された発生過程があるからこそ,形態的相同性がもたらされるとも考えられる.同様な基準によって,我々は生理機能の相同性や細胞型の相同性,遺伝子の相同性を議論することができる.特定の器官の解剖学的構造や生理機能,器官を構成する細胞型や遺伝子発現などの特徴がすべて矛盾なく一致しているのであれば,こうした特徴が共通祖先から受け継いだものであることに議論の余地はほぼないだろう.一方,これらの生物学的特徴に不一致がみられた場合,相同性の議論は往々にして紛糾する.大脳皮質を構成する神経細胞の相同性の問題は,解剖学的特徴や細胞型,そして遺伝子発現の不一致の典型であり,着地点のみえない議論の応酬が世紀を超えて繰り広げられてきた研究分野でもある.
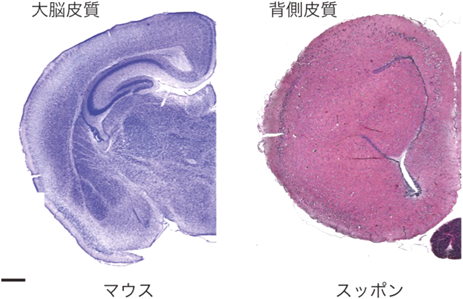
哺乳類の大脳皮質はシート状の構造物であり,外側の灰白質と呼ばれる構造に神経細胞やグリア細胞の細胞体が存在している.一方,皮質内側の白質は神経細胞の軸索で占められており,いわゆる神経線維と付随するグリア細胞(主にオリゴデンドロサイト)で構成されている.灰白質にはさまざまな種類の神経細胞が整然と並んだ6層構造が認められる.各層の厚みや細胞数に差はあるが,大脳皮質のすべての領域にわたってこの6層構造が維持されている.こうした特徴より,大脳皮質はisocortex(等皮質)とも呼ばれている.この大脳皮質構造はあらゆる現生哺乳類に普遍的に認められる構造である(図1).哺乳類は現在三つの系統に分類されるが,最も初期に分岐した単孔類(カモノハシ,ハリモグラ類)においても大脳皮質構造が維持されている.したがって,大脳皮質の6層構造は哺乳類を規定する共有派生形質であり,その構造は哺乳類の共通祖先ですでに獲得されていたと推測される4).
現在地球上に生息するすべての哺乳類の共通祖先は,今から約2億年前の三畳紀からジュラ紀初期に出現したと考えられている.現在の哺乳類に最も近縁の絶滅動物は哺乳型類と呼ばれる動物群であるが,この系統をさらに遡ると古生代ペルム紀に繁栄した単弓類(眼窩の後ろに一つの側頭窓を持つ動物)と呼ばれる動物群にたどりつく5).一方,現在の爬虫類や鳥類の祖先もこの時期に出現していた双弓類(眼窩の後ろに側頭窓が二つある動物)に由来し,これら二つの系統と絶滅した無弓類を含めた動物群の共通祖先がいたはずである.現在の哺乳類,爬虫類,鳥類はいずれも胚の時期に「羊膜」と呼ばれる膜で覆われた形で胚発生が進行するため,これらの動物群を有羊膜類(羊膜類)と呼ぶ.この羊膜類の共通祖先は石炭紀後期に出現していたと考えられるが,その実体はいまだ不明な点が多い5).
化石記録に残らない脳の内部構造の進化を推測する唯一の手段が現生動物の比較解析である.19世紀より多くの神経解剖学者がさまざまな動物の脳の比較形態学的解析を行ってきた.爬虫類にも大脳皮質と同様の構造が認められるが,その構造は哺乳類と比較して単純であり,構成する神経細胞の数も非常に少ない(図1).爬虫類の皮質(背側皮質)は3層に区分され,主に中間の第2層に神経細胞が集積している6, 7).これらの神経細胞の多くは興奮性の神経細胞であり,視床からの感覚性入力を受けるという点で哺乳類の大脳皮質との類似性が認められる.また哺乳類の大脳皮質と同様に,爬虫類の背側皮質は胚発生の時期の背側外套と呼ばれる領域に由来する.以上の観点から,爬虫類の背側皮質は哺乳類大脳皮質と相同な領域であるという見解は,現在多くの比較神経解剖学者の一致するところである(背側皮質のさらに詳細な境界に関してはいまだいくつかの説が存在する8, 9)).
爬虫類の背側皮質と哺乳類大脳皮質が相同であるならば,両者を構成する神経細胞にも相同性が認められてしかるべきである.哺乳類大脳皮質を構成するすべての神経細胞の種類(サブタイプ)は,爬虫類背側皮質にも存在しているのだろうか? 20世紀の終わりごろまで,異なる種間での神経細胞の類似性の比較はゴルジ染色による形態学的観察,軸索トレーサーを用いた神経回路網の比較,そして神経伝達物質や細胞内カルシウム結合タンパク質に対する抗体を用いた免疫組織化学的手法しかなかった.こうした解析の結果,哺乳類大脳皮質と爬虫類背側皮質の神経細胞は,類似している部分とそうでない部分(これも厳密には研究者の主観に基づいている)が混在していることが明らかとなり,哺乳類大脳皮質の神経細胞と相同な神経細胞サブタイプが非哺乳類にも果たして存在するのかどうか,最終的な結論を下すことはできなかった.
21世紀に入り,哺乳類の大脳皮質の層特異的な神経細胞を標識するタンパク質が同定されたことにより,この研究分野は飛躍的に進展している10).大脳皮質の第1層から6層を構成する神経細胞の分化をつかさどる遺伝子が次々と明らかになり,これらの遺伝子発現の制御機構から層特異的な神経細胞の発生・分化機構のモデルが立てられた11).このモデルの根幹は発生の時間軸に沿った特異的な転写因子による相互発現制御機構であり,このコンセプトはショウジョウバエの神経細胞サブタイプの分化機構を元にしている.
哺乳類大脳皮質の神経細胞サブタイプの分化機構が明らかになったことにより,この機構の種間比較解析を試みる研究者が現れてきた.まず,大脳皮質の神経細胞サブタイプを規定する遺伝子群の発現が他の動物でも確認されるのかどうか,in situハイブリダイゼーションあるいは免疫組織化学的手法による結果が報告された.その結果,層特異的な神経細胞サブタイプの発現は爬虫類や鳥類の大脳外套にも認められることが明らかとなった12–14).しかしながら,これらの動物群の神経細胞サブタイプは外套の特定領域にクラスター状に存在しており,哺乳類のような層構造を形成していなかった.一方,各神経細胞サブタイプが構築する神経回路には種を超えた共通性が認められ,感覚性の入力を受ける神経細胞,運動性の出力線維を持つ神経細胞どうしでは同じ転写因子が発現していることも明らかとなった.こうした結果より,哺乳類大脳皮質の層特異的な神経細胞サブタイプと相同な細胞型は他の羊膜類にも存在しており,こうした細胞型は少なくとも羊膜類の共通祖先ですでに獲得されていた,という説が提唱された14, 15).
一方,この仮説には問題点もいくつか存在する.まず,いずれの研究も非常に少数の遺伝子発現に着目しているため,比較対象とする遺伝子の選別が妥当といえるのか疑問である.さらに,種間における細胞の表現型と遺伝子の発現様式に齟齬が生じた場合,遺伝子発現様式の類似性だけでは細胞型の相同性の根拠としては不十分である.最初の問題に関しては,網羅的な遺伝子発現の解析を行うことにより,より客観的かつ定量的な比較が可能になると思われた.実際に,イギリス・オックスフォード大学のグループとアメリカ・デューク大学およびシカゴ大学のグループがそれぞれ独立に鳥類および爬虫類(アリゲーター)大脳の各領域の遺伝子発現の網羅的な解析を行い,哺乳類大脳皮質との類似性を検討した16–18).オックスフォード大の結果では,大脳腹側に由来する基底核や,外套の内側に由来する海馬の領域に関しては,哺乳類と鳥類で遺伝子発現パターンの類似性が認められた.一方,それ以外の鳥類外套領域において,哺乳類の大脳皮質の層特異的な神経細胞と高い類似性を示す領域は確認されなかった.たとえば,哺乳類大脳皮質の第4層にはRORβと呼ばれる核内受容体が発現している.RORβの発現は鳥類外套の特異的な領域(entopallium)に認められるが,この領域を構成する神経細胞のトランスクリプトーム解析の結果は,必ずしも両者の間で高い類似性を示すわけではなかった16).これは,本来異なるサブタイプであった神経細胞が進化の過程で独立にRORβの発現を獲得した,いわゆる収斂進化の可能性を示唆している.一方,すべての遺伝子発現は神経細胞サブタイプの分化に等しく重要ではないため,細胞型の類似性を比較するためにはコアとなる遺伝子発現(この場合であればRORβ)に着目すべきである,という主張もある.デューク大,シカゴ大のグループはこうした観点で羊膜類外套領域の遺伝子発現を比較し,哺乳類大脳皮質と爬虫類,鳥類外套における相同(あるいは類似した)細胞が「同定された」,と報告している17, 18).しかしながら,選んだ遺伝子が細胞型を決定するコア・ファクターとして妥当だったのかどうか,ここでまた論理の循環が生じてしまう.これらの議論には相同性の重要な要素である発生学的な細胞起源に関する視点が欠如している.また,一般に爬虫類と呼ばれる動物は実は多様な系統を含む動物集団であり,ワニ類は鳥類と同じ主竜類,一方ヘビやトカゲ類は鱗竜類,カメ類は主竜類に近い系統である.したがって,鳥類やワニ類との比較解析だけでは羊膜類全体を網羅した細胞型の相同性を検証するデータとしては不十分である.こうした問題を解決するためには,爬虫類の中でも鱗竜類(ヘビ,トカゲ,ヤモリ)やカメ類の背側皮質の神経細胞サブタイプの系譜解析,さらには神経細胞サブタイプを規定する遺伝子発現機構の解析が不可欠と考えられた.
4. 爬虫類背側皮質の神経細胞サブタイプの発生過程の解析
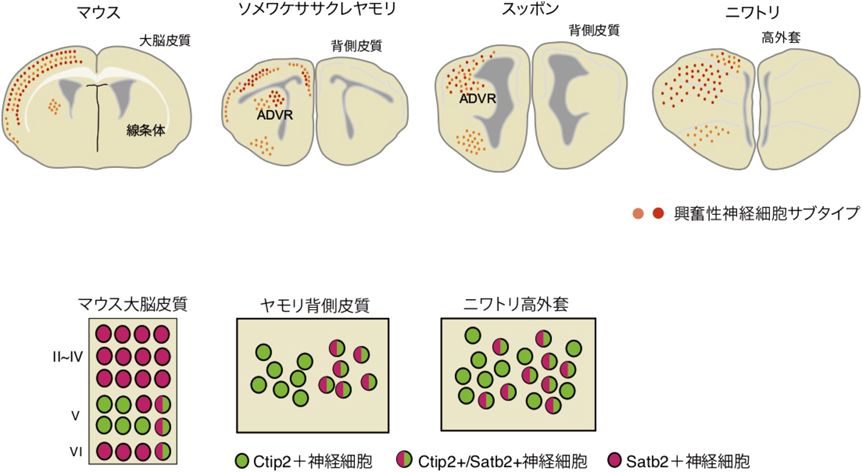
そこで我々の研究グループは,爬虫類背側皮質の神経細胞サブタイプの分化様式と遺伝子発現の制御機構を解析し,哺乳類大脳皮質の層特異的な神経細胞サブタイプとの共通性を検討することにした19).遺伝子発現の比較に際して,我々はあえてCtip2とSatb2という二つの転写因子のみに着目し,他の遺伝子発現を切り捨てることにした.その理由として,1)これらの転写因子はいずれも哺乳類大脳皮質の層特異的な神経細胞サブタイプの特異化に深く関与していること,2)哺乳類大脳皮質において,これらの転写因子の発現制御機構が明らかになっていること,さらに3)Ctip2とSatb2は主に大脳皮質の下層,上層の神経細胞にほぼ排他的に発現しており,これらの遺伝子発現を比較することで下層,上層二つの細胞型の類似性の検討が可能になること,があげられる.我々が研究に使用した爬虫類は,ソメワケササクレヤモリとスッポンであり,どちらも胚の入手と遺伝子の発現操作が可能である.また,これらの動物のゲノム配列やトランスクリプトームのデータも公開されている20–22).さらにヤモリ,カメ,トリ(ニワトリ)を同時に比較することで,羊膜類の主要な系統群をすべて網羅することができる.Ctip2とSatb2に対する市販の抗体は種を超えて使用可能であることも研究の遂行には重要な要素であった.
我々はまず,それぞれのタンパク質に対する抗体を用いて,Ctip2とSatb2の発現を哺乳類,爬虫類,鳥類の外套領域で比較した.哺乳類(マウス)ではCtip2は皮質第5層の神経細胞に特異的に発現している.一方,Satb2は第2層から6層までの幅広い領域の神経細胞に発現しているが,これら二つの転写因子はマウス大脳皮質ではそれぞれの神経細胞においてほぼ排他的な発現が認められる.一方,ヤモリ,スッポン,ニワトリの外套領域では,いずれの種でも多くの神経細胞においてCtip2とSatb2のタンパク質が共局在しており,一つの神経細胞がこれら二つの遺伝子を同時に発現していることが明らかとなった(この細胞をCtip2+Satb2+細胞と定義した).すなわち,この二つの転写因子の発現様式でみる限り,爬虫類,鳥類の神経細胞において哺乳類大脳皮質の上層の神経細胞と同一な細胞を同定することは困難であった(図2).これに対して,Ctip2のみを発現する細胞(Ctip2+細胞)は爬虫類,鳥類の外套にも存在していた.これらの神経細胞は哺乳類大脳皮質の第5層の神経細胞と相同な細胞と考えてよいのだろうか?
哺乳類大脳皮質の層特異的な神経細胞は発生段階に応じて順次分化するが,これは脳室帯に存在する神経前駆細胞の特性が時々刻々と変化していくからである.大脳皮質の発生初期に存在するそれぞれの神経前駆細胞は皮質上層および下層両方の神経細胞を産生する能力を持っていることが,in vitroの分散培養やin vivoの細胞系譜解析によって明らかとなっている23, 24).このことから,大脳皮質の発生初期の神経前駆細胞は多様な神経細胞を生み出す能力(多分化能)を備えていることが示唆されている.では,爬虫類や鳥類の神経細胞サブタイプは哺乳類と同様に多分化能を持つ神経前駆細胞に由来するのだろうか? 神経細胞サブタイプの相同性を議論するには,遺伝子の発現比較だけでなくこうした細胞系譜の解析が不可欠である.
胚の細胞系譜解析は発生生物学における古典的な研究手法の一つでもある.さまざまな生体色素の注入による古典的な細胞標識法に加えて,近年は組織特異的プロモーターを利用した遺伝学的手法による細胞系譜解析も広く用いられている.しかしながら,一つの前駆細胞の細胞系譜を明らかにするクローン系譜解析に関しては,これまで多くの方法が試行され,その汎用性や結果の妥当性が議論されてきた25).レトロウイルスによる細胞標識法は中枢神経系のクローン系譜解析において最も一般的な方法の一つである.アルカリホスファターゼなどの酵素や蛍光タンパク質を発現するレトロウイルスを低濃度で脳室内に注入することにより,ごく少数の神経前駆細胞とその子孫細胞が標識される.標識された細胞がある程度の集団で存在していた場合,こうした細胞集団は同一の前駆細胞に由来するクローンであると予測される.しかしながらこの方法では,違う前駆細胞に由来する細胞が偶然その標識細胞集団に移入してしまった場合でも,同一のクローン集団であると認識されてしまう.現在,クローン解析で最も精度の高い細胞標識方法は,ランダムシーケンスタグ(ランダムな配列を持つ比較的短いDNA断片)を持つレトロウイルスを作製し,このウイルスを脳室に注入後,脳の中で標識された細胞を再び回収しウイルス由来のゲノム配列を増幅することでクローン集団を同定する方法である26).この方法の問題点は細胞の回収にレーザーマイクロダイセクション装置が必要であること,また細胞やゲノムの回収・増幅効率が100%ではないため,一つの前駆細胞に由来する細胞系譜のすべてを明らかにすることが困難な点にある.一方,マウスにおいては遺伝学的手法による細胞の蛍光標識によって1細胞に由来する子孫細胞を標識・追跡することも可能になっているが,同様の方法を爬虫類や鳥類に応用するためには,生殖細胞ゲノムに外来遺伝子が挿入されたトランスジェニック動物の作製が必要である.爬虫類や鳥類のトランスジェニック技術も開発されてはいるが,実験の汎用性を考慮するといまだハードルは高い.
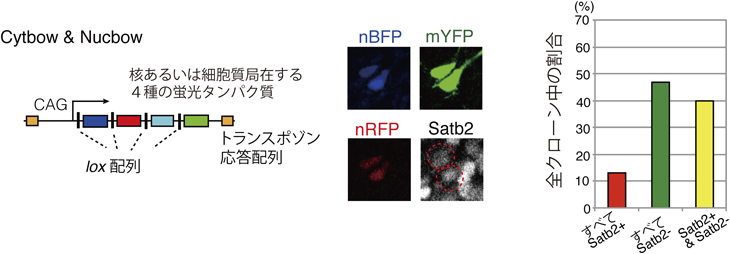
爬虫類や鳥類の神経細胞サブタイプのクローン解析を実施するにあたり,我々はオーソドックスな方法であるウイルスベクターを用いた細胞標識法と,近年開発された改変型Brainbowベクターを用いたランダム蛍光標識法を採用した(図3).ウイルスベクターについては,我々は市販のパントロピック・レンチウイルスが低い感染効率で爬虫類や鳥類の神経前駆細胞を標識することを見いだした.標識細胞の移動によるクローン混入の可能性については,GFPとRFPを発現するウイルスを混合した場合の標識結果によって検証し,GFP-GFPあるいはRFP-RFP標識細胞どうしの距離(すなわち同一前駆細胞に由来するクローン)がGFP-RFP標識細胞どうしの距離(異なる細胞由来のクローン)よりも近いことを確かめた.GFP発現レンチウイルスによるクローン解析によって,爬虫類(ソメワケササクレヤモリ)の背側皮質および鳥類(ニワトリ)の背側外套の神経前駆細胞の大部分が,Ctip2+神経細胞とCtip2+Satb2+細胞の両方を生み出すことが明らかとなった(図3).
Brainbowは2007年に開発された遺伝学的細胞標識法であり,Creリコンビナーゼの活性により四つの蛍光タンパク質がランダムに発現するように細工されたコンストラクションを用いる27).コンストラクションがゲノムに1コピーしか存在しない場合,蛍光波長の組み合わせは4タイプであるが,マルチコピーの場合は波長の組合わせが増加する.電気穿孔法によりこのベクターを神経前駆細胞に導入することで,非哺乳類でもクローン解析を行うことができる.しかしながら,細胞に導入されたベクターは通常細胞分裂とともに細胞内で希釈あるいは分解されていくため,長期間の細胞系譜解析ではコンストラクションのゲノム挿入が必要となる.また,電気穿孔法による遺伝子導入では細胞ごとに導入されるベクターの量にばらつきが生じるため,蛍光波長の組合わせだけでは子孫細胞の系譜解析にバイアスがかかる可能性がある.これらの問題を解決するため,2012年にCytbow, Nucbowベクターが開発された28).これらのベクターはそれぞれ細胞質あるいは核に蛍光タンパク質が局在するように細工されており,かつトランスポゾン配列を両端に持つことにより導入細胞のゲノムに挿入される仕組みになっている.これらのベクターと自己切断型Cre発現ベクター(Self-excision Cre:Creによるベクターの自己切断によってCreが発現する期間をごく短期間に限定できるベクター)を共導入することにより,精度の高いクローン集団の同定が可能となった.実際には神経細胞サブタイプを判定するために細胞型マーカーによる組織化学的染色が必要であり,我々はクローン集団におけるSatb2の発現を検討した(蛍光フィルター数の制限により二つの転写因子の発現を同時に解析することができなかったが,Satb2陽性細胞はCtip2を同時に発現していると推測され,Satb2陰性細胞の多くはCtip2+細胞であると推測される).この細胞標識法を用いてヤモリとニワトリの背側外套領域のクローン解析を実施したところ,レンチウイルスベクターによる標識と同様に,多くの神経前駆細胞がSatb2陽性と陰性の神経細胞のどちらも産生する能力を持っていることが明らかとなった(図3).したがって,少なくとも細胞系譜の観点から,爬虫類,鳥類の神経細胞サブタイプ(この場合はCtip2とSatb2の発現による識別)の発生機構は,哺乳類の層特異的な神経細胞の発生機構と同一であることが示唆された.一方,爬虫類や鳥類では,少数ながらCtip2+細胞のみを産生する前駆細胞が存在することも推測された.この前駆細胞のタイプが非哺乳類独自のものであるのか,あるいは細胞標識を実施した発生段階特異的なものなのかは明らかではない.また爬虫類,鳥類の外套ではCtip2+細胞は比較的外套の内側に集積しており,神経前駆細胞の特性が発生過程において空間的な制御を受けている可能性もある.
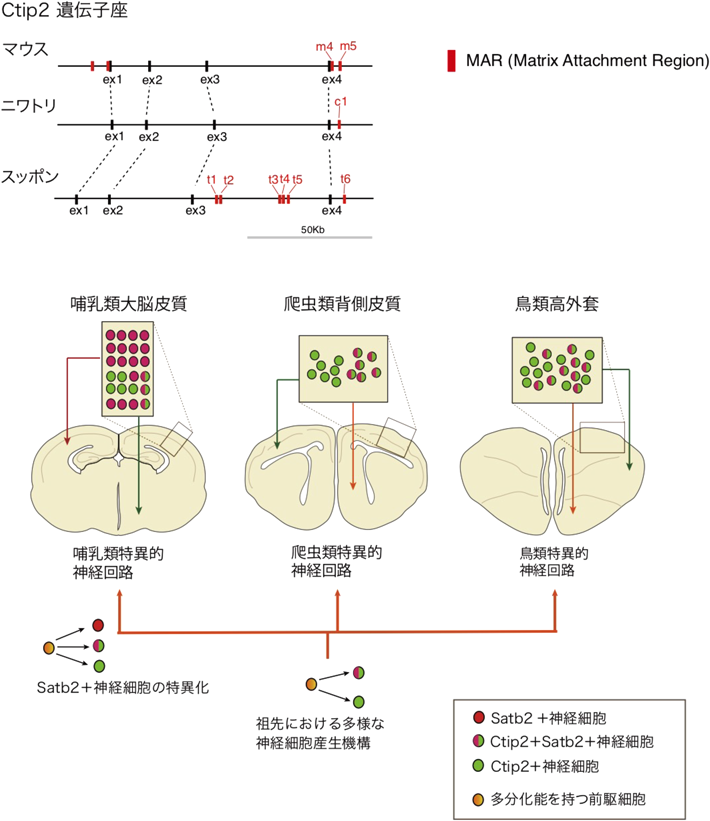
哺乳類と非哺乳類で神経細胞サブタイプの産生機構が同一であるならば,なぜ爬虫類や鳥類では二つの転写因子が一つの神経細胞で同時に発現するような事態が生じるのだろうか? 実は哺乳類大脳皮質において,特に上層の神経細胞では積極的にCtip2の発現を抑制するメカニズムが機能している.Ctip2遺伝子が存在するゲノム領域には,MAR(matrix attachment region)と呼ばれるATリッチの特殊なシス配列が存在している.この配列にはNuRD複合体(nucleosome remodeling deacetylase)と呼ばれるタンパク質複合体が結合し,周辺遺伝子の転写抑制を行う.哺乳類大脳皮質におけるSatb2の機能解析を報告した論文では,Satb2がいくつかの核内タンパク質と共同してNuRD複合体として機能し,Ctip2のMAR配列に結合することでCtip2の発現を抑制することを見いだしている29–31).ならば,このNuRD複合体およびCtip2のMARを介した転写抑制機構が哺乳類と非哺乳類で異なっているのだろうか?
我々はまず免疫組織化学的手法によりNuRD複合体を構成するタンパク質(SkiおよびHDAC2)が爬虫類や鳥類のCtip2+Satb2+細胞に強く発現していることを見いだした.したがって,少なくともCtip2+とSatb2+の共発現はトランス側の因子の違いによるものではない可能性が示唆された.次に,MARの構造あるいは機能的な違いが種間の遺伝子発現の違いを生み出している可能性を検討するため,我々は爬虫類,鳥類のCtip2ゲノム領域のMAR配列の同定を試みた.その結果,ニワトリのCtip2の遺伝子座に存在するMARは3′側の一つのみであること,スッポンCtip2遺伝子座のMARは複数存在するが,いずれも3′側に集中していることが明らかとなった(図4).そこでこれらのMARをすべて単離し,ルシフェラーゼを発現するリポーターベクターに挿入することによりMARの転写抑制機能の測定を試みた.その結果,哺乳類Ctip2遺伝子座のMAR(特にMAR4)に関しては,先行研究と同様にSatb2およびSkiの存在下では強い転写抑制効果が存在することが確認できた.興味深いことにニワトリCtip2遺伝子座のMARは,Satb2の存在下では逆に転写を亢進させることが明らかとなった.またスッポンのMARは領域ごとに異なる転写活性を示したが,少なくとも3′側のMARには転写抑制活性は認められず,鳥類と同様にSatb2の存在下では転写の亢進が確認された.またソメワケササクレヤモリのCtip2遺伝子座についても同様に解析を行ったが,残念ながらこの領域のゲノム配列情報が十分ではなく,特に5′側にMARが存在するかどうかを確認することができなかった.これらの結果より,非哺乳類のCtip2遺伝子座のMARはNuRD複合体を介した転写抑制機能を持たず,これがCtip2とSatb2の両タンパク質が共発現する仕組みの一つであることが示唆された.
これまでの比較脳形態学では,特定の転写因子の発現様式から神経細胞サブタイプの相同性を議論している研究が主流であった.しかし,同じ転写因子を発現している神経細胞は種を超えて類似した神経回路を構築しているのだろうか? 実は,遺伝子発現によって規定される爬虫類や鳥類の神経細胞サブタイプと神経投射パターンを実際に検討した論文はこれまでなかった.そこで我々は,爬虫類の背側皮質に存在するCtip2+およびCtip2+Satb2+神経細胞の軸索投射パターンを検討した.その結果,Ctip2+細胞は主に軸索を終脳内側に伸長し,多くは反対則の皮質へと投射していた.このように両半球を連絡する神経線維は哺乳類の脳梁と類似しているが,哺乳類大脳皮質の場合は脳梁を構成する神経線維は主に皮質上層のSatb2+神経細胞に由来する.一方,爬虫類のCtip2+Satb2+神経細胞は主に中隔野と呼ばれる終脳内側領域に投射することがわかった.すなわち,この二つの転写因子によって規定される神経細胞サブタイプと神経回路網は種間で保存されておらず,転写因子の発現様式と神経軸索投射パターンには種間多様性が存在することが明らかとなった.たとえば左右の半球を連絡する神経線維は羊膜類で普遍的にみられるが,この線維を構成する神経細胞サブタイプは種間で保存されていない32).機能的に重要な神経回路は種間で保存されている場合が多いが,たとえばドーパミン作動性神経回路のように祖先を同一にすることが予測される場合もあれば,半球間結合のように並行進化によって獲得されたと予測されるものもある.爬虫類の皮質間結合は脳梁の相同回路ではなく,爬虫類で独立に獲得された神経回路である.
これらの結果を総合して,我々は以下の結論を導き出した.1)神経細胞サブタイプを規定する転写因子の発現は少なくとも羊膜類の外套で広く保存されている(おそらく脊椎動物で高度に保存されているだろう).2)しかしながら,一つの神経細胞で発現する転写因子の組合わせは種間で保存されておらず,特に非哺乳類の多くの種では異なる転写因子が共発現している.3)転写因子の組合わせと神経回路パターンにも種特異性があり,これは祖先種における転写因子の機能(特定の神経回路網形成への寄与)に強固な制約がなかったことを示唆している.4)哺乳類の進化過程において転写因子の排他的な発現様式が確立され,同時に各転写因子が特定の神経回路を規定するような拘束が獲得されたことが推測される.要するに,少なくとも相同遺伝子の発現は神経細胞の相同性を約束するものではない,ということである(図4).遺伝子の発現と細胞型の不一致は,祖先系統における発生拘束(進化の方向性に制約がかかるような発生プロセスの保守性)が比較的ゆるいものであった可能性を示唆している.
8. 1細胞トランスクリプトームによる爬虫類皮質の遺伝子発現解析
我々が羊膜類の大脳皮質相同領域における神経細胞サブタイプに関する論文を発表した直後,ドイツ・マックスプランク研究所のグループによる爬虫類外套領域の1細胞トランスクリプトーム解析の結果が発表された33).彼らは,アカミミガメ(Trachemys scripta)およびフトアゴヒゲトカゲ(Pogona vitticeps)の成体の外套を材料にDrop-seqによる網羅的遺伝子発現解析を行っている.単離・解析した細胞群は,哺乳類における細胞特異的マーカーの発現を基準として神経細胞と非神経細胞(オリゴデンドロサイトとその前駆細胞,エペンディモグリア細胞,ミクログリア)に分類された.興味深いことに,エペンディモグリア細胞はマウス成体脳におけるアストロサイト,成体神経幹細胞,上衣細胞における遺伝子発現を共有しており,これらの細胞群が共通の細胞型細胞から進化した可能性を示唆している.また神経細胞に関しては,VGLUT1およびGABA合成・代謝酵素の発現を基に興奮性神経細胞と抑制性神経細胞に分類されている.特にGABA作動性の抑制性神経細胞に関して,マウスでは線条体隆起の3領域(lateral, medial, caudal)から産生されることが知られているが,これら三つの領域に由来する抑制性神経細胞サブタイプと同様な神経細胞が爬虫類にも存在することが明らかとなった.さらに,哺乳類に存在するSST(somatostatin),PV(parvalbumin),HTR(serotonin receptor),VIP(vasoactive intestinal polypeptide)といった抑制性神経細胞のサブタイプ特異的マーカーを発現する神経細胞と同様な細胞も爬虫類外套に存在していることが確認された.したがって,抑制性神経細胞の主要なサブタイプは羊膜類の祖先系統ですでに獲得されていたと推測される.
最も興味深いのは外套領域の興奮性神経細胞のサブタイプ解析である.彼らの解析では,カメの背側皮質において,哺乳類大脳皮質上層と下層の神経細胞に類似した遺伝子発現を示す細胞が存在していることを示しているが,これらの細胞群を規定する遺伝子発現の多くが一つの細胞でオーバラップしていることも報告している.いくつかの遺伝子についてin situハイブリダイゼーションによってそれらの発現様式を確認すると,「皮質上層」と「皮質下層」に相当する神経細胞はカメ背側皮質の第2層においてサブレイヤーを構成していることも明らかとなった(カメでは「皮質上層」「下層」の位置がマウス大脳皮質とは逆転している).しかしながら最も重要な点として,1細胞トランスクリプトーム解析においても,哺乳類大脳皮質の層特異的神経細胞と爬虫類の背側皮質の神経細胞は1対1の対応づけをすることはできない,と彼らは結論づけている.すなわち1)哺乳類と爬虫類における「皮質下層」「皮質下層」神経細胞の存在は,それぞれの系統における神経回路の類似性に伴う収斂進化の結果である,あるいは2)羊膜類の共通祖先でこれらの神経細胞サブタイプはすでに獲得されており,哺乳類大脳皮質の進化過程において起こったさらなる遺伝学的変化により,これらの神経細胞サブタイプが「層特異性」を獲得した結果とも考えられる.
爬虫類の外套領域の網羅的遺伝子発現に関して,おそらくこれ以上精度の高い報告は発表されないのではないかと感じている.爬虫類外套の1細胞トランスクリプトームを実際に遂行する研究者がいたことにも驚いたが,こうした研究成果がトップジャーナルに発表されることにも驚きを禁じえなかった.筆頭著者のMaria Antonietta Toschesとは2019年にスペインの地方都市ムルシアで開催された比較神経生物学会で初めて顔を合わせ,互いの研究成果について議論した.それぞれ独立に研究を開始し,まったく異なる方法論を採用しながら同じ結論にたどりついたこと,それぞれの研究結果は互いに補完しあうものであることを確認し意気投合した.少数の転写因子の発現制御解析を行うという非常にクラシカルな発生生物学的手法による研究結果が,アンバイアスなトランスクリプトーム解析による結論によって支持されたことは,我々にとってきわめて大きな意義を持つと感じている.欧州の脳進化に関する研究会はいずれも小規模のリトリート的風情のものが多く,この分野の研究者と濃密な議論ができるのは大変有意義であった.
脊椎動物の脳の基本的な設計様式は円口類から哺乳類まで高度に保存されている.脊椎動物の共通祖先から受け継いだ分節構造に従って特異化する神経細胞サブタイプの中で,大脳の抑制性神経細胞のように細胞型の種間保存性が非常に高いものに関しては,細胞型の相同性におそらく議論の余地はない.これに対して外套領域の興奮性神経細胞の表現型や遺伝子発現は種間で保存性が低く,細胞型の相同性の議論が紛糾する原因となってきた.他の脳領域と比較して外套領域の構造と細胞型の多様性が高いことは,祖先型動物の細胞型を規定する発生プロセスが子孫において変更可能であったことを示唆している.なぜ外套領域の発生プロセスが可塑性に富んでいる(いた)のか,こうした可塑性がどこまで外套に内在的な機構によるものなのか,今後の検証が必要である.さらに,相同な表現型が異なる発生プロセスによってもたらされる,いわゆる「発生システム浮動」の現象が外套領域の進化に寄与していた可能性についても検討されなければならない.
神経系の最も重要な役割は感覚入力の情報処理に基づく行動へのアウトプットであり,自然淘汰はこうした神経回路の機能性に強く作用すると思われる.事実,層構造はさまざまな種のさまざまな脳領域に構築される普遍的構造であり,層構造の進化に寄与した神経生理学的な拘束性が存在すると思われる.なぜ大脳皮質(様)の6層構造が非哺乳類の外套に形成されなかったのか? 現生哺乳類が出現してから1億年以上にわたって大脳皮質6層構造の変更がされなかった理由はなんだろうか? これまでに報告された哺乳類大脳皮質のエンハンサー解析の結果は残念ながらこうした疑問の解答を提供しているとはいいがたい.我々が自分自身を知るためには他者との比較や対話が不可欠であるように,哺乳類大脳皮質の特異性を真に理解するためには,比較生物学的な視点からの研究が今後ますます重要になっていくだろう.
謝辞Acknowledgments
本研究の遂行をサポートしていただいた京都府立医科大学大学院神経発生生物学・小野勝彦教授,後藤仁志博士,川見美里氏,理化学研究所・清成寛博士,工樂樹洋博士,原雄一郎博士(現名古屋大学)に感謝の意を表する.また本研究は科学技術振興機構・さきがけ研究「細胞機能の構成的理解と制御」,新学術領域研究「共感性の進化・神経基盤」,「温度を基軸とした生命現象の統合的理解」および基盤研究(B)の支援により行われた.
引用文献References
1) ポール・D・マクリーン(2018)三つの脳の進化(法橋登編訳),工作舎.
2) 倉谷 滋(2016)分節幻想——脊椎動物のボディプランの起源をめぐる科学思想史,工作舎.
3) 倉谷 滋(2018)進化する形 進化発生学入門,講談社.
4) Nomura, T., Murakami, Y., Gotoh, H., & Ono, K. (2014) Reconstruction of ancestral brains: exploring the evolutionary process of encephalization in amniotes. Neurosci. Res., 86, 25–36.
5) Carroll, R.L.(1988) Vertebrate Paleontology and Evolution, W.H.Freeman and Company, New York.
6) Nomura, T., Kawaguchi, M., Ono, K., & Murakami, Y. (2013) Reptiles: a new model for brain evo-devo research. J. Exp. Zoolog. B Mol. Dev. Evol., 320, 57–73.
7) Ulinski, P.S.(1990) in Cerebral Cortex (Jones, E.G. & Peters, A. eds.), Vol. 8A, pp. 139–215, Plenum Press, New York.
8) Puelles, L. (2017) Comments on the Updated Tetrapartite Pallium Model in the Mouse and Chick, Featuring a Homologous Claustro-Insular Complex. Brain Behav Evol, 90, 171–189.
9) Desfilis, E., Abellan, A., Sentandreu, V., & Medina, L. (2018) Expression of regulatory genes in the embryonic brain of a lizard and implications for understanding pallial organization and evolution. J. Comp. Neurol., 526, 166–202.
10) Hevner, R.F., Daza, R.A., Rubenstein, J.L., Stunnenberg, H., Olavarria, J.F., & Englund, C. (2003) Beyond laminar fate: toward a molecular classification of cortical projection/pyramidal neurons. Dev. Neurosci., 25, 139–151.
11) Molyneaux, B.J., Arlotta, P., Menezes, J.R., & Macklis, J.D. (2007) Neuronal subtype specification in the cerebral cortex. Nat. Rev. Neurosci., 8, 427–437.
12) Nomura, T., Takahashi, M., Hara, Y., & Osumi, N. (2008) Patterns of neurogenesis and amplitude of Reelin expression are essential for making a mammalian-type cortex. PLoS One, 3, e1454.
13) Suzuki, I.K., Kawasaki, T., Gojobori, T., & Hirata, T. (2012) The temporal sequence of the mammalian neocortical neurogenetic program drives mediolateral pattern in the chick pallium. Dev. Cell, 22, 863–870.
14) Dugas-Ford, J., Rowell, J.J., & Ragsdale, C.W. (2012) Cell-type homologies and the origins of the neocortex. Proc. Natl. Acad. Sci. USA, 109, 16974–16979.
15) Suzuki, I.K. & Hirata, T. (2014) A common developmental plan for neocortical gene-expressing neurons in the pallium of the domestic chicken Gallus gallus domesticus and the Chinese softshell turtle Pelodiscus sinensis. Front. Neuroanat., 8, 20.
16) Belgard, T.G., Montiel, J.F., Wang, W.Z., García-Moreno, F., Margulies, E.H., Ponting, C.P., & Molnár, Z. (2013) Adult pallium transcriptomes surprise in not reflecting predicted homologies across diverse chicken and mouse pallial sectors. Proc. Natl. Acad. Sci. USA, 110, 13150–13155.
17) Jarvis, E.D., Yu, J., Rivas, M.V., Horita, H., Feenders, G., Whitney, O., Jarvis, S.C., Jarvis, E.R., Kubikova, L., Puck, A.E., et al. (2013) Global view of the functional molecular organization of the avian cerebrum: mirror images and functional columns. J. Comp. Neurol., 521, 3614–3665.
18) Briscoe, S.D., Albertin, C.B., Rowell, J.J., & Ragsdale, C.W. (2018) Neocortical Association Cell Types in the Forebrain of Birds and Alligators. Curr. Biol., 28, 686–696.e6.
19) Nomura, T., Yamashita, W., Gotoh, H., & Ono, K. (2018) Species-Specific Mechanisms of Neuron Subtype Specification Reveal Evolutionary Plasticity of Amniote Brain Development. Cell Rep., 22, 3142–3151.
20) Hara, Y., Takeuchi, M., Kageyama, Y., Tatsumi, K., Hibi, M., Kiyonari, H., & Kuraku, S. (2018) Madagascar ground gecko genome analysis characterizes asymmetric fates of duplicated genes. BMC Biol., 16, 40.
21) Hara, Y., Tatsumi, K., Yoshida, M., Kajikawa, E., Kiyonari, H., & Kuraku, S. (2015) Optimizing and benchmarking de novo transcriptome sequencing: from library preparation to assembly evaluation. BMC Genomics, 16, 977.
22) Wang, Z., Pascual-Anaya, J., Zadissa, A., Li, W., Niimura, Y., Huang, Z., Li, C., White, S., Xiong, Z., Fang, D., et al. (2013) The draft genomes of soft-shell turtle and green sea turtle yield insights into the development and evolution of the turtle-specific body plan. Nat. Genet., 45, 701–706.
23) Shen, Q., Wang, Y., Dimos, J.T., Fasano, C.A., Phoenix, T.N., Lemischka, I.R., Ivanova, N.B., Stifani, S., Morrisey, E.E., & Temple, S. (2006) The timing of cortical neurogenesis is encoded within lineages of individual progenitor cells. Nat. Neurosci., 9, 743–751.
24) Gao, P., Postiglione, M.P., Krieger, T.G., Hernandez, L., Wang, C., Han, Z., Streicher, C., Papusheva, E., Insolera, R., Chugh, K., et al. (2014) Deterministic progenitor behavior and unitary production of neurons in the neocortex. Cell, 159, 775–788.
25) Kretzschmar, K. & Watt, F.M. (2012) Lineage tracing. Cell, 148, 33–45.
26) Walsh, C. & Cepko, C.L. (1992) Widespread dispersion of neuronal clones across functional regions of the cerebral cortex. Science, 255, 434–440.
27) Livet, J., Weissman, T.A., Kang, H., Draft, R.W., Lu, J., Bennis, R.A., Sanes, J.R., & Lichtman, J.W. (2007) Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature, 450, 56–62.
28) Loulier, K., Barry, R., Mahou, P., Le Franc, Y., Supatto, W., Matho, K.S., Ieng, S., Fouquet, S., Dupin, E., Benosman, R., et al. (2014) Multiplex cell and lineage tracking with combinatorial labels. Neuron, 81, 505–520.
29) Alcamo, E.A., Chirivella, L., Dautzenberg, M., Dobreva, G., Fariñas, I., Grosschedl, R., & McConnell, S.K. (2008) Satb2 regulates callosal projection neuron identity in the developing cerebral cortex. Neuron, 57, 364–377.
30) Britanova, O., de Juan Romero, C., Cheung, A., Kwan, K.Y., Schwark, M., Gyorgy, A., Vogel, T., Akopov, S., Mitkovski, M., Agoston, D., et al. (2008) Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron, 57, 378–392.
31) Baranek, C., Dittrich, M., Parthasarathy, S., Bonnon, C.G., Britanova, O., Lanshakov, D., Boukhtouche, F., Sommer, J.E., Colmenares, C., Tarabykin, V., et al. (2012) Protooncogene Ski cooperates with the chromatin-remodeling factor Satb2 in specifying callosal neurons. Proc. Natl. Acad. Sci. USA, 109, 3546–3551.
32) Suarez, R., Gobius, I., & Richards, L.J. (2014) Evolution and development of interhemispheric connections in the vertebrate forebrain. Front. Hum. Neurosci., 8, 497.
33) Tosches, M.A., Yamawaki, T.M., Naumann, R.K., Jacobi, A.A., Tushev, G., & Laurent, G. (2018) Evolution of pallium, hippocampus, and cortical cell types revealed by single-cell transcriptomics in reptiles. Science, 360, 881–888.
著者紹介Author Profile
 野村 真(のむら ただし)
野村 真(のむら ただし)京都府立医科大学大学院神経発生生物学准教授.博士(理学).
略歴1972年神奈川県に生る.2000年名古屋大学大学院博士後期課程修了.東北大学大学院医学系研究科助手,助教,カロリンスカ研究所博士研究員を経て,11年より現職.
研究テーマと抱負哺乳類大脳皮質の進化発生学的研究を行っている.様々な動物の胚操作技術を用いて,遺伝子の変化と脳の形態的多様性との因果関係を明らかにしていきたい.
ウェブサイトhttp://tadnom.jimdo.com
趣味絶版模型の収集と製作.