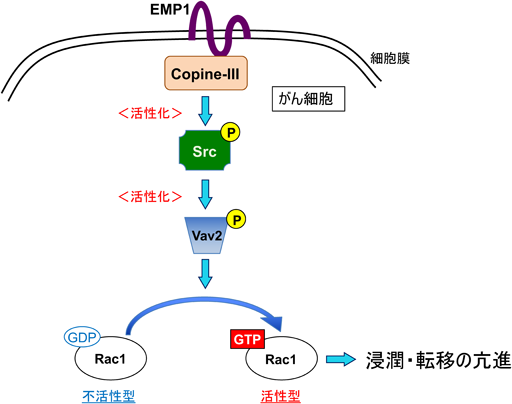
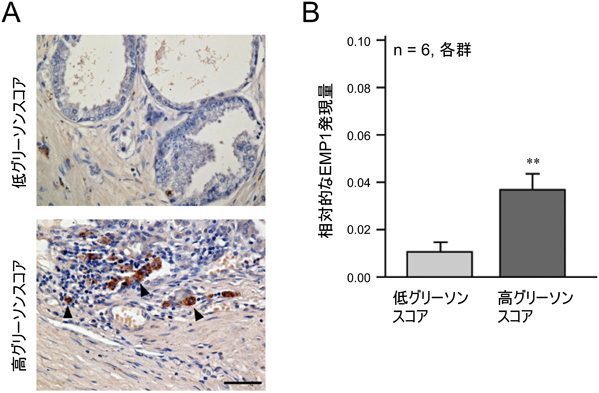
がんの浸潤・転移を促進させるepithelial membrane protein 1の分子作用機構Pro-invasive and -metastatic activities of epithelial membrane protein 1
滋賀医科大学分子生物学・生化学講座分子病態生化学部門Division of Molecular Medical Biochemistry, Department of Biochemistry and Molecular Biology, Shiga University of Medical Science ◇ 滋賀県大津市瀬田月輪町 ◇ Seta Tsukinowa-cho, Otsu, Shiga 520–2192, Japan)