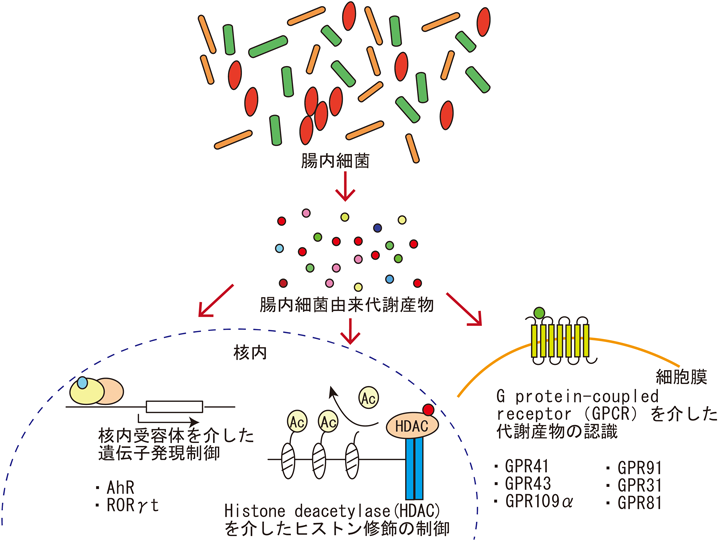
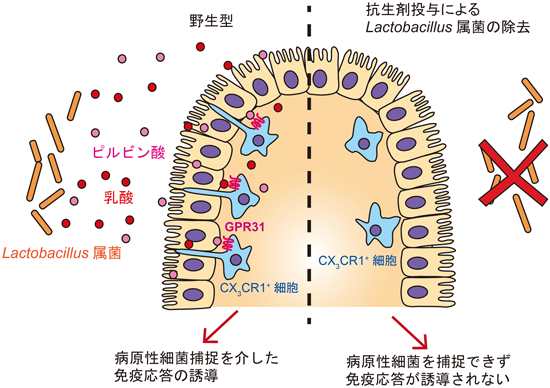
腸内細菌が作る乳酸・ピルビン酸による腸管免疫の活性化Intestinal immune regulation by the commensal bacteria-derived lactic acid and pyruvic acid
1 東京大学定量生命科学研究所 免疫・感染制御研究分野Laboratory of Immunology and Infection Control,Institute for Quantitative Biosciences, The University of Tokyo ◇ 〒113–0032 東京都文京区弥生1–1–1 ◇ 1–1–1 Yayoi, Bunkyo-ku, Tokyo 113–0032, Japan
2 大阪大学大学院医学系研究科免疫制御学Department of Microbiology and Immunology, Graduate School of Medicine, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ 2‒2 Yamadaoka, Suita, Osaka 565‒0871, Japan