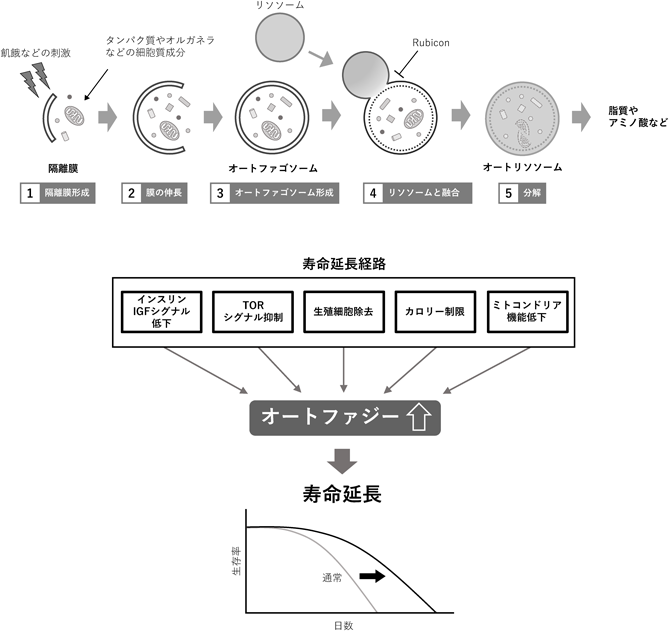
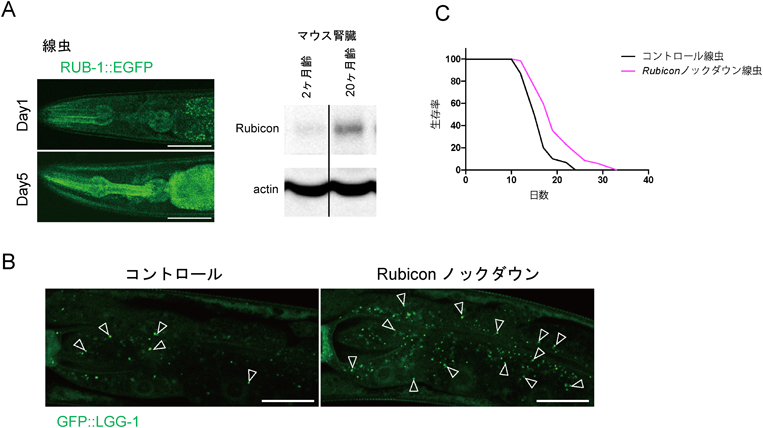
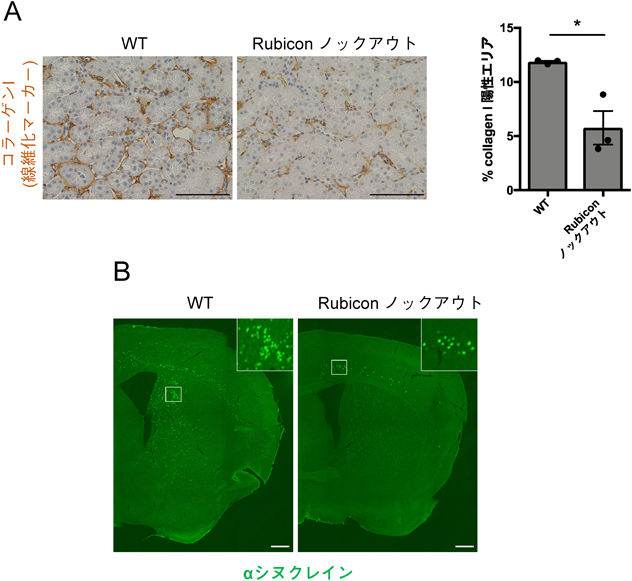
加齢に伴うオートファジー低下のメカニズムNovel insights into the molecular mechanism of age-associated decline of autophagy
1 大阪大学大学院医学系研究科生化学・分子生物学講座遺伝学教室Department of Genetics, Graduate School of Medicine, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ 2–2 Yamadaoka, Suita, Osaka 565–0871, JAPAN
2 大阪大学大学院生命機能研究科時空生物学講座細胞内膜動態研究室Department of Intracellular Membrane Dynamics, Graduate School of Frontier Biosciences, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ 2–2 Yamadaoka, Suita, Osaka 565–0871, JAPAN
3 大阪大学高等共創研究院Institute for Advanced Co-Creation Studies, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ 2–2 Yamadaoka, Suita, Osaka 565–0871, JAPAN