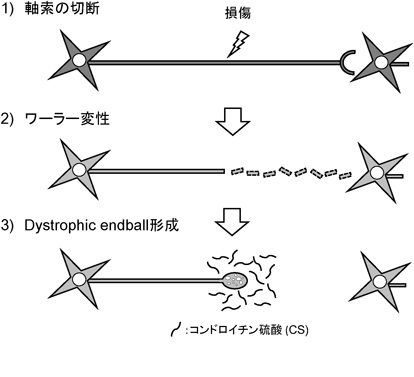
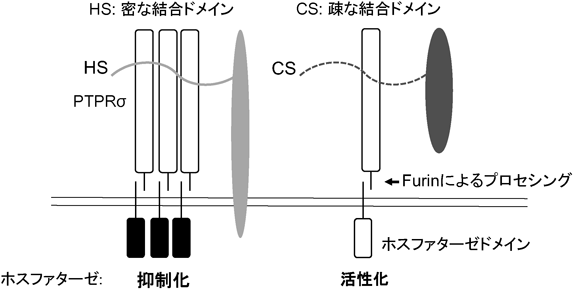
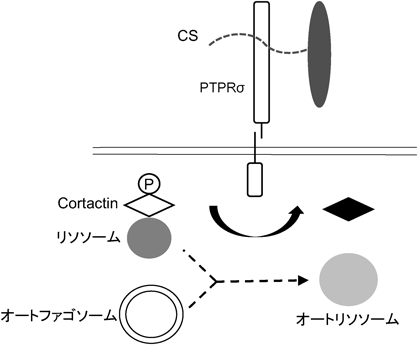
硫酸化糖鎖によるDystrophic endball形成機構Mechanisms of formation of dystrophic endballs by sulfated glycans
名古屋大学大学院医学系研究科生物化学講座分子生物学分野Department of Biochemistry, Nagoya University Graduate School of Medicine ◇ 〒466–8550 愛知県名古屋市昭和区鶴舞町65 ◇ 65 Tsurumai-cho, Showa-ku, Nagoya, Aichi 466–8550, Japan