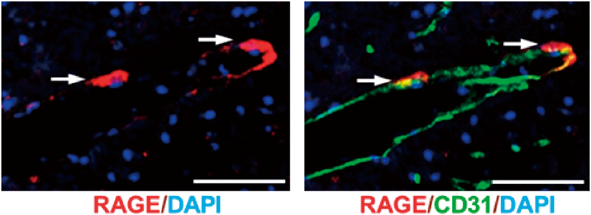
RAGEによるオキシトシンの血液脳関門移行と愛情構築の調節RAGE is an oxytocin transporter of the blood-brain barrier, transducing maternal bonding and nurturing
金沢大学医薬保健研究域医学系血管分子生物学Department of Biochemistry and Molecular Vascular Biology, Kanazawa University Graduate School of Medical Sciences ◇ 〒920–8640 石川県金沢市宝町13–1 ◇ 13–1 Takara-machi, Kanazawa 920–8640, Japan