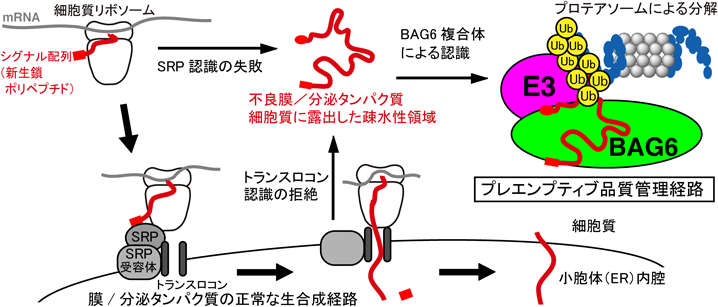
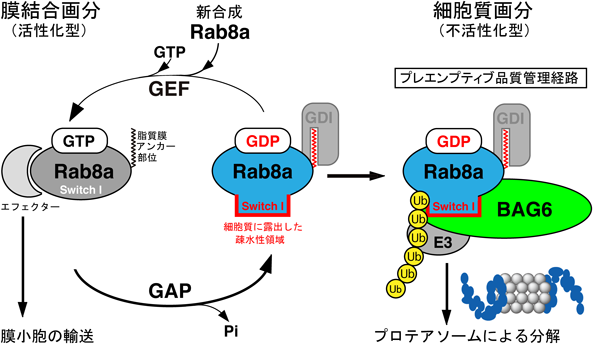
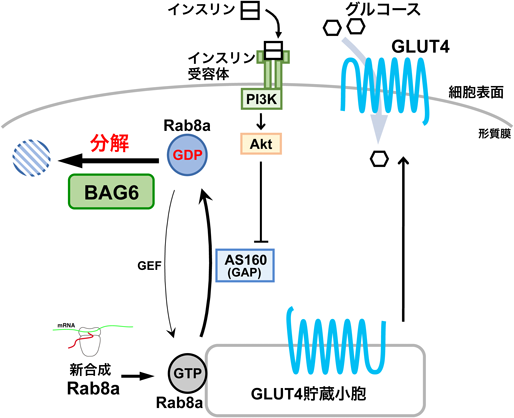
プレエンプティブ品質管理を介した膜タンパク質の選択的分解機構Pre-emptive quality control in selective membrane protein degradation
東京都立大学理学部生命科学科Department of Biological Sciences, Tokyo Metropolitan University ◇ 〒192–0397 東京都八王子市南大沢1–1 ◇ Minami-Osawa 1–1, Hachioji 192–0397, Tokyo, Japan