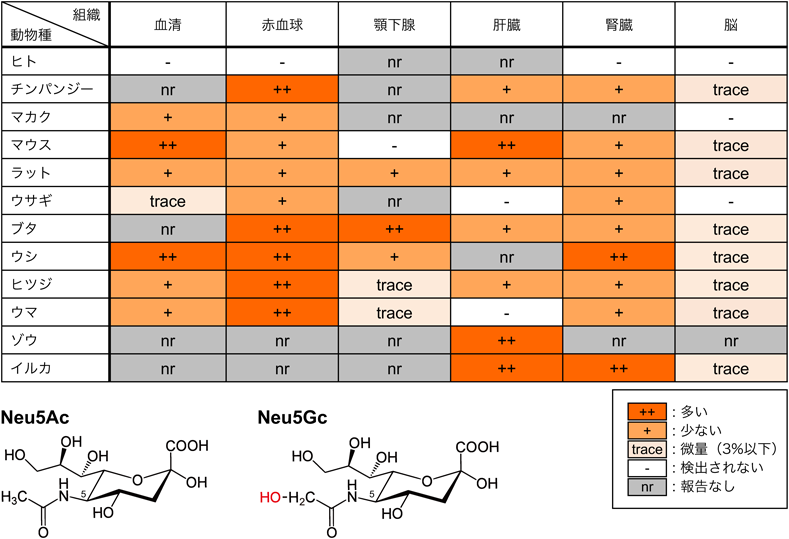
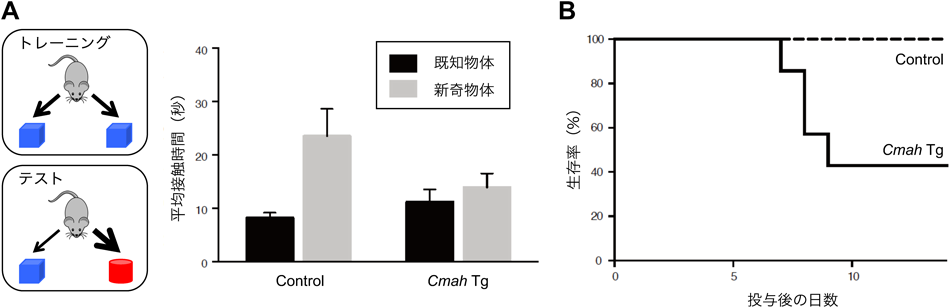
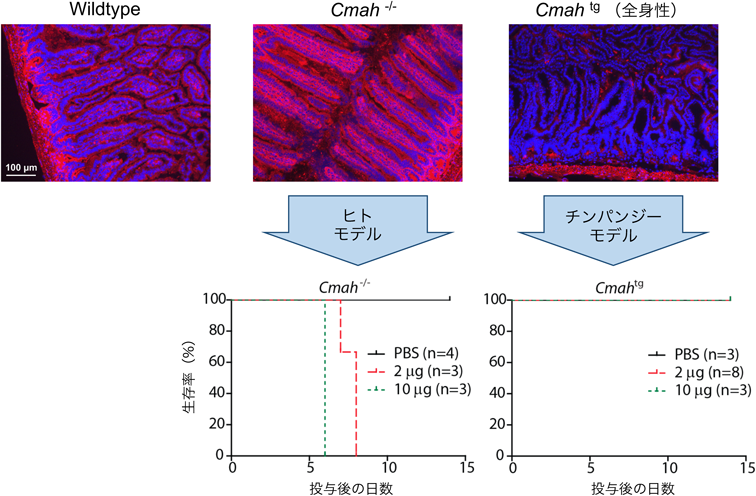
進化への影響を検証するシアル酸分子種改変マウスモデル研究Sialoglycan-modified mice to evaluate evolutional effects
藤田医科大学医療科学部放射線学科Faculty of Radiological Technology, School of Medical Sciences, Fujita Health University ◇ 〒470–1192 愛知県豊明市沓掛町田楽ケ窪1番地98 ◇ 1–98 Dengakugakubo, Kutsukake-cho, Toyoake, Aichi 470–1192, Japan