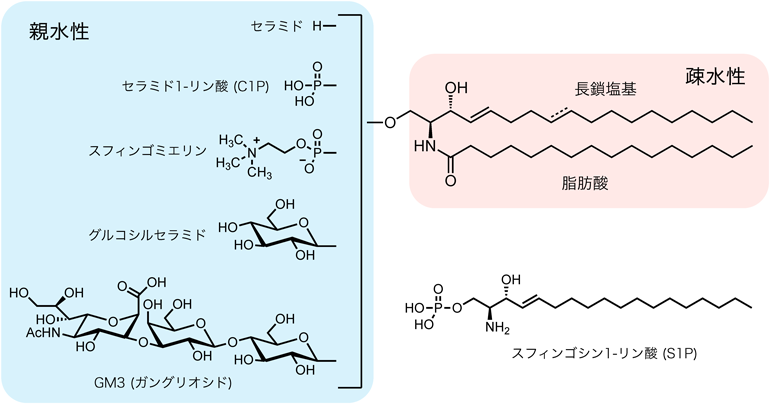
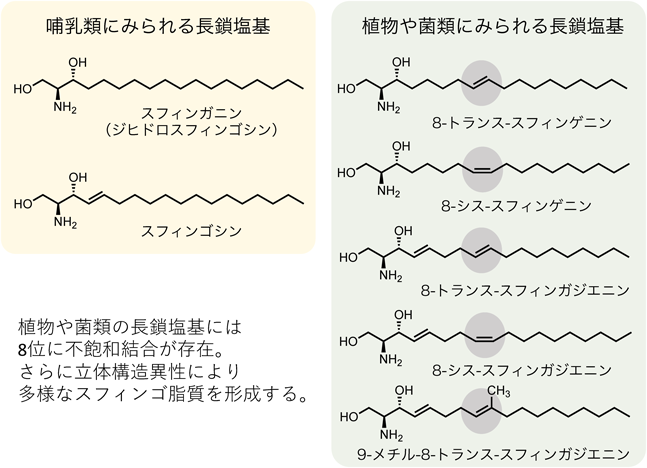
長鎖アミノアルコールの一種である長鎖塩基を基本骨格とする複合脂質はスフィンゴ脂質と呼ばれ,複合脂質は一般的にグリセロ脂質とこのスフィンゴ脂質の大きく二つに分類される.またスフィンゴ脂質はすべての真核生物および一部の原核生物中に確認されている.スフィンゴ脂質の名称は,ドイツのJ.L.W. Thudichumが約140年前に脳組織から脂溶性と親水性の両親媒性を持つ,不思議な脂質を初めて発見した際,神話に登場する人間の顔とライオンの身体を持つ謎めいた怪物スフィンクスになぞらえて名づけられた1).スフィンゴ脂質の中心的存在となるセラミドは,長鎖塩基とそのアミノ基が脂肪酸によりアシル化された生体内脂質であり,アミノ酸セリンとパルミチン酸を原料とするde novo合成により生合成される.特にセラミドC1位の水酸基の修飾により,さまざまな役割を持つスフィンゴ脂質が誘導される.修飾基を持たないものは一般的にセラミドと呼ばれ,皮膚の角質層の主要な成分として存在し,皮膚バリア機能,水分の保持機能に関わっている.セラミドの水酸基にスフィンゴミエリン合成酵素によりホスホコリンが修飾されるとスフィンゴミエリンとなる.スフィンゴミエリンは細胞膜,とりわけ脂質ラフト(脂質マイクロドメイン)に多く存在し,細胞内外の物質の輸送に大きく関与する.またセラミドはグルコースやガラクトース,シアル酸などの糖鎖が修飾されることでスフィンゴ糖脂質(ガングリオシド)となる.その糖鎖の多様性により400種以上のスフィンゴ糖脂質が存在し,細胞間どうしやタンパク質,生理活性物質–細胞間シグナル伝達などに大きく関与する.一方,長鎖塩基であるスフィンゴシン自体のC1位水酸基もリン酸化酵素(SPK1, 2)によりリン酸化されることでスフィンゴシン1-リン酸(S1P)となり,細胞膜に存在する7回膜貫通型のGタンパク質共役受容体であるS1P受容体(S1P1~S1P5の5種)を刺激し,炎症反応,免疫細胞の亢進,血管新生,神経機能の制御に関与する脂質メディエーターとなる2).また,最近ではヒストン脱アシル化酵素であるHDAC1, 2の活性阻害などエピジェネティックな核内修飾3, 4)への関与なども報告され,がんや神経疼痛などの新たな治療法への発展が期待されている(図1).
1)マイクロ波加熱と酵素(ケモエンザイマティック)反応による長鎖塩基の効率的調製法
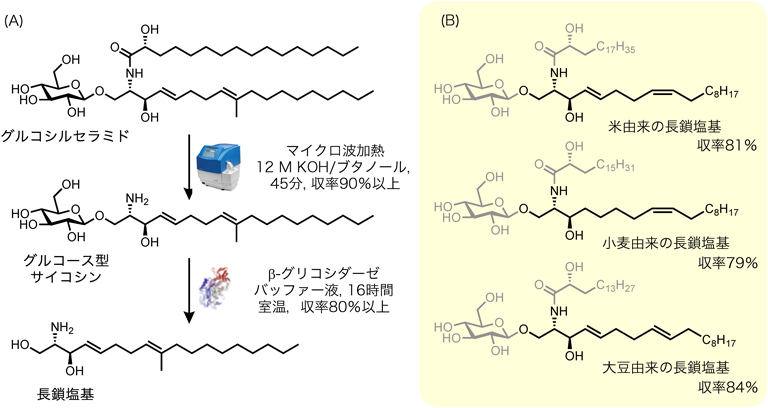
食品(植物)中には,スフィンゴ脂質が豊富に含まれることが知られており,そのほとんどはスフィンゴ糖脂質のグルコシルセラミドとして存在する.先に述べたように,これらの長鎖塩基構造は,哺乳類のものとはその構造の一部が異なり,多様性を示している.したがって,これら天然の長鎖塩基を有効利用することは,セラミドアナログの迅速なライブラリー創製につながる.特に,食品由来となれば,ヒトへの安全性もある程度担保される利点がある.グルコシルセラミドから長鎖塩基への調製方法は,脱アシル化および脱グルコシル化等の加水分解反応によって可能である.しかし,これまでに報告されている加水分解反応は,強酸および強塩基の存在下,加熱,長時間を要する過酷な反応であり,低収率,転位を伴う副反応,ラセミ化等が伴うため実用化には多々問題があった17–19).一方,酵素法は温和な条件で反応が進行するため,選択的かつ理想的な方法ではあるが,高価なendoglycoceramidase I(EGCase I)20)やsphingolipid ceramide N-deacylase(SCDase)21)は,ライブラリー創製を指向した大量供給には,現状では不向きである.そこで,我々は,段階的にグルコシルセラミドのアシル基の化学的加水分解を行い,化合物に親水性を保持させ,次に安価な酵素により糖部分を除去するケモエンザイマティックな方法を立案した.種々条件を検討した結果,アシル基の除去にはマイクロ波加熱のもとアルカリ加水分解が,糖部分の除去にはβ-グルコシダーゼを用いることが有効であることを見いだした.実際に,北海道で一般的に食される食用キノコであるタモギタケにはグルコシルセラミドが多く含まれることから,今回タモギタケを100グラム程度用いて,クロロホルム/メタノール/水の混合溶液でクロロホルム層に脂質群を抽出後,クロマトグラフィー精製によってグルコシルセラミド数グラムを単離した.これをマイクロ波照射下,12 M水酸化カリウム溶液によりアシル基を短時間で加水分解し,90%程度でグルコース型のサイコシンを得ることに成功した.このサイコシンは水への溶解が可能になり,入手容易なアーモンド由来のβ-グルコシダーゼを用いて脱グルコシル化反応を進行させ,これも90%程度の高収率で目的の長鎖塩基を得ることに成功した(図3A)22).さらに我々は,本法の有用性を確認するために米,小麦,大豆についてもグラム単位のグルコシルセラミドを抽出後,同様な処理を行った結果,いずれも高収率,グラムスケールで長鎖塩基を調製することに成功している(図3B)23).
2)樹脂固定型グルタルアルデヒドによる長鎖塩基の効率的精製法
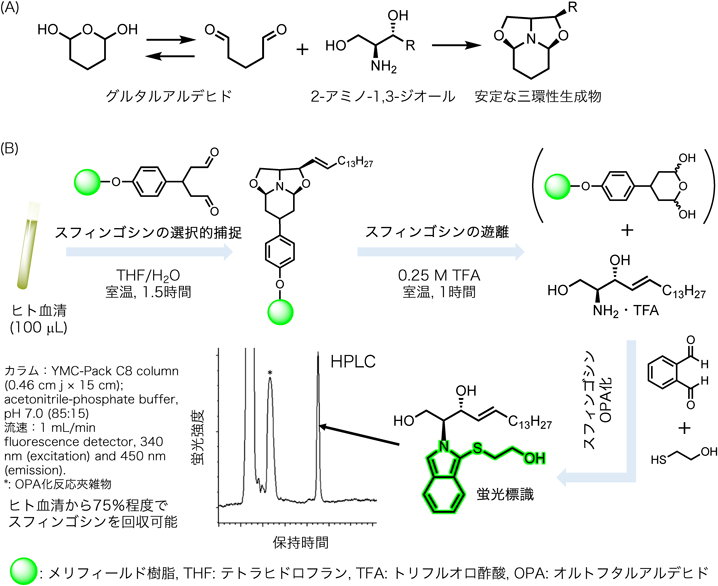
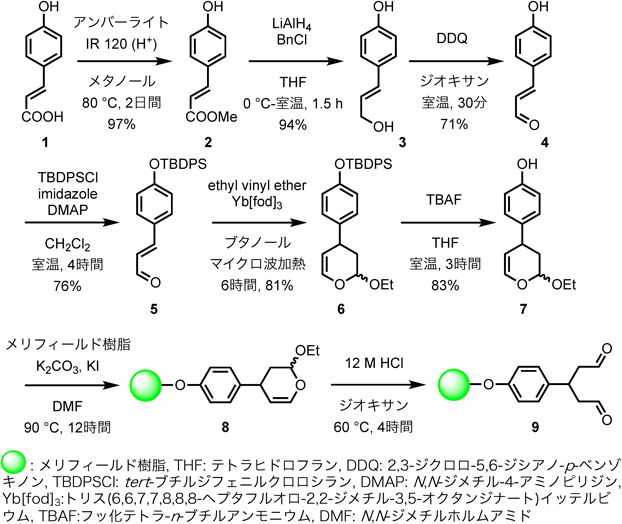
化学合成やスフィンゴ脂質の加水分解によって得られる長鎖塩基,生物体内の夾雑系に微量に存在する長鎖塩基の精製は,その両親媒性の性質から困難な過程であり,より効率的な方法が求められている.一般的なスフィンゴ脂質の抽出方法としてBligh-Dyer法24)やFolch法が知られているが,これらの手法は有機溶媒を多用することや煩雑な操作の点から,環境面やロス等の問題があり,簡便な精製方法の確立が望まれている.我々は,長鎖塩基を簡便に精製する方法として,官能基特異的反応を利用した固相抽出法の開発を提案した.すべての生物間における長鎖塩基の共通構造は,2-アミノ-1,3-ジオールを有している.これは,アミノ酸(タンパク質),糖,脂肪酸などの他の生体内小分子にはない長鎖塩基特有の構造上の特徴といえる.すなわち,この官能基に特異的に反応する化学反応を用いれば,長鎖塩基のみを選択的に捕捉することが可能となる.我々は,2-アミノ-1,3-ジオール構造とグルタルアルデヒドとの官能基特異的反応による三環性化合物生成に着目した(図4A).この反応は,水を含む有機溶媒中でも進行し,室温中,短時間,高収率で反応することから,生体試料への応用が十分可能な手法と期待した.しかし,グルタルアルデヒド構造はアルドール縮合による重合反応物を形成しやすいことや,酸化反応によりグルタル酸を形成しやすい難点から,グルタルアルデヒドを有効利用した例は少ない.そこで我々は,ペプチド固相合成等に用いられる樹脂にグルタルアルデヒドを固定化することでこれらの問題点を克服できると考え,グルタルアルデヒド固定型樹脂を開発した.初めに,trans-4-ヒドロキシケイ皮酸(図5,1)をエステル化(2),還元(3),酸化させることでアルデヒド(4)を調製した.フェノール水酸基をシリル基で保護(5)した後,エチルビニルエーテルとのYb触媒存在下,逆電子要請型ヘテロDiels-Alder反応によってジアステロ混合物(6)を合成し,シリル基を脱保護(7)した.樹脂はペプチド固相合成に用いられ,酸塩基や極低温条件に安定なメリフィールド樹脂を選択することで,塩基条件にて化合物(8)を効率よく固定化することに成功した.最後に酸性条件にて,ビニルエーテル環を加水分解することで樹脂固定型グルタルアルデヒドの創製に成功した(9).一部,水の付加によるジヘミアセタールがIRスペクトル解析によって確認された(図5)25).樹脂固定型グルタルアルデヒドは狙いどおり,重合反応が抑えられ,高凝集物や酸化物生成の抑制に成功し,乾燥冷蔵保存で1年間の保存にも耐えられることを確認した.我々は,予備実験としてスフィンゴシンを樹脂固定型グルタルアルデヒドと反応させたところ,86%の効率でスフィンゴシンを捕捉し,また0.25 M TFA処理によりスフィンゴシンを81%の効率で遊離することを確認した.さらに樹脂固定型グルタルアルデヒドの実用性を確認するため,ヒト血清中のスフィンゴシンの分離について検討した.100 µLの血清を400 µLのメタノールに溶解し遠心後,上清を回収,これにTHF(250 µL)とアルデヒド樹脂(5 mg)を添加し,1時間ほど混合撹拌した.ろ過により遊離タンパク質,糖類を除去し残渣として樹脂を回収した.樹脂を0.25 M TFA処理することで,捕捉スフィンゴシンを遊離させ,ろ液を回収することで,スフィンゴシンを簡便に精製することに成功した.回収したスフィンゴシンの収率は,オルトフタルアルデヒド(OPA)誘導化後,蛍光HPLCにて定量した.その結果,回収スフィンゴシンの濃度は280 nM程度(図4B)であったことから,既知文献情報26)の値の範囲内であった.以上のように,本法は煩雑な操作なく,短時間で極微量スケールから長鎖塩基を効率よく精製できる有用な手法と期待できる.
引用文献References
1) Thudichum, J.L.W.(1884) A Treatise on the Chemical Constitution of the Brain, Bailliere, Tindall and Cox, London.
2) Chun, J., Goetzl, E.J., Hla, T., Igarashi, Y., Lynch, K.R., Moolenaar, W., Pyne, S., & Tigyi, G. (2002) International Union of Pharmacology. XXXIV. Lysophospholipid receptor nomenclature. Pharmacol. Rev., 54, 265–269.
3) Hait, N.C., Allegood, J., Maceyka, M., Strub, G.M., Harikumar, K.B., Singh, S.K., Luo, C., Marmorstein, R., Kordula, T., Milstien, S., et al. (2009) Regulation of histone acetylation in the nucleus by sphingosine-1-phosphate. Science, 325, 1254–1257.
4) Alvarez, S.E., Harikumar, K.B., Hait, N.C., Allegood, J., Strub, G.M., Kim, E.Y., Maceyka, M., Jiang, H., Luo, C., Kordula, T., et al. (2010) Sphingosine-1-phosphate is a missing cofactor for the E3 ubiquitin ligase TRAF2. Nature, 465, 1084–1088.
5) Tsuji, K., Mitsutake, S., Ishikawa, J., Takagi, Y., Akiyama, M., Shimizu, H., Tomiyama, T., & Igarashi, Y. (2006) Dietary glucosylceramide improves skin barrier function in hairless mice. J. Dermatol. Sci., 44, 101–107.
6) Yuyama, K., Takahashi, K., Usuki, S., Mikami, D., Sun, H., Hanamatsu, H., Furukawa, J., Mukai, K., & Igarashi, Y. (2019) Plant sphingolipids promote extracellular vesicle release and alleviate amyloid-β pathologies in a mouse model of Alzheimer’s disease. Sci. Rep., 9, 16827.
7) Liu, J., Beckman, B.S., & Foroozesh, M. (2013) A review of ceramide analogs as potential anticancer agents. Future Med. Chem., 5, 1405–1421.
8) Vunnam, R.R. & Radin, N.S. (1980) Analogs of ceramide that inhibit glucocerebroside synthetase in mouse brain. Chem. Phys. Lipids, 26, 265–278.
9) Igarashi, Y., Hakomori, S., Toyokuni, T., Dean, B., Fujita, S., Sugimoto, M., Ogawa, T., el-Ghendy, K., & Racker, E. (1989) Effect of chemically well-defined sphingosine and its N-methyl derivatives on protein kinase C and src kinase activities. Biochemistry, 28, 6796–6800.
10) Abe, A., Inokuchi, J., Jimbo, M., Shimeno, H., Nagamatsu, A., Shayman, J.A., Shukla, G.S., & Radin, N.S. (1992) Improved inhibitors of glucosylceramide synthase. J. Biochem., 111, 191–196.
11) Abe, A., Radin, N.S., Shayman, J.A., Wotring, L.L., Zipkin, R.E., Sivakumar, R., Ruggieri, J.M., Carson, K.G., & Ganem, B. (1995) Structural and stereochemical studies of potent inhibitors of glucosylceramide synthase and tumor cell growth. J. Lipid Res., 36, 611–621.
12) Yatomi, Y., Ruan, F., Megidish, T., Toyokuni, T., Hakomori, S., & Igarashi, Y. (1996) N,N-dimethylsphingosine inhibition of sphingosine kinase and sphingosine 1-phosphate activity in human platelets. Biochemistry, 35, 626–633.
13) 門出健次,他4名(2016)SMS2阻害活性を有するセラミド誘導体,特願2016-007702
14) Mitsutake, S., Zama, K., Yokota, H., Yoshida, T., Tanaka, M., Mitsui, M., Ikawa, M., Okabe, M., Tanaka, Y., Yamashita, T., et al. (2011) Dynamic modification of sphingomyelin in lipid microdomains controls development of obesity, fatty liver, and type 2 diabetes. J. Biol. Chem., 286, 28544–28555.
15) Li, Z., Zhang, H., Liu, J., Liang, C.P., Li, Y., Teitelman, G., Beyer, T., Bui, H.H., Peake, D.A., Zhang, Y., et al. (2011) Reducing plasma membrane sphingomyelin increases insulin sensitivity. Mol. Cell. Biol., 31, 4205–4218.
16) Fan, Y., Shi, F., Liu, J., Dong, J., Bui, H.H., Peake, D.A., Kuo, M.S., Cao, G., & Jiang, X.-C. (2010) Selective reduction in the sphingomyelin content of atherogenic lipoproteins inhibits their retention in murine aortas and the subsequent development of atherosclerosis. Arterioscler. Thromb. Vasc. Biol., 30, 2114–2120.
17) Karlsson, K.A. (1970) On the chemistry and occurrence of sphingolipid long-chain bases. Chem. Phys. Lipids, 5, 6–43.
18) Sambasivarao, K. & McCluer, R.H. (1963) Thin-layer chromatographic separation of sphingosine and related bases. J. Lipid Res., 4, 106–108.
19) Cahoon, B.E. & Lynch, V.D. (1991) Analysis of Glucocerebrosides of Rye (Secale cereale L. cv Puma) Leaf and Plasma Membrane. Plant Physiol., 95, 58–68.
20) Ito, M. & Yamagata, T. (1986) A novel glycosphingolipid-degrading enzyme cleaves the linkage between the oligosaccharide and ceramide of neutral and acidic glycosphingolipids. J. Biol. Chem., 261, 14278–14282.
21) Nakagawa, T., Tani, M., Kita, K., & Ito, M. (1999). J. Biochem., 126, 111–119.
22) 門出健次,他4名(2014)糖スフィンゴシン及びスフィンゴイド塩基の製造方法,特願2014-215478
23) Gowda, S.G.B., Usuki, S., Hammam, M.A.S., Murai, Y., Igarashi, Y., & Monde, K. (2016) Highly efficient preparation of sphingoid bases from glucosylceramides by chemoenzymatic method. J. Lipid Res., 57, 325–331.
24) Bligh, E.G. & Dyer, W.J. (1959). J. Biochem. Physiol., 37, 911–917.
25) Gowda, S.G.B., Nakahashi, A., Yamane, K., Nakahashi, S., Murai, Y., Siddegowda, A.K.C., Hammam, M.A.S., & Monde, K. (2018) Facile Chemoselective Strategy toward Capturing Sphingoid Bases by a Unique Glutaraldehyde-Functionalized Resin. ACS Omega, 3, 753–759.
26) Lagana, A., Marino, A., Fago, G., Terregino, C., & Pardo-Martinez, B. (1994) An improved method for the determination of free sphingosine in serum. Chromatographia, 39, 85–90.