ヒトの母乳は常乳で12~13 g/L,初乳で22~24 g/Lのミルクオリゴ糖と呼ばれる複雑なオリゴ糖の混合物を含んでいる1).それは人乳においてはラクトース(Galβ1-4Glc)(60 g/L),脂質(35 g/L)に継ぐ3番目の固形成分であって,タンパク質よりも濃度が高い.母乳の中のラクトース,脂質,タンパク質などは,母乳摂取後に乳児によって消化吸収され,乳児のエネルギー源や骨格形成としての機能を担うが,大部分のミルクオリゴ糖は小腸での消化・吸収を受けないで大腸に到達し,栄養機能性成分とは異なる生理的役割を有している.そのような役割とは,母乳栄養児の腸管内でビフィドバクテリウム(ビフィズス菌)などの有用腸内細菌の増殖を促進する,有害細菌の腸管内付着を防止する,髄膜炎起因菌グループBストレプトコッカスの増殖を阻害する,低病原性のウイルス・細菌によるワクチン効果を高め感染を防御する,炎症性サイトカインの発現を抑制し免疫を調整する,ミルクオリゴ糖に含まれるシアル酸は脳神経系の成分合成素材として利用される,などである.ミルクオリゴ糖による腸管内ビフィドバクテリウム増殖促進効果は従来から報告されていたものの,その代謝系は解明されていなかった.しかしながら2000年代以降,各種のビフィドバクテリウムによるヒトミルクオリゴ糖(human milk oligosaccharides:HMOs)代謝系が詳細に解析された.本稿では,HMOsとヒト腸管マイクロビオータのグライコミクスとの関連性についての解説を中心に扱いながら,それ以外の機能についても簡単に紹介し,将来的なミルクオリゴ糖利用産業の発展を展望する.
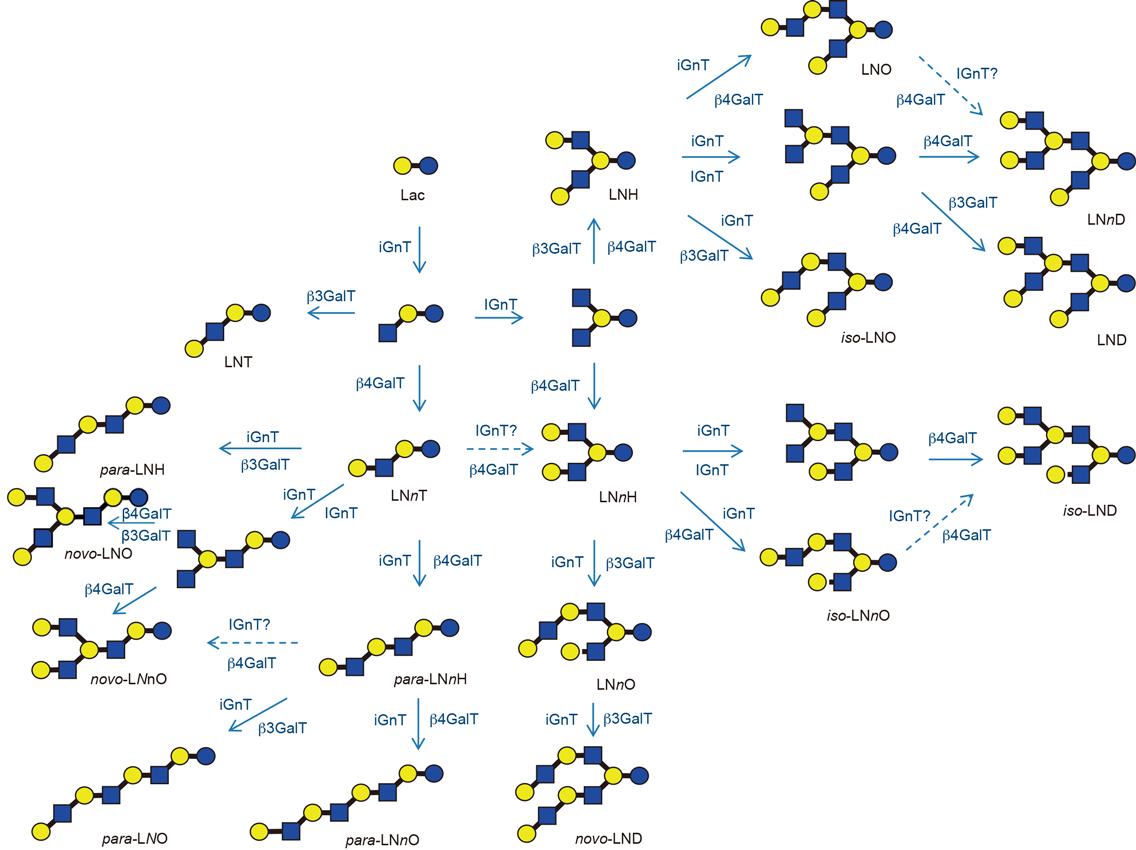
若干の例外を除きほとんどすべてのHMOsは還元末端側にラクトース単位を含み,それにN-アセチルグルコサミン(GlcNAc),ガラクトース(Gal),フコース(Fuc),N-アセチルノイラミン酸(Neu5Ac)が付加したような化学構造を有する.現在までに247種類のHMOsが分離され,そのうちの168種類の化学構造が決定されている(表1)1).各オリゴ糖の名称と略号もあわせて表1に示した.Urashimaら1)は近年Ashlineら2)の報告したHMOsを含む168種類の構造に基づき,20のコア骨格を提案した(表2).コア骨格に対してFucが非還元末端Galへα(1-2)結合,またはGlcNAcや還元末端Glcへα(1-3/4)結合,Neu5Acが非還元末端Galへα(2-3/6)結合,またはGlcNAcへα(2-6)結合することによって168種類へのバリエーションができ上がる.19のコア骨格[ラクト-N-ノボペンタオースI(lacto-N-novopentaose I)以外]の可能な生合成経路を図1に示した1).表2に示したコア骨格は,iGnT(β3N-アセチルグルコサミニルトランスフェラーゼ)の働きによって,ラクトースからGlcNAcβ1-3Galβ1-4Glcが作られ,続いてIGnT(β6N-アセチルグルコサミニルトランスフェラーゼ)の働きでGlcNAcβ1-3(GlcNAcβ1-6)Galβ1-4Glcが作られる.さらにβ3GalT(β3-ガラクトシルトランスフェラーゼ)あるいはβ4GalT(β4-ガラクトシルトランスフェラーゼ)が働いてラクト-N-テトラオース(LNT)かラクト-N-ネオテトラオース(LNnT),またはラクト-N-へキサオース(LNH)かラクト-N-ネオへキサオース(LNnH)ができ上がる.さらにそれらを基質として同じ糖転移酵素群が働いて糖鎖が伸長する実線で示した経路が予想される.また,LNnTを基質とする別のIGnTが働いて糖鎖が伸長する点線で示した経路の存在も予想される.HMOsのコア骨格の生合成経路は,まだ完全には解明されていない.
表1 ヒトミルクオリゴ糖(HMOs)の化学構造 |
 |
表2 ヒトミルクオリゴ糖(HMOs)の20コア骨格構造 |
LNTのようにGalβ1-3GlcNAc(ラクト-N-ビオースI, LNB)を含む糖鎖をタイプI, LNnTのようにGalβ1-4GlcNAc(N-アセチルラクトサミン,LacNAc)を含む糖鎖をタイプIIと分類するが,ヒトの母乳ではタイプI HMOsがタイプII HMOsよりも優先的である.それらの存在割合は泌乳期乳腺細胞におけるβ3GalTとβ4GalTの発現量によって決定されると予想される.コア構造を含むHMOsの生合成は,ラクトース同様に泌乳期乳腺細胞内のゴルジ体で行われ,ゴルジ膜に由来するエンドソームに包まれて細胞外に分泌されることが予想される.
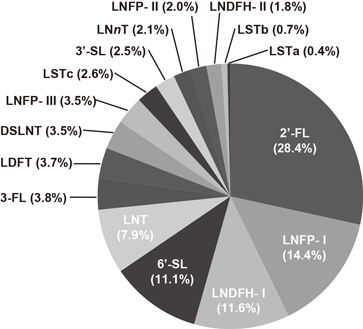
168種類のHMOsはすべての母親(ドナー)の母乳に含まれるわけではない.体液にABO式血液型物質が分泌されない非分泌型ドナーの母乳では,それが分泌される分泌型ドナーの母乳中で優先的なHMOsである2′-フコシルラクトース(2′-FL),ラクト-N-フコペンタオースI(LNFP-I),ラクト-N-ジフコへキサオース-I(LNDFH-I)など非還元末端Fucα1-2残基を有するオリゴ糖が検出されない1).またルイス陰性型ドナーの母乳にはラクト-N-フコペンタオース-II(LNFP-II)などFucα1-4残基を含むHMOsは検出されない1).母乳におけるこれらのHMOsが存在しないのは泌乳期乳腺細胞においてFUT2, FUT3などのフコシルトランスフェラーゼが発現しないことによる1).ルイス陽性分泌型ドナーの母乳ではすべてのHMOsが検出されている.分泌型,非分泌型,ルイス陰性型ドナーの割合は各々80%,15%,5%と算出されているが,ドナーの人種によってもそれらの割合の変動することが示されている1).母乳中の各HMOsの濃度は絶えず一定ではなくて,泌乳時期により変動する3, 4).代表的なHMOsの濃度は,分泌型,非分泌型,ルイス陰性型ドナーごとにさまざまな泌乳時期で報告されている4).分泌型ドナーとルイス陰性型ドナーの乳では2′-FL, LNFP-I, LNDFH-I, LNTの順で,一方,非分泌型ドナーの乳では3-FL, LNFP-II, LNTの順で優先的であった.分泌型ドナーの乳に含まれる代表的なHMOsの相対的な濃度割合を図2に示した.各オリゴ糖の重量パーセントは,図2に含めたHMOsの合計濃度を100%として算出した.
1)HMOsを添加した培地によるビフィドバクテリウムのin vitro増殖実験
従来,羊水も胎児の腸内も無菌であり,新生児は産道通過中に腟内細菌や出生時に母親の便に含まれる腸内細菌を受け渡され,それが母乳成分を栄養源として腸管に定着することで腸内フローラが形成されると考えられてきた.しかしながら近年細菌の検出方法が進歩したおかげで,細菌が羊水中に検出され,また乳児の腸内細菌は母親の母乳からも移行するという主張もある5).ミルクオリゴ糖も羊水の中からも検出されている.仮に一部母親からの体内循環や母乳から乳児への腸内細菌の摂取があったとしても,乳児への腸内細菌の伝搬は従来考えられている経路が主要なものと予想される.
ヒトの腸内に定着するビフィドバクテリウムによるHMOs代謝に関する研究は,HMOsを添加した培地での各菌株の増殖をモニターするin vitro実験から開始された.WardらはHMOsを1%添加した乳酸菌選択培地(MRS培地)に,Bifidobacterium longum subsp. infantis, B. longum subsp. longum, B. adolescentis, B. breve, B. bifidum株それぞれを接種し,37°Cで350時間まで培養して増殖測定試験を行った6).その結果,B. longum subsp. infantis株は他の菌株よりも約3倍高い細胞密度に達し,B. bifidum株はB. longum subsp. longum株,B. adolescentis株,B. breve株よりもわずかに高い増殖が観察された.
一方LoCascioらは独自のグリコプロファイリング法を使用して,in vitroでのビフィドバクテリウム株によるHMOsの消化追跡試験を行った7).彼らは,1.6%のHMOs画分を唯一炭素源とするMRS培地中で25時間または50時間B. longum subsp. infantis株,B. breve株,B. longum subsp. longum株を培養した後に培養上清中のオリゴ糖を回収し(分析のために)還元した.次いで出発量と同量の重水素化還元したHMOs画分を内部標準として添加し,MALDI-FTICR質量分析に供してから,重水素化/非重水素化したピークの割合によって同一分子量のHMOごとの分解率を定量的に調べた.その結果,B. longum subsp. infantis株の培養物では7糖以下のオリゴ糖が消費されたのに対し,7糖以上のオリゴ糖は部分的にしか消費されず,B. breve株およびB. longum subsp. longum株の菌株の培養物では,HMOsの一つであるLNTが25時間または50時間培養によって,各々24%,35%が消費されたのみであった.
一方Marcobalらは,2%のHMOsを唯一の炭素源として添加したZMB1培地(腸球菌および連鎖球菌の高細胞密度増殖を支える化学的に規定された培地)の中でB. longum subsp. infantis株の培養を行い,上と同様のMALDI-FTICR質量分析を用いたHMOs消費プロファイリング実験を行った8).その結果,LoCascioらとは異なるオリゴ糖の消費パターンが明らかにされた.この実験において7糖以下のオリゴ糖は完全消費されない一方,フコースを3残基また2残基含むオリゴ糖の消費は,フコースを1残基含むオリゴ糖や含まないオリゴ糖よりも高いことが示された.この実験において全HMOsの消費は45~65%であり,MRS培地を使用して培養したLoCascioらの実験よりも低かった.またMarcobalらは,Bacteroides fragilis株が同様に培養したB. longum subsp. infantis株よりもオリゴ糖消費が高い一方で,フコースを含まないHMOsや分子量の大きなHMOsを優先的に消費することを報告した.この論文は,バクテロイデスがHMOsを消費することを初めて示したが,バクテロイデスは母乳栄養児の腸管内で優占的な菌種でないことを考慮すると,腸管内でのビフィドバクテリウムとバクテロイデスの増殖や定着の競合には,HMOs以外の母乳成分や腸管や胆汁由来の成分の影響が大きいことを示唆している.
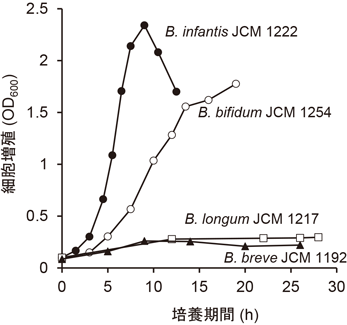
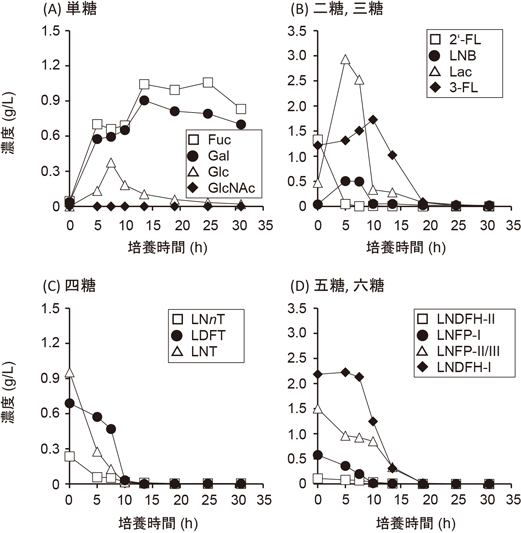
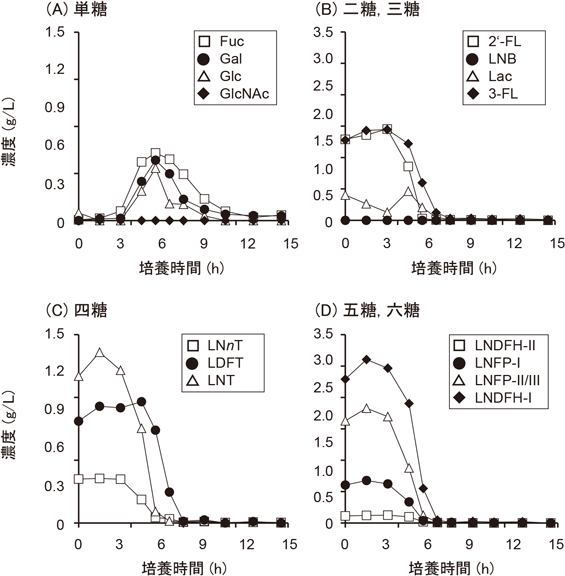
これらの研究はin vitro実験においてHMOsがビフィドバクテリウムによって消費されることを示した研究成果であり,重要な意義を持つが,研究で使用した方法では増殖に伴った各HMOsの消費状況を定量的に論じることができない.このような問題点を克服する上で,培養上清に残存する各HMOsの濃度を定量的に評価したAsakumaらの研究結果は意義深い9).Asakumaらは,1%のHMOsを唯一の炭素源とする半合成培地にB. longum subsp. infantis株,B. bifidum株,B. longum subsp. longum株,B. breve株を接種し,37°Cで30時間まで培養して増殖実験を行った.各菌株の増殖曲線を図3に示した.B. longum subsp. infantis株とB. bifidum株は高い細胞密度に達したが,B. longum subsp. longum株とB. breve株の増殖速度は低かった.B. bifidum株の増殖速度がLoCascioらの培養実験よりも高かったが,それは使用した菌株の違いによるものと考えられる.Asakumaらは,それぞれの菌株の培養時間ごとに培養上清に含まれるオリゴ糖や単糖の濃度を,2-アミノ安息香酸によるラベリングと順相系のHPLCによって定量測定した.その結果,B. bifidum株およびB. longum subsp. infantis株は,図4と図5に示したような各単糖やオリゴ糖の濃度変化が観察された.B. bifidum株では,それぞれのHMOsの濃度の低下速度に違いが見いだされ,中間的な生産物として0時間培養では検出されないラクトースとLNBの生産が認められた.また培養終了時に上清に単糖(FucとGal)の残存があった.一方,B. longum subsp. infantis株の培養上清のHMOsの濃度はある培養時間までは一定であるものの,突然に急減した.培養上清中の単糖はある時期に濃度上昇が認められたが,最終的には検出されなくなった.これらは後述するB. bifidum株とB. longum subsp. infantis株のHMOs代謝経路の違いによって説明づけることが可能である.B. longum subsp. longum株は培養上清にLNTの完全な消費とLNFP-1の部分的な消費が見いだされ,B. breve株はLNTの消費は見いだされたものの,それ以外のHMOsの濃度低下は見いだされなかった.
2)ビフィドバクテリウムにおけるHMOsの代謝経路
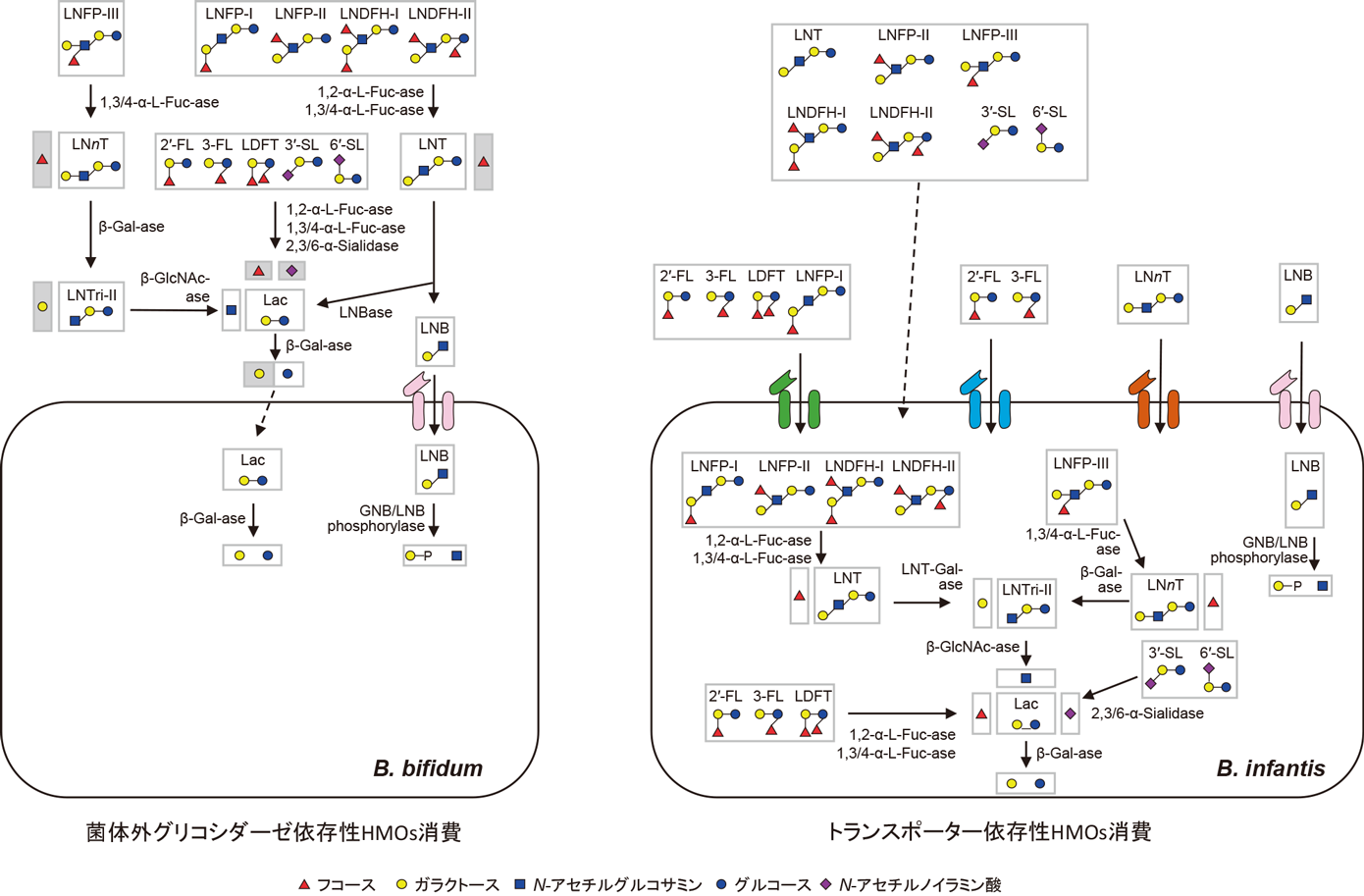
B. bifidumならびにB. longum subsp. infantisにおけるHMOs代謝経路は図6に要約した.
SelaらはB. longum subsp. infantis ATC C15697株のゲノム情報から,HMOsの細胞内輸送や加水分解に関わる輸送タンパク質や各種グリコシダーゼの遺伝子が集まった43 kbpの領域のあることを発見し,HMOsクラスター1と命名した10).同菌株ははじめに未消化のHMOsを輸送タンパク質の働きで菌体内に取り込み,次いでシアリダーゼ,フコシダーゼ,β-N-アセチルヘキソサミニダーゼ,β-ガラクトシダーゼの作用によって非還元末端より順次単糖に加水分解する.培養上清においてすべてのHMOs量が急減する段階(図5参照)で,輸送タンパク質によるHMOsの菌体内取り込みが行われていると予想される.
B. longum subsp. infanis株においては,2種のα-シアリダーゼ遺伝子が存在するが,そのうちの1種はHMOsによる増殖によって発現が上昇し,α2-3ならびにα2-6結合したN-アセチルノイラミン酸を含むHMOsからそれを効率的に遊離する.一方,HMOsクラスター1内でコードされる2種のα-フコシダーゼは,HMOsによる増殖によって発現が上昇し,2′-FLならびに3-フコシルラクトース(3-FL)からフコースを遊離する.また2種のβ-N-アセチルヘキソサミニダーゼが発現され,1種はGlcNAcβ1-6Gal結合を,他の1種はGlcNAcβ1-3Gal結合を加水分解すると予想されている11).HMOsクラスター1内でコードされるβ-ガラクトシダーゼはN-アセチルラクトサミンやLNnTを基質とし,Galβ1-4GlcNAc結合を加水分解することはできるが,LNTやLNBを基質とすることはできず,Galβ1-3GlcNAc結合を切断しない.一方,HMOsクラスター1内にコードされない3種のβ-ガラクトシダーゼ遺伝子がクラスターの外側に存在し,そのうちの1種の酵素はLNTなどタイプI HMOsを加水分解することができる12).このことからHMOsの中で優先的なタイプI HMOsは,HMOsクラスター1内の各種グリコシダーゼと,クラスターには含まれないβ-ガラクトシダーゼによって消費されることが予想される.またこのβ-ガラクトシダーゼはGalβ1-3Gal, Galβ1-4Gal, Galβ1-6Galも加水分解することができ,ガラクトオリゴ糖の代謝にも関わることが予想された13).
B. bifidumによるHMOsの代謝経路は,KitaokaやKatayamaによって解明された14).B. bifidum JCM1254株から菌体外でフコシルHMOsからフコースを遊離する1,2-αフコシダーゼと1,3/4-α-フコシダーゼをコードする遺伝子,ならびにシアリルHMOsからN-アセチルノイラミン酸を遊離する2種のシアリダーゼをコードする遺伝子が発見され,クローニングされている.LNTを分解してLNBとラクトースを遊離する菌体外ラクト-N-ビオシダーゼも単離・精製され,これらの酵素の働きでLNT, LNFP-1, LNFP-II, LST a(Neu5Acα2-3Galβ1-3GlcNAcβ1-3Galβ1-4Glc)などタイプI HMOsからLNBとラクトースが遊離する.それはAsakumaらが行ったHMOsを唯一炭素源とするin vitro培養実験において観察された結果とも一致する(図4参照).LNBは特異的な輸送タンパク質の働きによって菌体内に取り込まれ,ラクト-N-ビオース/ガラクト-N-ビオースホスホリラーゼによって過リン酸分解されてGal-1-PとGlcNAcを生成し,Gal-1-Pはルロアール経路による解糖系に入る.GlcNAcはN-acetylhexosamine 1-kinaseの作用でGlcNAc-1-Pに変換され,次いでUDP-glucose hexose 1-phosphate uridylyltransferaseの作用でUDP-GlcNAcに変換された後,アミノ糖の代謝経路に入る.一方,タイプII HMOsは菌体外β-ガラクトシダーゼやβ-N-アセチルヘキソサミニダーゼの作用によって,非還元末端より逐次加水分解を受ける.
B. breveとB. longum subsp. longumは,HMOsを唯一炭素源とするタイプ株を使用したin vitro培養実験では高い増殖は達成されなかったが(図3参照),母乳栄養児の腸管内では高い割合で定着していることが糞便のマイクロフローラ分析から示されている.タイプ株以外の母乳栄養児の便から分離された株にHMOs資化性があるかどうか注目されたが,Ruiz-Moyanoらは3~4か月の40人の母乳栄養児の糞便から分離されたB. breveの菌株を使用し,全HMOs, LNTとLNnT, 2′-FLと3-FL,また3′-SLと6′-SLを唯一炭素源として増殖試験を行った15).その結果,いくつかの株でHMOsを炭素源とした緩やかな増殖が観察され,B. longum subsp. infantis ATC C15697株ほどではないものの高い増殖速度が観察された.すべての株でLNT/LNnTを炭素源とした高い増殖性が観察されたが,若干の株のみがフコシルHMOsを炭素源として増殖した.またLoCascioらと同様のグリコプロファイリング法でHMOsの消費を測定したところ,6株で23~42%のHMOsを消費することが明らかにされた.また分離した株においてグリコヒドロラーゼ遺伝子の探索を行ったところ,すべての株でβ-N-アセチルヘキソサミニダーゼ,α-フコシダーゼをコードする遺伝子が,多くの株でα-シアリダーゼをコードする遺伝子が発見された.
B. longum subsp. longumは,HMOsを炭素源として増殖した場合LNTを消費するが,それを証明するようにラクト-N-ビオシダーゼがクローニングされた16).同酵素はB. bifidumのラクト-N-ビオシダーゼとは相同性が低く,LNFP-IやLST aも基質とすることのできる新規酵素である.また同酵素の発現には,遺伝子どうしがオペロンを構成する他のシャペロンタンパク質の発現を必要とする点も興味深い.
B. longum subsp. infantisとB. bifidumによるHMOs代謝経路は上述したように明らかにされたが,Matsukiらは母乳栄養児の便から単離したビフィドバクテリウムにフコシルラクトース(FL)利用に特化したそれ以外のHMOs代謝経路のあることを明らかにした17).かれらは乳児便から分離した29株のビフィドバクテリウムのうちHMOs培地で高い増殖性を示した14株を選抜した.それらの株の大半はLNTを利用して増殖したものの,FLを利用した増殖は株依存的であって大きな違いが見いだされた.彼らはFL利用に関わるフコシダーゼ遺伝子などを探索したところ,FL利用株に共通してパーミアーゼ遺伝子やフコシダーゼ遺伝子に隣接した位置にABCトランスポーターシステムに関わる基質結合タンパク質(SBP)を発見し,それはFL輸送を媒介すると仮定した.そのようなFL-SBP遺伝子をノックアウトしたB. breve BR-A29株に対してHMOs添加培地で培養を行ったところ,限定的な増殖しか示さなかった.さらに乳児をFL利用ビフィドバクテリウムの優先的な腸内細菌叢を持つクラスターB1とFL非利用ビフィドバクテリウムの優占的なクラスターB2に分け,エンテロバクター優占叢を持つクラスターEを含めて便有機酸,pHおよび残存HMOs濃度を比較したところ,クラスターB1にはB2やEと比べて有意に高い酢酸濃度と低いpHおよび残存HMOs濃度が観察された.これらの結果は乳児の腸内ビフィドバクテリウムの中にFL-SBPを有し,FLを優先的に利用する菌株のあることを示している.
一方SakanakaらはB. longum subsp. infantis JCM1222T株に基質特異性の異なるFL-SBP遺伝子(FL1-BPとFL2-BP)を発見し,そのいずれかまた両方をノックアウトした株を作製して2種のFLやLNFP-1, LDFTに対する増殖性の比較を行った18).その結果,FL1-BPをノックアウトした株では2′-FLと3-FLに対する増殖性が低下したが,FL2-BPノックアウト株では低下しなかった.両者とも発現しない株では2′-FLでの増殖低下,3-FLでの著しい増殖低下,およびLDFTでの増殖停止が観察されたが,FL1-BPノックアウト株ではLDFTでの増殖はやや低下した程度であった.LNFP-1での増殖はFL2-BPノックアウト株以外では高かった.この結果は,Matsukiらによって発見されたFLトランスポーターには基質特異性の異なる2種があり,ビフィドバクテリウム株での二つのFLトランスポーターの局在によってビフィズスフローラ(各種のビフィドバクテリウムによる腸内細菌叢)が影響を受ける可能性を示唆している.実際に,30組の母子ペアからそれぞれ母乳および糞便を回収して,オリゴ糖の消長解析と遺伝子解析を行ったところ,FL2-BP遺伝子とビフィズスフローラ形成率には高い正の相関がみられた.また,FL2-BP遺伝子が糞便中に多いほど,糞便中の母乳オリゴ糖基質濃度が少なくなっていた.これらのことは,FLトランスポーターを有するビフィズス菌が,乳児腸管内において母乳オリゴ糖を消費することで増殖していることを強く示唆している.
Zabelらも2′-FLを唯一炭素源として増殖したB. longum subsp. infantis Bi-26株のトランスクリプトーム分析からいくつかのABCタイプ糖輸送体クラスターの発現上昇を確認しているがそれは,クラスター内に上述したようなFLトランスポーター遺伝子の含まれる可能性を示唆している19).一方Salliらは乳児の結腸をシミュレーションした発酵容器において,母乳栄養児または人工栄養児から回収した便を2′-FLを唯一炭素源として発酵し,2′-FLを加えないコントロールに対して発酵容器内の細菌叢の変化と生成した短鎖有機酸量の測定を行った20).その結果,2′-FLを炭素源とした発酵シミュレーションにおいて,ビフィドバクテリウムの増殖促進や乳酸,酢酸の生産が認められたが,ガラクトオリゴ糖(GOS)やラクトースを炭素源とする場合よりも細菌叢の変化は小さく,酸の生産量も小さかった.
Jamesらは,完全母乳栄養児の便から2′-FLを唯一炭素源として増殖するB. kashiwanohense APCKJ1株を分離し,ゲノム解析を行うとともに2′-FLを炭素源として増殖した後のトランスクリプトーム分析を行って転写上昇した遺伝子クラスターを特定した21).同クラスター内に含まれる遺伝子のB. breve UCC2003株への選択的な導入実験から,クラスター内には隣接する2種のα-フコシダーゼをコードする遺伝子とともに,フコシルラクトースの摂取と菌体内輸送に関わる1種の基質結合タンパク質と2種のパーミアーゼをコードする遺伝子の存在が明らかにされた.2種のα-フコシダーゼのうちの1種は2′-FLとともに3-FLを基質とするが2′-FLへの基質特異性が高く,他のα-フコシダーゼは3-FLへの厳密な基質特異性を有していた.
HMOsを唯一の炭素源として培養したタイプ株によるin vitro増殖では増殖性が非常に低かったB. breveやB. longum subsp. longumが,実際に母乳栄養児の腸管に定着できる理由として,腸管内に生息している菌株によるB. longum subsp. infantisと同様の代謝経路の利用やFLトランスポーターを利用したフコシルHMOsの利用が考えられた.一方,HMOsで高い増殖性を示さなかったB. breveやB. longum subsp. longumを含めたビフィドバクテリウム4菌株はいずれもラクト-N-ビオース/ガラクト-N-ビオースホスホリラーゼを持ち,LNBを炭素源とした増殖性は高い.またB. bifidumが単糖(FucやGal)の利用は低い一方で,B. breveはそれらやNeu5Acを炭素源として利用することも知られている.つまり,B. breveにはB. bifidumがラクト-N-ビオシダーゼの働きで菌体外に分泌したLNBやタイプII HMOsから菌体外に遊離した単糖を利用して増殖するcross feedingによる腸管内定着のメカニズムも予想される.それを証明するような研究結果が報告されている.GotohらはHMOsを唯一の炭素源として母乳栄養児1名と離乳後の幼児2名,成人2名の便を添加した培養系にB. bifidum株を添加し,B. bifidumやそれ以外のビフィドバクテリウム種の菌数の変化を測定した22).もともとの便に含まれるB. bifidumの菌数は乳児サンプルでは非常に低かった.成人便サンプルではB. bifidum株の添加により他のビフィドバクテリウム種の菌数上昇は低かったが,乳児便培養物では1,700~10,000倍も上昇していた.B. bifidum株を添加しない乳児便培養物では,2′-FL, LNFP-1, LNFDFH-1などが検出されたが,B. bifidum株を添加培養した場合には検出されなかった.この結果は,母乳栄養児の腸内においてB. bifidumが優先占的な菌株ではないものの,その存在が他のビフィドバクテリウムの定着に重要な役割を有していることを示唆する.
1人の母乳栄養児の腸内に定着するビフィドバクテリウム株どうしのcross feedingは,B. bifidumを仲介しないものもある.Lawsonらは3人の母乳栄養児の便から分離したB. longum subsp. infantis株,B. breve株,B. longum subsp. longum株およびB. pseudocatenulatum株のゲノム解析,および2′-FLまたはLNnTを唯一の炭素源とする単独培養によってHMOs利用株と非利用株に分類した23).2′-FLまたLNnTを唯一炭素源としてHMOs利用株の培養を行った後,回収した培養上清を培地としてHMOs非利用株の培養を行ったところ,組合わせによっては非利用株の増殖が観察された.彼らはまた1H-NMRを使用して,HMOs利用株培養後とその培養上清を培地とするHMOs非利用株培養後の代謝生成物の分析を行った.この結果,1人の乳児の便から分離された異なる菌種間で,HMOsを介したcross feedingの可能なことが示唆された.これはHMOsを介したcross feedingを探索する方法として注目される.
上述のように母乳の中のHMOsプロファイルにはドナーの分泌型,非分泌型,ルイス陰性型によって違いがあるので,それらの母乳を摂取した母乳栄養児の腸内細菌叢に違いがあるかどうか興味が持たれる.それらを解析するパイロット研究が世界の数か所で行われている.
2012年12月~2013年10月にオーストラリアのクイーンズランドに集まった37人の乳児(2.2~3.1歳,平均年齢2.67歳)と17人の母(20.9~43.9歳,平均35.25歳)を対象にした調査がSmith-Brownらにより行われた24).血液または唾液を解析し,母親と乳児が分泌型あるいは非分泌型かを調査した結果,分泌状態を明らかにすることのできた乳児28人のうち,20人は分泌型(71%)であり,母親17人のうち11人が分泌型(65%)であった.また,乳児の糞便の細菌叢を門(Actinobacteria, Bacteroidetes, Firmicutes, Proteobacteria)および属レベルで調査し,乳児の分泌型/非分泌型,また母親の分泌型/非分泌型間で比較したところ,非分泌型乳児の腸内細菌叢は分泌型乳児よりもプレボテラ属の占める割合が有意に高かった.また,分泌型あるいは非分泌型の母親を持つ11人の乳児を4か月間完全母乳栄養で育てた後,糞便細菌叢を調査した結果,分泌型の母親を持つ乳児でビフィドバクテリウム属の割合が高く,バクテロイデス属には違いはみられなかった.
Lewisらは,44人の母親から分娩後6, 21, 71, 120日目に母乳を,同じ日に母乳栄養児の糞便を採取し,母乳と糞便中のHMOsプロファイルとともに糞便中の細菌叢を解析した25).母乳107サンプルのうち35サンプルは非分泌型ドナー(12人,33%)から,72サンプルは分泌型ドナー(32人,67%)からの採集であった.糞便中の菌叢解析の結果,分泌型の母親を持つ乳児では非分泌型の母親を持つ乳児と比べビフィドバクテリウムとバクテロイデスの割合が相対的に高く,ユーバクテリウム,クロストリジウムおよびストレプトコッカスが低かった.また,絶対量で比較しても分泌型の母親を持つ乳児ではビフィドバクテリウムの菌数が有意に高かった.
Baiらは,2016年5月~2017年12月にかけ両親が中国北部出身の56組の母子から母乳と糞便を回収し,母乳中のHMOsと糖タンパク質N-グリカンの分析と乳児糞便細菌叢の解析を行い,分泌型母乳を摂取した母乳栄養児と非分泌型母乳を摂取した母乳栄養児の糞便細菌叢を比較した26).被験者の23%に相当する13人が非分泌型であった.全HMOs濃度およびフコシルHMOs濃度は特に泌乳初期において分泌型母乳の方が非分泌型母乳よりも高く,乳タンパク質のフコシルN-グリカン濃度も同様の傾向であった.母乳栄養児の糞便細菌叢を比較すると,非分泌型母乳摂取乳児よりも分泌型母乳摂取乳児の方がビフィドバクテリウムの占める割合が高かった.ビフィドバクテリウムは4菌種が検出され,出生後6日と42日の分泌型母乳摂取乳児の糞便細菌叢においてB. pseudocatenulatum種が最も優占であった.同菌種は中国以外の母乳栄養児の腸内細菌叢では優占菌種ではなく,B. longum subsp. longum種,B. longum subsp. infantis種,B. breve種の方が優占的である.この違いは地理的あるいは民族的な違いによるかもしれない.また,出生後6日の分泌型母乳摂取乳児の糞便細菌叢では非分泌型母乳摂取乳児よりもActinobacteria門が優占的であった.出生後180日ではラクトバチルスとストレプトコッカスは分泌型母乳摂取乳児において,バクテロイデスは非分泌型母乳摂取乳児において優占的であった.
これら三つのパイロット研究の結果,いずれも母乳栄養児の腸内細菌叢において,2′-FLやLNFP-1を含む分泌型ドナーの母乳を摂取した乳児の腸内細菌叢の方が,非分泌型ドナーの母乳を摂取した乳児よりもビフィドバクテリウムの優占率の高いことが示された.これは腸内ビフィズスフローラの形成において,MatsukiらやSakanakaらによって発見されたFLトランスポーターの働きがビフィドバクテリウムのHMOs利用に寄与していることを示唆する17, 18).
出生後のまもない時期に,母乳中のどのHMOsをどのビフィドバクテリウムが利用して腸内増殖と定着を行うのかについては,母乳栄養児の便に残存するHMOsのプロファイルと乳児の糞便での細菌叢を分析することでヒントが得られるであろう.母乳HMOs組成と1か月母乳栄養児の糞便微生物組成に相関はあるか,HMOs分解は乳児の糞便細菌コミュニティーや乳児腸管に特異的に定着する細菌系統とリンクするかどうか,オランダ南部の母子を対象としたパイロット研究が行われた27).対象者は2002~2003年に自然分娩または帝王切開出産した母親とその乳児で,母乳と同じ日の朝に回収した乳児便サンプルを対象とし,それぞれの代表的なHMOsの濃度測定と便中の細菌叢が解析された.乳児腸管におけるHMOs消費は,母乳と対応する乳児便のHMOsプロファイルに基づき,HMOsの“低”消費,“中”消費,“高”消費に分類するとともに,それぞれの乳児の便細菌叢において異なる細菌属の同定が試みられた.腸内フローラの三つのユニバーサルなパターンとして,さまざまな細菌属が混合した割合を持つクラスターA,ビフィドバクテリウム優占的コミュニティーを持つクラスターB,ビフィドバクテリウムとバクテロイデスの優占的コミュニティーを持つクラスターCに分類された.HMOs消費の効率はクラスターAの“高”で40%,“中”で10%,“低”で49%,クラスターBの“高”で47%,“中”で21%,“低”で26%,そしてクラスターCの“高”で48%,“中”で24%,“低”で26%であった.2′-FL, LNFP-II, LNFP-III, LDFT, 6′-SL消費にはクラスター間で差があった.このようなパイロット研究の実施例が増えることで,HMOsプロファイルと腸内フローラ形成の関係が理解されるであろう.
HMOsには母乳栄養児の有用腸内細菌の増殖を促進するプレバイオティクスとしての機能以外に,病原体の感染防御,免疫調整,壊死性腸炎予防,脳神経機能活性化などの機能性が証明されている.それら研究の一部を簡単に紹介する.
1)抗感染
HMOsによる病原性細菌やウイルスに対する感染防御研究の多くは,従来は上皮細胞と細菌・ウイルスとの共培養系を使用し,接着阻止メカニズムによるin vitro研究によって行われてきた.つまり,HMOsを添加して培養した後に細胞に付着したウイルス・細菌の量を測定し,HMOs無添加コントロールに比べて吸着量が低下するかどうかを観察する方法である.たとえば以下のような実施例がある.尿細管上皮由来のMA-104細胞に対してロタウイルス(RV)株とともにHMOs(3′-SL, 6′-SL,全HMOs混合物)を1~10 mg/mLの濃度で添加して培養した後,細胞に吸着したRV量を測定したところ,HMOsの添加において無添加コントロールよりも吸着量が少なく,感染抑制が観察された28).
HMOsによる感染防御には免疫能力の向上による効果のあることがin vivo実験によって実証されている.たとえば以下のような実証例がある.6週齢の雌マウスに0.25~5%の2′-FLを添加した食餌を与え,2週間後に右耳に不活性化インフルエンザワクチンを,対照として左耳に生理食塩水を皮下注射し,さらに9日後にワクチンを追加接種してから,追加ワクチン接種前と接種24日後に炎症反応の有無を耳厚により評価した.その結果2′-FL摂取マウスはコントロールと比較して2′-FL 0.25~2.5%濃度で濃度依存的に有意な炎症反応の増加を認めるとともに,インフルエンザウイルス特異的IgG1とIgG2a抗体はコントロール群よりも増加した29).
HMOsによる有害細菌・ウイルスへの抗感染作用はこのように宿主への付着阻止や免疫向上による効果が示唆されてきたが,最近髄膜炎起因菌グループBストレプトコッカス(GBS)に対してはHMOsの添加で増殖が抑制できることが報告された.血清タイプIII,タイプIa,タイプV GBS株への0.25~1.0 mg/mLのHMOs混合物の添加によって,それらの増殖は濃度依存的に抑制された.全HMOsのうちLNTとLNFP-1には5 mg/mLで増殖抑制効果が示されたが,LNnTにはそのような効果は観察されなかった30).一方他の研究において,1%HMOsとともに各種の抗生物質を添加して3株のStreptococcus agalactiaeの培養を行ったところ,エリスロマイシン,ゲンタマイシン,ミノサイクリンなどによる最小増殖抑制濃度を16分の1から32分の1に低下させた31).
2)抗炎症
乳児が母乳を摂取した後,大部分のHMOsは消化・吸収されないで大腸に到達する.HMOsが母乳栄養児の尿に発見されることから,一部が吸収されて体内循環することが示唆されてきた.最近母乳摂取後に採集された乳児の血漿において,2′-FL, 3-FL, LNnTなどが検出され,一部は実際に吸収されることが明らかになった32).体内循環する過程でHMOsは上皮細胞や内皮細胞,血液細胞などと相互作用し,抗炎症性作用を発揮することがin vitroやin vivoの実験において実証されている.たとえば,2′-FL, 3-FL, 6′-SL, LNnT, LDFTなどを血小板に添加して培養し,トロンビンによる活性化後ケモカインRANTESや腫瘍壊死因子様可溶性CD40リガンドの生産量を測定したところ,2~10 mg/LのLDFTの添加によって無添加コントロールと比較してRANTESの生産量が強く抑制された33).
また食品アレルギーを持つオボアルブミン(OVA)感作マウスに2′-FLや6′-SLを経口投与し,下痢や栄養障害スコア,脾臓細胞の炎症性サイトカイン生産量,マスト細胞数をコントロール群と比較したところ,それらの摂取は下痢や栄養障害スコアを改善し,マスト細胞数やTNFなど炎症性サイトカイン発現量を低減することが示された34).
3)壊死性腸炎予防
母乳の摂取は,未熟児にしばしば深刻な症状をもたらす壊死性腸炎(NEC)のリスクを低下させることが指摘されてきたが,HMOsがその予防と症状の緩和に効果を持つことがin vivo実験によって示された.妊娠期の母ラットに対し炎症誘発剤を注入することで出生してくる乳仔ラットにNECを誘導し,次いで母親と一緒に飼育する群(DAM群),全HMOs(10 mg/mL)を含む調合乳摂取群(HMOs群),ならびにそれを含まない調合乳を摂取させたコントロール群に分けて飼育し,96時間後に結腸を回収した.それぞれに群ごとの炎症をスコア化したところ,HMOs群のスコアはコントロールよりも有意に改善し,DAM群に近かった.続いて全HMOsを負電荷によって分画した画分を用いて同様の試験を行ったところ,シアル酸を2単位含む画分に特異的にNEC改善効果が発見され,活性成分の構造決定の結果,ジシアルルラクト-N-テトラオース[Neu5Acα2-3Galβ1-3(Neu5Acα2-6)Galβ1-4Glc, DSLNT]にその効果があることが明らかにされた35).
HMOsによるNEC防御に対するメカニズムに対しては,腸管バリア機能の回復であることを示唆する報告がある.HMOs(20 mg/mL)を添加した調合乳を摂取させたマウス乳仔に対し低酸素曝露とLPS投与によってNECを誘導し,次いで結腸を回収して炎症スコアを測定したところ,HMOs投与群にコントロール群よりも有意な改善が発見された.摘出した組織の染色と顕微鏡観察から,コントロール群でNEC発症による腸上皮Muc2+細胞の損傷が認められたが,HMOs添加群では同細胞数が高く維持されていた.LS174細胞を使用したin vitro培養実験ではHMOs添加時にMuc2の発現上昇が観察された36).
Wangらも,NEC誘導乳仔ラットへのHMOs(20 mg/mL)投与後の炎症スコアと致死性の改善を検討し,そのメカニズムの探索を行った37).NEC誘導ラットおよびHMOs摂取群の血清と回腸における炎症性サイトカインIL-6とIL-8濃度と,回腸のTLR4タンパク質とpNF-kBの発現量を測定した結果,HMOs摂取群に血清と回腸でのそれらの発現レベル低下が観察された.またNEC誘導ラットならびにHMOs摂取群から回収した腸管上皮幹細胞を含むオルガノイドの培養と,増殖細胞マーカーKi67や腸上皮幹細胞マーカーSOX9の観察から,低下したKi67とSOX9陽性細胞数のHMOs摂取後の回復が示された.
Wertsらは,未成熟なマウス腸エンテロイドを使用した実験において,NECは低酸素曝露ならびにNECを患った患者からの腸内細菌の摂取によるネクロプトーシスによって誘導されるが,それは2′-FLやヒト母乳の添加によって阻害されることを示した38).これは2′-FLなどHMOsによるNEC防御の可能なメカニズムを示唆している.
4)脳機能活性化
シアル酸を含むHMOsの経口摂取によって吸収されたシアル酸が,脳内でのシアリル複合糖質の合成材料として利用されることを示唆する報告がある.仔ブタに2~4 g/Lの3′-SLを含む調合乳を21日間摂取させ,次いで脳を回収して大脳皮質,小脳,脳梁,ならびに海馬のシアル酸濃度やガングリオシドシアル酸濃度を測定し,SLを含まない調合乳を摂取した群と比較したところ,小脳のシアル酸濃度とガングリオシドシアル酸濃度は3′-SL添加によって濃度依存的に上昇し,脳梁におけるシアル酸濃度は2 g/Lの3′-SL摂取によって増加していた39).
Obelitz-Ryonらは,予定出産までの妊娠90%の段階で帝王切開によって出生させた未熟仔ブタへのSLの投与が,認識能力と神経発達に対する改善効果を持つかどうか検討した40).未熟出生ブタへの300 mg/L SLを含むウシ乳ホエー添加食摂取群(PRE-SAL),6 g/Lのラクトース添加のウシ生乳コントロール食摂取群(PRE-CON),ならびにコントロール食摂取の100%妊娠・帝王切開出生群(TERM-CON)に分け,摂取12日から6日間T迷路を使用した学習能力観察と,19日後の脳組織の回収を行った.PRE-SAL群はTERM-CON群に近いレベルまで,PRE-CON群よりも高い学習基準に到達した.PRE-SAL群とPRE-CON群では脳重量や海馬のシアル酸レベル差はなかったが,トータルシアル酸に対するガングリオシド結合シアル酸の割合は,PRE-SAL群に高い傾向が観察された.
一方,シアリルオリゴ糖ではなく,代表的なHMOsである2′-FLの摂取が学習能力を向上させたことを示唆する研究もある.外科処置により海馬背面CA1領域に電極を埋め込んだオスの成獣マウスおよびラットに,0.321%または0.625%の2′-FLを添加した食餌を12週間または5週間摂取させると同時に,興奮性シナプス後場電位を記録したところ,コントロール群と比べ2′-FL投与群で高いシナプス結合強度の持続的増加(長期増強)が観察された.これは,2′-FL摂取により動物の記憶や空間認識能が活性化されたことを示唆している41).またマウスを,三角学習チャンバーを装着したインテリケージに入れ5週間飼育して餌に対する探索行動を観察したところ,2′-FL摂取群はコントロール群よりも高い学習スコアを示した.一方,迷走神経を切断したラットを使用して餌探索学習行動を観察したところ,2′-FLを摂取しても学習能の向上が示されなかったので,そのような効果は腸-脳相関によるものと考えられた42).
5)栄養障害改善
乳幼児の栄養障害は世界中で310万人も発生し,2011年には5歳以下の死亡原因の45%を占めている.栄養障害は腸内微生物叢を撹乱する原因にもなることが示唆されているが,ミルクオリゴ糖などのプレバイオティクス摂取によって腸内微生物叢を改善することができたなら,栄養障害による死亡率の低下につながることが期待される.Charnonneauらは,栄養障害を来したマラウイの乳児の便から分離した腸内細菌を無菌マウスと無菌仔ブタに移植して2群に分け,一方にはチーズホエーの限外ろ過液から調製したシアリルウシミルクオリゴ糖(SBMOs)を添加した一般的なマラウイ食を,もう一方にはコントロール食として何も添加しないマラウイ食を摂取させてそれぞれの成長を比較した43).両群において体重と大腿骨密度の変化を5週間以上モニターしたところ,コントロール群に比べSBMOs投与群で両方の有意な増加が認められた.また,両群間で盲腸内細菌叢にも違いが見いだされたことから,その効果は腸内細菌群の改善によるものと考えられた.6日間の投与実験により,無菌仔ブタを用いた実験でもSBMOs投与による体重増加が観察された.
SBMOs摂取による成長改善効果のメカニズムも研究されている.Cowardinらは,栄養障害を持つバングラデシュの乳児コホートの糞便から分離した細菌を移植したノトバイオティックマウス(無菌マウスに特定の腸内細菌を移植したマウス)を使用して,SBMOs摂取効果の再現性を確認するとともに血液サンプルを分析した結果,破骨細胞によって骨の分解過程で遊離されるバイオマーカー,タイプ1コラーゲンのC末端テロペプチド(CTX-1)発現量の低下を観察した44).またSBMOs処理マウスにおいてアルカリホスファターゼによる染色後の脛骨断片に,破骨細胞数の低下が観察された.一方,SBMOs摂取によって骨芽細胞への影響は観察されなかった.破骨細胞の分化と機能を調節するタンパク質RANKLとそのメディエーターであるオステオポンチンの血清レベルはSBMOs摂取マウスで有意に減少したが,RANKLの活性に対抗するオステオプロテグリンの血清レベルは高かった.この結果は,SBMOs摂取によって破骨細胞の増殖が抑制されたが,骨芽細胞には影響しなかったことを示している.
6. HMOsの工業的な調製と育児用調整乳への利用
このように母乳中には高濃度で多種類のHMOsが含まれる一方で,牛乳では分娩後まもない初乳には約1 g/Lのミルクオリゴ糖が含まれるものの常乳には痕跡量しか含まれない.それに加えて,2′-FL, 3-FL, LNT, LNFP-1, LNDFH-1などの代表的なHMOsは牛乳には含まれないか,含まれていても痕跡量である.乳児用の育児用調合乳は牛乳を原料として調製するので,HMOsにこのような重要な生理活性のあることを考慮すれば,HMOsや関連オリゴ糖がほとんど含まれないことはその品質にとって大きな不利益であった.HMOsのプレバイオティクス機能を代用する目的で,ガラクトオリゴ糖,ラクチュロース,フルクトオリゴ糖などが添加されているが,それだけではHMOsの多くの機能を代用することはできない.近年2′-FL, LNnT, LNT, 3′-SL, 6′-SLなどの少数のオリゴ糖については,Glycom A/S(デンマーク),Elicityl(フランス),Jennewein Biotechnologies(ドイツ),Glycosynth LLC(アメリカ),Friesland Campina(オランダ)などにおいて産業的なスケールで調製されるようになり,安全性確認試験も実施され育児用調合乳への利用が期待されている45–50).乳児を対象として,2′-FLや2′-FLプラスLNnTを添加した育児用調合乳による介入試験もそれぞれアメリカとイタリア,ベルギーで実施され,それらを摂取した乳児の成長は母乳栄養児と比較しても差がないことと,2′-FLやLNnT無添加の調合乳を摂取した人工栄養児と比べて湿疹や感染エピソードの低下,便性の改善などが報告された51–53).しかし大量に調製できるオリゴ糖は250種類のHMOsの中で限られており,タイプI型オリゴ糖やH抗原(Fucα1-2Gal結合)を含むオリゴ糖,分岐型オリゴ糖などを大量調製できる技術開発が求められている.
HMOsが母乳中のビフィズス因子であることは従来から知られていたものの,ビフィドバクテリウムによるHMOsの代謝経路は未解明であった.しかしながら21世紀に入ってからその研究は一気に進み,おおよそ解明されたとみなしてよい.本稿はそれらの研究史を紹介することを主目的としている.一方で,母乳中のHMOsプロファイルが実際に母乳栄養児の腸管細菌叢の形成,特に個人間差とどのように関わるか,今後パイロット研究の実施例を多くすることで少しずつ解明されていくであろう.プレバイオティクス以外のHMOsの機能研究は,一部のHMOsが大量調製できるようになったため,in vivo研究が実施されるようになり,加速度的に進められている.腸管バリア機能,壊死性腸炎予防,腸内細菌コロニー化促進など,HMOsの異なる機能が,HMOs曝露による上皮細胞上の細胞表面を被覆する糖タンパク質や多糖類の層であるグリコカリックスの修飾という共通のメカニズムによって果たされる可能性も示唆される.Kongらは,3-FLで1日または5日曝露したCaco-2細胞においてグリコカリックスのアルブミンやヘパラン硫酸,ヒアルロン酸に覆われる層の容積が拡大することを発見した54).
一方,HMOsは妊婦の血清や出生時に回収した臍帯血からも検出され,胎児がすでにHMOsに曝露されていることが明らかになったことから55),HMOsの新たな働きが解明されるかもしれない.この分野は,世界的にも報告されている論文数が糖質科学のトップ2%以内にあげられるほど活発である.育児用調合乳への添加以外にも,解明された機能に基づいて新しい機能性食品素材や医薬品素材の開発が進められるであろう.一方で上記以外のHMOsの大量調製技術の開発や効率的な調製方法の開発も重要な課題である.HMOsの機能研究や応用研究は海外を中心に進んでいるので,国内でも精力的に取り組んでほしい課題である.
引用文献References
1) Urashima, T., Hirabayashi, J., Sato, S., & Kobata, A. (2018) Human Milk Oligosaccharides as Essential Tools for Basic and Application Studies on Galectins. Trends Glycosci. Glycotechnol., 30, SE51–SE65.
2) Ashline, D.J., Yu, Y., Lasanajak, Y., Song, X., Hu, L., Ramani, S., Prasad, V., Estes, M.K., Cummings, R.D., Smith, D.F., et al. (2014) Structural characterization by multistage mass spectrometry (MSn) of human milk glycans recognized by human rotaviruses. Mol. Cell. Proteomics, 13, 2961–2974.
3) Thurl, S., Munzert, M., Boehm, G., & Stahl, B. (2017) Systematic review of the concentrations of oligosaccharides in human milk. Nutr. Rev., 75, 920–933.
4) Thurl, S., Munzert, M., Henker, J., Boehm, G., Muller-Werner, B., Jelinek, J., & Stahl, B. (2010) Variation of human milk oligosaccharides in relation to milk groups and lactational periods. Br. J. Nutr., 104, 1261–1271.
5) Rodriguez, J.M. (2014) The origin of human milk bacteria: is there a bacterial entero-mammary pathway during late pregnancy and lactation? Adv. Nutr., 5, 779–784.
6) Ward, R.E., Ninonuevo, M., Mills, D.A., Lebrilla, C.B., & German, J.B. (2006) In vitro fermentation of breast milk oligosaccharides by Bifidobacterium infantis and Lactobacillus gasseri. Appl. Environ. Microbiol., 72, 4497–4499.
7) LoCascio, R., Ninonuevo, M.R., Freeman, S.L., Sela, D.A., Grimm, R., Lebrilla, C.B., Mills, D.A., & German, J.B. (2007) Glycoprofiling of Bifidobacterial Consumption of Human Milk Oligosaccharides Demonstrates Strain Specific, Preferential Consumption of Small Chain Glycans Secreted in Early Human Lactation. J. Agric. Food Chem., 55, 8014–8019.
8) Marcobal, A., Barboza, M., Froehlich, J.W., Block, D.E., German, J.B., Lebrilla, C.B., & Mills, D.A. (2010) Consumption of human milk oligosaccharides by gut-related microbes. J. Agric. Food Chem., 58, 5334–5340.
9) Asakuma, S., Hatakeyama, E., Urashima, T., Yoshida, E., Katayama, T., Yamamoto, K., Kumagai, H., Ashida, H., Hirose, J., & Kitaoka, M. (2011) Physiology of consumption of human milk oligosaccharides by infant gut-associated bifidobacteria. J. Biol. Chem., 286, 34583–34592.
10) Sela, D.A., Chapman, J., Adeuya, A., Kim, J.H., Chen, F., Whitehead, T.R., Lapidus, A., Rokhsar, D.S., Lebrilla, C.B., German, J.B., et al. (2008) The genome sequence of Bifidobacterium longum subsp. infantis reveals adaptations for milk utilization within the infant microbiome. Proc. Natl. Acad. Sci. USA, 195, 18964–18969.
11) Garrido, D., Barille, D., & Mills, D.A. (2012) A molecular basis for bifidobacterial enrichment in the infant gastrointestinal tract. Adv. Nutr., 3, 415S–421S.
12) Yoshida, E., Sakurama, H., Kiyohara, M., Nakajima, M., Kitaoka, M., Ashida, H., Hirose, J., Katayama, T., Yamamoto, K., & Kumagai, H. (2012) Bifidobacterium longum subsp. infantis uses two different β-galactosidases for selectively degrading type-1 and type-2 human milk oligosaccharides. Glycobiology, 22, 361–368.
13) Viborg, A.H., Katayama, T., Hachem, M.A., Andersen, M.C.F., Nishimoto, M., Clausen, M.H., Urashima, T., Svensson, B., & Kitaoka, M. (2014) Distinct substrate specificities of three glycoside hydrolase family 42 β-galactosidases from Bifidobacterium longum subsp. infantis ATCC 15697. Glycobiology, 24, 208–216.
14) Kitaoka, M. (2012) Bifidobacterial enzymes involved in the metabolism of human milk oligosaccharides. Adv. Nutr., 3, 422S–429S.
15) Ruiz-Moyano, S., Totten, S.M., Garrido, D.A., Smilowitz, J.T., German, J.B., Lebrilla, C.B., & Mills, D.A. (2013) Variation in consumption of human milk oligosaccharides by infant gut-associated strains of Bifidobacterium breve. Appl. Environ. Microbiol., 79, 6040–6049.
16) Sakurama, H., Kiyohara, M., Wada, J., Honda, Y., Yamaguchi, M., Fukiya, S., Yokota, A., Ashida, H., Kumagai, H., Kitaoka, M., et al. (2013) Lacto-N-biosidase encoded by a novel gene of Bifidobacterium longum subspecies longum shows unique substrate specificity and requires a designated chaperone for its active expression. J. Biol. Chem., 288, 25194–25206.
17) Matsuki, T., Yahagi, K., Mori, H., Matsumoto, H., Hara, T., Tajima, S., Ogawa, E., Kodama, H., Yamamoto, K., Yamada, T., et al. (2016) A key genetic factor for fucosyllactose utilization affects infant gut microbiota development. Nat. Commun., 7, 11939.
18) Sakanaka, M., Hansen, M.E., Gotoh, A., Katoh, T., Yoshida, K., Odamaki, T., Yachi, H., Sugiyama, Y., Kurihara, S., Hirose, J., et al. (2019) Evolutionary adaptation in fucosyllactose uptake systems supports bifidobacteria-infant symbiosis. Sci. Adv., 5, eaaw7696.
19) Zabel, B., Clement Yde, C., Roos, P., Marcussen, J., Jensen, H.M., Salli, K., Hirvonen, J., Iuwehand, A.C., & Morovic, W. (2019) Novel Genes and Metabolite Trends in Bifidobacterium longum subsp. infantis Bi-26 Metabolism of Human Milk Oligosaccharide 2′-fucosyllactose. Sci. Rep., 9, 7983.
20) Salli, K., Anglenius, H., Hirvonen, J., Hibberd, A.A., Abonen, I., Saarinen, M., Tiihonen, K., Maukonen, J., & Ouwehand, A.C. (2019) The effect of 2′-fucosyllactose on simulated infant gut microbiome and metabolites; a pilot study in comparison to GOS and lactose. Sci. Rep., 9, 13232.
21) James, K., Bottacini, F., Contreras, J.I.S., Vigoureux, M., Egan, M., Mothermay, M.O., Holmes, E., & van Sinrderen, D. (2019) Metabolism of the predominant human milk oligosaccharide fucosyllactose by an infant gut commensal. Sci. Rep., 9, 15427.
22) Gotoh, A., Katoh, T., Sakanaka, M., Liing, Y., Yamada, C., Asakuma, S., Urashima, T., Tomabechi, Y., Katayama-Ikegami, A., Kurihara, S., et al. (2018) Sharing of human milk oligosaccharides degradants within bifidobacterial communities in faecal cultures supplemented with Bifidobacterium bifidum. Sci. Rep., 8, 13958–13971.
23) Lawson, M.A.E., O’Neill, I.J.O., Kujawska, M., Javvadi, S.G., Wijeyesekera, A., Fiegg, Z., Chalklen, L., & Hall, L.J. (2019). ISME J.
24) Smith-Brown, P., Morrison, M., Krause, L., & Davies, P.S. (2016) Mothers Secretor Status Affects Development of Childrens Microbiota Composition and Function: A Pilot Study. PLoS One, 11, e0161211.
25) Lewis, Z.T., Totten, S.M., Smilowitz, J.T., Popovic, M., Parker, E., Lemay, D.G., van Tassell, M.L., Miller, M.J., Jin, Y.S., German, J.B., et al. (2015) Maternal fucosyltransferase 2 status affects the gut bifidobacterial communities of breastfed infants. Microbiome, 3, 13–33.
26) Bai, Y., Tao, J., Zhou, J., Fan, Q., Liu, M., Hu, Y., Xu, Y., Zhang, L., Yuan, J., Li, W., et al. (2019) Fucosylated Human Milk Oligosaccharides and N-Glycans in the Milk of Chinese Mothers Regulate the Gut Microbiome of Their Breast-Fed Infants during Different Lactation Stages. mSystems, 3, e00206–e00218.
27) Borewicz, K., Gu, F., Saccenti, E., Arts, I.C.W., Penders, J., Thijs, C., van Leeuwen, S.S., Lindner, C., Nauta, A., van Leusen, E., et al. (2019) Correlating Infant Fecal Microbiota Composition and Human Milk Oligosaccharide Consumption by Microbiota of 1-Month-Old Breastfed Infants. Mol. Nutr. Food Res., e1801214.
28) Hester, S.N., Chen, X., Li, M., Monaco, M.H., Comstock, S.S., Kuhlenschmidt, T.B., Kuhlenschimidt, M.S., & Donovan, S.M. (2013) Human milk oligosaccharides inhibit rotavirus infectivity in vitro and in acutely infected piglets. Br. J. Nutr., 110, 1233–1242.
29) Xiao, L., Leusink-Muis, T., Nettelarij, N., vanArk, I., Blijenberg, B., Hesen, N.A., Stahl, B., Overbeek, S.A., Garssen, J., Folherts, G., et al. (2018) Human Milk Oligosaccharide 2′-Fucosyllactose Improves Innate and Adaptive Immunity in an Influenza-Specific Murine Vaccination Model. Front. Immunol., 9, 452.
30) Lin, A.E., Autran, C.A., Szyszka, A., Escajadillo, T., Huang, M., Godula, K., Prudden, A.R., Boons, G.J., Lewis, A.L., Donovan, K.S., et al. (2017) Human milk oligosaccharides inhibit growth of group B Streptococcus. J. Biol. Chem., 292, 11243–11249.
31) Craft, K.M., Gaddy, J.A., & Townsend, S.D. (2018) Human Milk Oligosaccharides (HMOs) Sensitize Group B Streptococcus to Clindamycin, Erythromycin, Gentamicin, and Minocycline on a Strain Specific Basis. ACS Chem. Biol., 13, 2020–2026.
32) Goehring, K.C., Kennedy, A.D., Prieto, P.A., & Buck, R.H. (2014) Direct evidence for the presence of human milk oligosaccharides in the circulation of breastfed infants. PLoS One, 9, e101692.
33) Newburg, D.S., Tanritanir, A.C., & Chakrabarti, S. (2016) Lactodifucotetraose, a human milk oligosaccharide, attenuates platelet function and inflammatory cytokine release. J. Thromb. Thrombolysis, 42, 46–55.
34) Castillo-Courtade, L., Han, S., Lee, S., Mian, F.M., Buck, R., & Forsythe, P. (2015). Allegy, 70, 1091–1102.
35) Jantsher-Krenn, E., Zherebtsov, M., Nissan, C., Goth, K., Guner, Y.S., Naidu, N., Choudbury, B., Grishin, A.V., Fird, H.R., & Bode, L. (2012). Gut, 61, 1417–1425.
36) Wu, R.Y., Li, B., Koike, Y., Maatnanen, P., Miyake, H., Cadete, M., Johnson-Henry, K.C., Botts, S.R., Lee, C., Abrahamson, T.R., et al. (2019) Human Milk Oligosaccharides Increase Mucin Expression in Experimental Necrotizing Enterocolitis. Mol. Nutr. Food Res., 63, e1800658.
37) Wang, C., Zhang, M., Guo, H., Yan, J., Liu, F., Chen, J., Li, Y., & Ren, F. (2019) Mol. Nut. Food Res., e1900262.
38) Werts, A.D., Fulton, W.B., Ladd, M.R., Saad-Eldin, A., Chen, Y.X., Kovler, M.L., Jia, H., Banfield, E.C., Buck, R., Goerhing, K., et al. (2019). Cell. Mol. Gastroenterol. Hepatol.
39) Jacobi, S.K., Yatsunenko, T., Li, D., Dasgupta, S., Yu, R.K., Berg, B.M., Chichlowski, M., & Odle, J. (2016) Dietary Isomers of Sialyllactose Increase Ganglioside Sialic Acid Concentrations in the Corpus Callosum and Cerebellum and Modulate the Colonic Microbiota of Formula-Fed Piglets. J. Nutr., 146, 200–208.
40) Obelizt-Ryom, K., Bering, S.B., Overgaard, S.H., Eskildsen, S.F., Ringgaard, S., Olesen, J.L., Skovgaard, K., Pankratova, S., Wang, B., Brunse, A., et al. (2019). Nutrients, 11, 1335.
41) Vazquez, E., Barranco, A., Ramirez, M., Gruart, A., Delgado-Gareia, J.M., Martinez-Lara, E., Blamco, S., Martin, M.J., Castanys, E., Buck, R., et al. (2015) Effects of a human milk oligosaccharide, 2′-fucosyllactose, on hippocampal long-term potentiation and learning capabilities in rodents. J. Nutr. Biochem., 26, 455–465.
42) Vazquez, E., Barranco, A., Ramirez, M., Gruart, A., Delgado-Garcia, J.M., Jimenez, M.L., Buck, R., & Rueda, R. (2016) Dietary 2′-Fucosyllactose Enhances Operant Conditioning and Long-Term Potentiation via Gut-Brain Communication through the Vagus Nerve in Rodents. PLoS One, 11, e0166070.
43) Charnonneau, M.R., O’Donnell, D., Blanton, L.V., Totten, S.M., Davis, J.C., Barratta, M.J., Cheng, J., Guruge, J., Talcott, M., Bain, J.R., et al. (2016). Cell, 164, 839–871.
44) Cowardin, C.A., Ahern, P.P., Kung, V.L., Hibbers, M.C., Cheng, J., Guruge, J.L., Sundaresan, V., Head, R.D., Barile, D., Mills, D.A., et al. (2019) Mechanisms by which sialylated milk oligosaccharides impact bone biology in a gnotobiotic mouse model of infant undernutrition. Proc. Natl. Acad. Sci. USA, 116, 11988–11996.
45) Coulet, M., Phothirath, P., Constable, A., Mardsen, E., & Schilter, B. (2013) Pre-clinical safety assessment of the synthetic human milk, nature-identical, oligosaccharide Lacto-N-neotetraose (LNnT). Food Chem. Toxicol., 62, 528–537.
46) Coulet, M., Phothirath, P., Allais, L., & Schilter, B. (2014) Pre-clinical safety evaluation of the synthetic human milk, nature-identical, oligosaccharide 2′-O-Fucosyllactose (2'FL). Regul. Toxicol. Pharmacol., 68, 59–69.
47) Phipps, K.R., Baldwin, N., Lynch, B., Stannard, D.R., Soltesova, A., Gilby, B., Miks, M.H., & Rohig, C.H. (2018) Preclinical safety evaluation of the human-identical milk oligosaccharide lacto-N-tetraose. Regul. Toxicol. Pharmacol., 99, 260–273.
48) Phipps, K.R., Baldwin, N.J., Lynch, B., Stannard, D.R., Soltesova, A., Gilby, B., Miks, M.H., & Rohrig, C.H. (2019) Toxicological safety assessment of the human-identical milk oligosaccharide 3′-sialyllactose sodium salt. J. Appl. Toxicol., 39, 1378–1393.
49) Phipps, K.R., Baldwin, N.J., Lynch, B., Stannard, D.R., Soltesova, A., Gilby, B., Miks, M.H., & Rohrig, C.H. (2019) Toxicological safety evaluation of the human-identical milk oligosaccharide 6′-sialyllactose sodium salt. J. Appl. Toxicol., 39, 1444–1461.
50) Monaco, M.H., Gurung, R.B., & Donovan, S.M. (2019) Safety evaluation of 3′-siallylactose sodium salt supplementation on growth and clinical parameters in neonatal piglets. Regul. Toxicol. Pharmacol., 101, 57–64.
51) Marriage, B.J., Buck, R.H., Gohring, K.C., Oliver, J.S., & Williams, J.A. (2015) Infants Fed a Lower Calorie Formula With 2′FL Show Growth and 2′FL Uptake Like Breast-Fed Infants. J. Pediatr. Gastroenterol. Nutr., 61, 649–658.
52) Goehring, K.C., Marriage, B.J., Oliver, J.S., Wilder, J.A., Barrett, E.G., & Buck, R.H. (2016) Similar to Those Who Are Breastfed, Infants Fed a Formula Containing 2′-Fucosyllactose Have Lower Inflammatory Cytokines in a Randomized Controlled Trial. J. Nutr., 146, 2559–2566.
53) Puccio, G., Alliet, P., Cajozzo, C., Janssens, E., Corsello, G., Sprenger, N., Wernimont, S., Egli, D., Gosoniu, L., & Steenhout, P. (2017) Effects of Infant Formula With Human Milk Oligosaccharides on Growth and Morbidity: A Randomized Multicenter Trial. J. Pediatr. Gastroenterol. Nutr., 64, 624–631.
54) Kong, C., Elderman, M., Cheng, L., de Haan, B.J., Nauta, A., & de Vos, P. (2019) Modulation of Intestinal Epithelial Glycocalyx Development by Human Milk Oligosaccharides and Non-Digestible Carbohydrates. Mol. Nutr. Food Res., 63, e1900303.
55) Hirschmugl, B., Brandl, W., Csapo, B., van Poppel, M., Kofeler, H., Desoye, G., Wadsack, C., & Jantsher-Krenn, E. (2019) Evidence of Human Milk Oligosaccharides in Cord Blood and Maternal-to-Fetal Transport across the Placenta. Nutrients, 11, 2640.
著者紹介Author Profile
 浦島 匡(うらしま ただす)
浦島 匡(うらしま ただす)帯広畜産大学教授.農学博士.
略歴1957年広島県に生れる.80年東京農工大学農学部卒業.86年東北大学大学院農学研究科博士後期課程修了.同年4月帯広畜産大学助手.94年4月同助教授.2003年8月同教授,以後現職.
研究テーマと抱負ミルクオリゴ糖の比較生化学と進化に関する研究.哺乳類の定義となる泌乳が共通祖先から現在の哺乳類に至るまで,どのように段階を追って獲得されたか,とくにラクトースとミルクオリゴ糖の進化と多様性を絡めて考察する.
趣味週末読書.食べ歩き.各地の探索.
 片山 高嶺(かたやま たかね)
片山 高嶺(かたやま たかね)京都大学大学院生命科学研究科教授.博士(農学).
略歴1994年京都大学農学部卒業.96年同大学院農学研究科修士課程修了.99年同博士課程修了.同年同リサーチアソシエイト.2002年京都大学大学院生命科学研究科助手.05年石川県立大学講師.08年同准教授.13年同教授.15年より現職.
研究テーマと抱負腸内細菌と宿主の共生の分子基盤を,宿主由来の糖質を介して理解すること.
ウェブサイトhttp://www.bunshioutou.lif.kyoto-u.ac.jp/katayama/Home.html
趣味ゴルフのはず.
 福田 健二(ふくだ けんじ)
福田 健二(ふくだ けんじ)帯広畜産大学グローバルアグロメディシン研究センター准教授.博士(農学).
略歴1997年北海道大学農学部卒業.99年同大学院農学研究科修士課程修了.2002年同博士課程修了.同年デンマーク国カールスバーグ研究所生化学部門博士研究員.05年帯広畜産大学大学院畜産衛生学専攻助教.10年帯広畜産大学大学院畜産衛生学研究部門准教授.17年より現職.
研究テーマと抱負乳および乳酸菌に由来する機能性成分の探索と解析.
ウェブサイトhttps://www.obihiro.ac.jp/faculty-r/kenji-fukuda
趣味ヤマベ釣り.