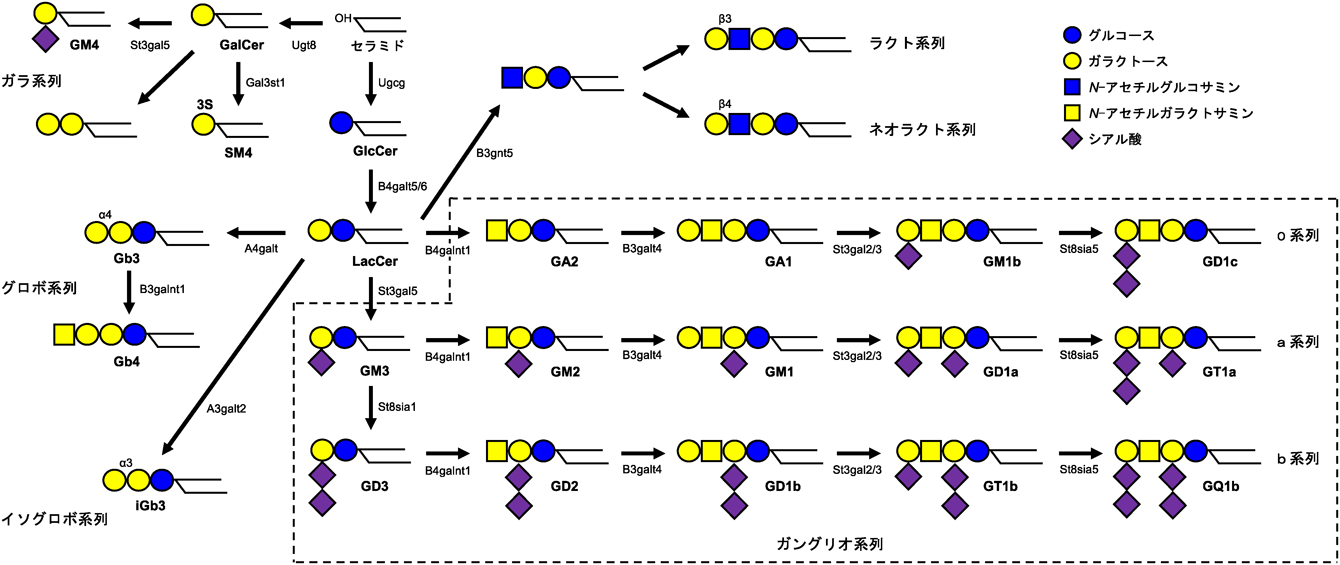
シアル酸を含有するスフィンゴ糖脂質をガングリオシドと総称する.ガングリオシドファミリーの生合成は,GM3合成酵素(GM3S)によってラクトシルセラミド(LacCer)にシアル酸が転移されGM3が生成することから始まる(図1).そもそもGM3は,糖脂質研究の草分けである山川民夫博士がウマ赤血球からヘマトシドとして同定されたものである1).GM3は,ヒトおよびマウスの脂肪組織や筋肉,ヒト肝臓および血清中など,末梢組織で主要に発現するガングリオシドである.1998年,井ノ口はこのGM3S遺伝子クローニングに参画して以来今日に至るまで,GM3および関連糖脂質の病態生理学的意義についての研究を続けている2, 3).2015年の本誌には,「ガングリオシドファミリーの分子種選択的発現と生理活性脂質としての意義」として我々の30年間の研究の軌跡についてまとめている4).そこでは,1)インスリン抵抗性発症におけるガングリオシドの関与とマイクロドメイン病の提唱,2)T細胞レパトア選択におけるガングリオシドの選択的発現と分子種特異的機構,および3)GM3合成酵素欠損と聴覚機能障害について述べた.
本稿では,1)GM3およびGM2合成酵素の細胞内輸送シグナル,2)摂食制御におけるガングリオシドの役割,3)コレステロール吸収におけるガングリオシドの役割,4)自然免疫におけるGM3およびグロボ系糖脂質分子種の役割,について最近の研究を紹介する.
[山川先生は,2018年10月7日に96歳で永眠されました.ここに謹んで哀悼の意を表するとともに,GM3の生みの親である先生へのプログレスレポートとして本稿を捧げます.]
スフィンゴ糖脂質は脂質部分としてのスフィンゴイド塩基と脂肪酸が酸アミド結合したセラミドと糖鎖とから構成されるが,その構造解析は糖鎖構造の均一性に注目して行われてきた.精製されたスフィンゴ糖脂質として報告された構造は,糖鎖は単一であるものの,セラミド部分は混合物で,スフィンゴイド塩基と脂肪酸の組成が記載される,というものであった5, 6).糖鎖の構造多様性,組織特異的発現,がんや先天性代謝異常症をはじめとする疾患での変化が注目されてきた一方で,脂質部分のセラミド構造には,糖鎖に匹敵する関心が払われてこなかった.脳,神経組織に存在し,シアル酸を含むガングリオシドと総称されるスフィンゴ糖脂質は,他の組織に例をみないほどの含量の多さと構造の特徴から,神経機能に関する多くの研究が現在なお継続されている.一方で,セラミド構造に関する状況はマイクロドメインあるいはラフトの概念が提出されたことで一転し,注目を集めることになった7).
スフィンゴ糖脂質の糖鎖構造に関して,これまでに報告された糖鎖が何種類あるか,厳密に数えないと確かな数字をあげることはできないが,数百種になると考えてよいと思われる5).一方で単一の糖鎖構造に対して結合しているセラミド構造は何種類存在するのか.この問いはスフィンゴイド塩基の数,脂肪酸の数,その組合わせによるセラミド構造が何種類存在するか,に答えることを意味する.スフィンゴイド塩基は,炭素鎖18,二重結合1個のd18 : 1 sphingenineを基本に,飽和型のd18 : 0 sphinganine,水酸基がC4位に1個追加されたt18 : 0 4-hydroxysphinganineの3種類が主要成分として存在する.炭素鎖16, 20のものも存在し,これらをまとめると9種類となる.脂肪酸は,16 : 0から24 : 0の飽和偶数鎖5種,どういう分子機構で生じるか不明であるが23 : 0の奇数鎖,24 : 1不飽和偶数鎖,以上のすべての脂肪酸鎖に対してα位(C2位)が水酸化された脂肪酸,総計14種が通常検出される脂質部分の構成要素である.これらからセラミド構造の種類は9×14=126となる.スフィンゴ糖脂質の可能な分子数は126×数百=12,600~37,800となる.
セラミド構造に関心が向かわなかったのは,スフィンゴ糖脂質分子そのものを検出する適切な分析法がなかったことによる.この状況は,matrix-assisted laser desorption ionization(MALDI)とelectrospray ionization(ESI)の開発によって,質量分析法(mass spectrometry:MS)に飛躍がもたらされ,一転する.タンパク質やペプチドのイオン化が可能になり,分子イオンを捉え,原子で衝突誘起解離(collision-induced dissociation:CID)を起こし,開裂イオンをMS/MS解析することで,分子の構成要素を解析することが可能になった.アミノ酸配列の解析がプロテオミクス(proteomics)の発展をもたらしたと同様に,この手法でグライコリピドミクス(glycolipidomics)が可能になった.MALDI-MSは感度,操作性に優れているが,イオン化で一部の分子に開裂が起きる.特にシアル酸はイオン化で脱離することが多い.一方でESIはよりソフトなイオン化が可能で,ガングリオシドがシアル酸の開裂を伴わないでイオン化される.液体クロマトグラフィー(LC)と直結できることも利点の一つである.
スフィンゴ糖脂質のLC-MSによる構造解析は,MS2による糖鎖配列解析とセラミドイオンの検出からなる糖鎖構造の確認とMS3によるセラミド構造の確認からなる.MS3によるセラミド構造確認に有効な情報を得るには,前駆体イオンとするセラミドイオンの十分な強度が必要になる.この解析で構造が確認できれば,実験群と対照群での変化を追跡することが必要になる.量的な変化を微量で検出するためにMS2の情報に基づく多重反応モニタリング(multiple reaction monitoring:MRM)が利用される.MS1で特定のイオンを選択し,CIDで開裂イオンを生成し,MS2で生成イオンを検出する手法である.前駆体イオンと生成イオンを特定して,検出する.構造解析とMRMによる量的変化の解析は異なる質量分析計を使用することになり,後者のMRM解析は前者の構造解析よりも数十倍感度が高い.
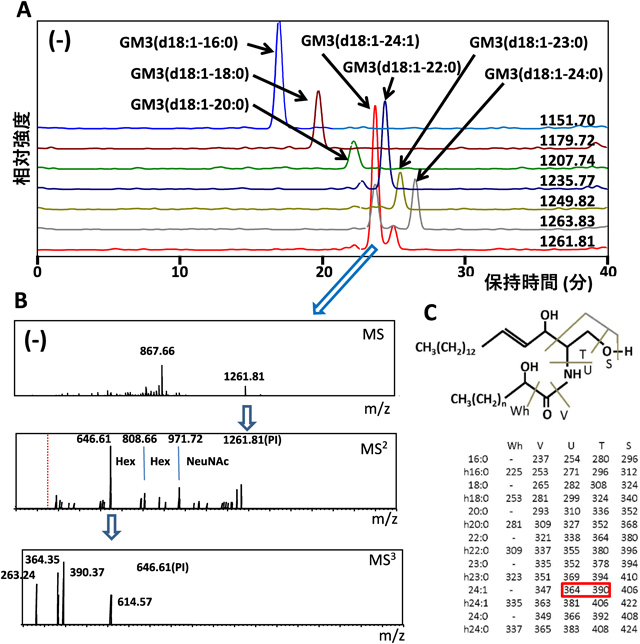
実際のルーチン解析の結果をヒト血清のGM3について示す.100 µLの血清から総脂質を得,弱アルカリ処理でエステル結合を持つ主要成分のリン脂質を分解し,中和,脱塩して,LC-MS分析用のサンプルとする.このサンプルにはセラミド,中性スフィンゴ糖脂質,GM3,微量成分としてのその他のガングリオシド,多量のスフィンゴミエリンが存在している.LCはC30カラム(1×50 mm),流量(50 µL/min),溶出溶媒(0.1%の酢酸,アンモニア水を含む,水/メタノール/イソプロパノールの混合溶媒で,疎水性を上昇させる)の条件で行い,溶出液を2種類の質量分析計(島津製作所LC-IT-TOFとLCMS-8060)を用いて負イオンモードで分析した8).図2にGM3の構造をLC-IT-TOF(LC-ion trap-time of flight)で確認した結果を示す.図2Aのマスクロマトグラムは主要な分子のみを示している.m/z 1261.81のピークは図2Bに示すようにMS2で糖鎖の配列とセラミドの分子量決定,セラミドイオンを前駆体とするMS3でセラミド構造の確認が行われる.図2Cにセラミド構造決定に有用なフラグメントイオンをリストした.これらのGM3分子の構造確認に基づいて,GM3分子の変動を解析することが求められる.この目的を達成するために,MRMによる解析が行われる.MRM解析の利点は検出のダイナミックレンジが広いこと,特定のイオンのみを検出することから高い検出感度が得られることである.図3に解析例を示す.この解析ではGM3の分子イオンを前駆体イオンとして特定し,それに由来するN-アセチルノイラミン酸(Neu5Ac)フラグメントイオン(m/z 290.1)を検出イオンとして検出する.ピーク面積をISD(internal standard)に対して求め,GM3分子のそれぞれの含量を求める.ISDとして13C標識パルミチン酸を持つGM3(d18 : 1–13C16 : 0)を使用した.
以上がグライコリピドミクスの一例であるが,上記の調製によるサンプル中には,他のスフィンゴ糖脂質も含まれ,それらの解析も同様に可能である.ガングリオシドは負イオンモードでの解析が適切である.中性糖脂質は陽イオンモードで,スフィンゴシン由来のフラグメントイオンを検出する方が,感度がよい.何を解析対象にするかで,最適な方法をとる必要がある.多くのスフィンゴ糖脂質について,データーベースの整備が望まれる.これまでに著者らが報告した中性スフィンゴ糖脂質9–11),ガングリオシド12–16)の解析文献をあげる.
3. GM3およびGM2合成酵素の細胞内輸送シグナル
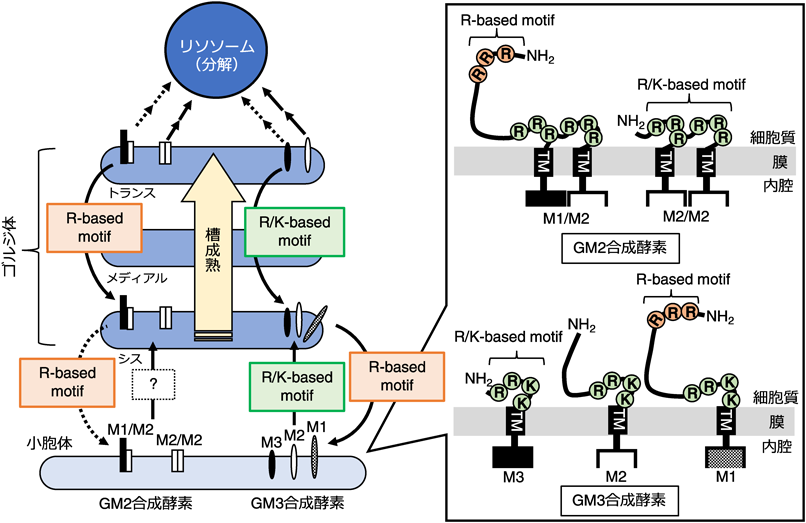
ガングリオシド生合成はゴルジ体の内腔側で行われる.ガングリオシドの生合成量を一定に保つために,基質となる糖供与体(CMP-シアル酸やUDP-ガラクトースなど)と糖受容体(糖脂質)のゴルジ体への輸送は重要だが,その反応を触媒する糖転移酵素の細胞内輸送・維持メカニズムも同様に重要である.多くの糖転移酵素はII型の膜タンパク質であり,小胞体で翻訳され,COPII小胞でゴルジ体へ運ばれる.ゴルジ体では,シス,メディアル,トランスとダイナミックに層成熟を繰り返す層板の中で各糖転移酵素がいるべき場所にとどまる仕組みがあると考えられる17, 18).
GM3合成酵素にはN末端側の長さが異なる3種類のアイソフォーム(M1型,M2型,M3型)が発現している(図4)19).GM3合成酵素の小胞体からゴルジ体への輸送は,膜貫通ドメイン直上のR/K-based motifによって担われており,ここに変異が導入されると小胞体からの搬出効率が低下する20).最初に糖転移酵素で同定された小胞体搬出シグナルは[R/K](X)[R/K]配列であり,COPIIコートタンパク質であるSar1と相互作用することが示された21).しかし,少なくとも安定に発現させた全長GM3合成酵素においては,[R/K](X)[R/K]配列だけでは小胞体搬出に十分ではなく,その近傍のリシン残基も必要であった.この結果から,我々は小胞体搬出シグナルとして,もう少し広範囲に定義したR/K-based motifの使用を提案している20).
GM3合成酵素の中でN末端が長いM1型には,ゴルジ体から小胞体への逆行輸送を担うR-based motifがある.R-based motifはCOPIコートタンパク質であるβ-COPとδ-COPが作る酸性ポケットに入り込む22).おそらくこのCOPIコートタンパク質複合体の構造的制限により,R-based motifは膜から離れた位置でしか機能できず,膜に近接するR/K-based motifとは明確に区別される.M1型はゴルジ体に運ばれた後,R-based motifによって小胞体へ戻されるため,その大部分は小胞体に安定して局在する.その一方で,M2型とM3型はゴルジ体へ運ばれた後,M2型は速やかにリソソームで分解され,M3型は安定してゴルジ体に繋留するといったような異なる運命をたどる.M3型のゴルジ体繋留には小胞体搬出シグナルとしても機能するR/K-based motifが関与しており,このシグナルによってゴルジ体の層板間を循環している.M2型が安定してゴルジ体に局在できないのは,M3型よりも長いN末端側配列が,このゴルジ体繋留に関わるR/K-based motifの機能を抑制するためのようである.この抑制はM1型でもみられ,R-based motif(逆行輸送シグナル)に変異を入れたM1型もまたリソソームで速やかに分解される19, 20).
GM2合成酵素にはN末端の長さが異なる2種類のアイソフォーム(M1型とM2型)が存在する(図4).GM2合成酵素がGM3合成酵素と大きく異なるのは,内腔側でシステイン残基を介して二量体を形成することである23).M1型をコードするmRNAバリアントの発現が低いため,M1型の発現量はM2型と比べて低く抑えられる.M1型とM2型はそれぞれホモ二量体およびヘテロ二量体を形成することができるが,その発現量比を考慮すると,大部分がM2型/M2型二量体で,一部がM1型/M2型ヘテロ二量体であると考えられる.GM2合成酵素にも膜貫通ドメインの直上にR/K-based motif(小胞体搬出/ゴルジ体繋留シグナル)を有しているが,M2型/M2型二量体やM1型/M2型ヘテロ二量体にとって,この配列は小胞体搬出に必須ではない.GM2合成酵素は二量体形成ができなくなる変異を導入すると小胞体から搬出されないので,GM2合成酵素の立体構造を認識してCOPII小胞に詰め込む積荷受容体がこの輸送に関与していることが示唆される(図4のbox).
GM2合成酵素のM1型には逆行輸送シグナルであるR-based motifが存在するが,なぜかこのシグナルはGM3合成酵素ほど小胞体へ逆行輸送させる力を持たない.しかし,M1型ホモ二量体はM2型ホモ二量体よりも安定して細胞内にとどまる.M1型/M2型ヘテロ二量体ーがM1型ホモ二量体と同程度の安定性を有しているため,M1型のR-based motifがゴルジ体の層板間の循環に寄与している可能性が考えられる24).
このように,GM3合成やGM2合成において,細胞内輸送シグナルによって異なる安定性を付与された複数のアイソフォームが,複雑に絡み合いながらダイナミックなゴルジ体層板内を動き回っている.この複雑性こそが糖脂質生合成の恒常性を生み出す鍵なのかもしれない.
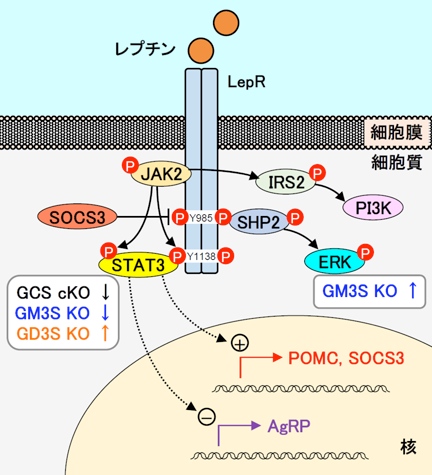
恒常的な摂食調節機構は,生体のエネルギーバランス維持に重要である.視床下部は摂食調節において中心的な役割を持ち,末梢組織から分泌される種々のホルモン等によるエネルギー情報を受け取り,代謝を調節している.白色脂肪細胞が分泌するレプチンは血流を介して中枢に情報を伝え,長期的な摂食抑制作用を示す.視床下部弓状核のPOMC(proopiomelanocortin)ニューロンとAgRP/NPY(Agouti-related peptide/neuropeptide Y)ニューロンはレプチン受容体(LepR)を発現しており,それぞれ摂食抑制および摂食促進に関わるニューロンとして相反する形で調節をしている(図5).POMCニューロンはレプチンによって活性化されると,JAK2(Janus kinase 2)-STAT3(signal transducer and activator of transcription 3)経路の活性化を介してPOMCやSOCS3(suppressor of cytokine signaling 3)等の標的遺伝子の転写を活性化する.前駆体POMCからはα-MSH(α-melanocyte stimulating hormone)が産生され,室傍核にあるメラノコルチン受容体MC4R(melanocortin-4 receptor)を持つ二次ニューロンを介して摂食を抑制する.一方でSOCS3はレプチン受容体に結合し,そのシグナルを抑制することで負のフィードバックループを形成する.AgRPはMC4Rを抑制し,NPYはNPY受容体を介していずれも摂食を促進するが,レプチンはAgRP/NPYニューロンを抑制することで摂食抑制へと導く25).
食餌誘導性肥満はレプチンの作用不全,すなわちレプチン抵抗性を惹起し,さらに末梢組織の慢性炎症を介して全身性のインスリン抵抗性を引き起こす.実際に肥満者においては血中レプチン濃度が高く,さらにレプチンを投与しても十分な減量効果が得られず,レプチン抵抗性の状態にあるとされている26, 27).レプチン抵抗性に関してはいくつかの異なる機序が提唱されているが,明確な機序は定かではない.
近年,LepRシグナルにおけるガングリオシドの役割が徐々に明らかにされてきている(図5).Nordströmらは,誘導型前脳特異的グルコシルセラミド(GlcCer)合成酵素ノックアウト(GCS cKO)マウスが進行性の肥満を呈し,それがガングリオシドの前駆体となるGlcCerの欠失に伴う視床下部ニューロンのLepRシグナルの減弱に起因することを報告した28).哺乳動物の脳のガングリオシド組成は,主にa系列とb系列であるGM1, GD1a, GD1b, GT1bなどからなっているが(構造は図1参照),Nordströmらは,視床下部由来神経細胞株N-41において,LepRがGM1およびGD1aと相互作用し,それがLepRシグナルの十分な活性化(STAT3リン酸化)に必要であることを示した.
一方,Jiらは,b系列ガングリオシドを欠くGD3合成酵素ノックアウト(GD3S KO)マウスのレプチン分泌異常と脂肪組織内蓄積を見いだした29).このKOマウスの視床下部では,a系列のGM1とGD1aの発現増加とともにLepR発現とSTAT3リン酸化が亢進しており,それが血中レプチンの著しい低値にもかかわらずGD3S KOマウスが肥満を発症しない理由のようである30).さらに,N-41細胞にGD3Sを過剰発現させると,a系列の減少とともにレプチン刺激によるSTAT3リン酸化の減弱がみられた.この結果からも,a系列ガングリオシドがLepRシグナルを正に調節していることが示された.
我々のグループは,肥満病態におけるガングリオシドの機能を調べるため,遺伝性肥満モデルにおけるGM3Sノックアウトマウス(GM3S KO)を作製した.KK-Ayマウスは重度の過食とともにレプチン抵抗性を発症するモデルであるが,KK-Ay/GM3S KOマウスでは,レプチンの腹腔内投与に対する視床下部弓状核ニューロンの応答性が維持されていた31).N-41細胞を用いてGM3S KO細胞を作製すると,KOマウス脳と同様にa系列ガングリオシドの消失とo系列のGM1bの発現がみられ,レプチン刺激に対するSTAT3リン酸化は減弱する一方でERK(extracellular signal-regulated kinase)のリン酸化が著明に亢進していた.レプチンの抗肥満作用に関してはJAK2-STAT3経路が最もよく研究されているが,SHP2(SH2-containing protein tyrosine phosphatase 2)-ERK経路についてもレプチンの作用に関わることが示されており32, 33),KK-Ay/GM3S KOマウスでみられた過食・肥満病態の改善はLepR~ERK経路の亢進によるものと考えられる.
LepRはJAK2-STAT3, SHP2-ERK, PI3K(phosphoinositide 3-kinase)-AKTなどのいくつかの異なるシグナル経路の活性化につながり,エネルギー恒常性の維持以外にも多様な機能を持つことが知られている.どのガングリオシド分子種が,どういった特異性でレプチン受容体機能を調節しているのかについて,詳細な機序の解明が今後の課題である.
5. コレステロール吸収におけるガングリオシドの役割
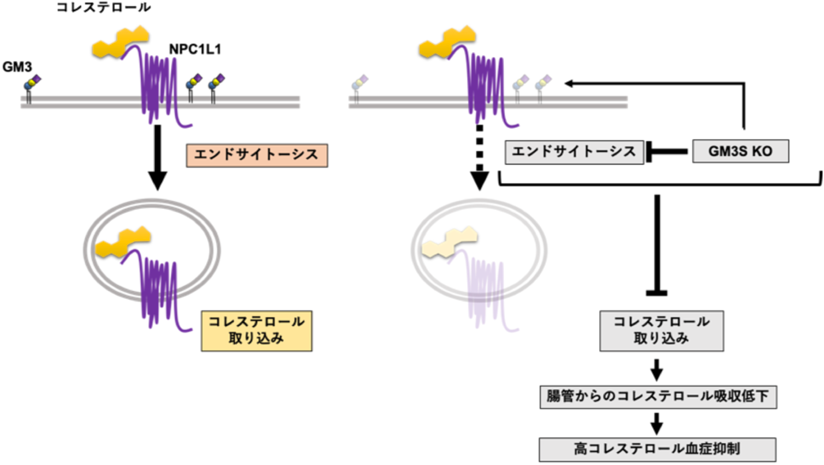
近年,腸管からの栄養吸収におけるスフィンゴ糖脂質の重要性が明らかとなってきている.これまでにC57BL6マウスの小腸絨毛における糖脂質組成が,発達の段階において種々の栄養吸収トランスポーターの遺伝子発現の変化と相関するようにダイナミックに変化することが報告されている34).また,腸上皮特異的GCS cKOマウスの解析から,スフィンゴ糖脂質が腸管の絨毛構造形成・脂質吸収に必須の因子である可能性が明らかとなっている35).我々は,腸管からのコレステロール吸収を担うNiemann-Pick C1 Like 1(NPC1L1)の機能にGM3をはじめとするガングリオシドが重要な役割を果たすことを新たに見いだした36).
腸管からのコレステロール吸収は,長らく特定のトランスポーターが介在しない受動拡散による輸送だと考えられてきたが,2004年にコレステロール特異的な輸送タンパク質として13回膜貫通タンパク質であるNPC1L1が発見された37, 38).NPC1L1は,コレステロール,スフィンゴ脂質などの細胞内蓄積を特徴とするNiemann-Pick病C型の原因遺伝子産物,NPC1とアミノ酸配列で約50%の相同性を有する.NPC1L1の発現分布には種差があり,ヒトでは主に小腸刷子縁膜,肝細胞毛細胆管膜において発現する一方で,マウスでは肝臓での発現は低い38, 39).NPC1L1を介したコレステロール輸送機構の詳細は未解明な点が多く残されているものの,ここ10年ほどでようやくその一端が明らかとなってきた.NPC1L1は定常状態ではエンドソームに局在し,コレステロール枯渇時には形質膜へとリクルートされ,N末端領域に対するコレステロールの結合をトリガーとして小胞輸送により形質膜のコレステロールを細胞内へと取り込む(図6左)40–42).我々は,このコレステロール依存的なNPC1L1の局在変化がGM3SをノックアウトしたHEK293T細胞およびGM3S KOマウスの小腸絨毛において抑制されており,GM3S KOマウスはNPC1L1の機能低下に伴う腸管からのコレステロール吸収抑制により高コレステロール血症に対して抵抗性を示すことを報告している(図6右)36).NPC1L1はガングリオシドに富む膜マイクロドメイン(脂質ラフト)に局在し,生理的な機能を発揮するためにはマイクロドメインの足場タンパク質であるフロチリン-1,フロチリン-2との会合を必要とする.NPC1L1を分子標的とした脂質異常症治療薬として用いられているエゼチミブは,NPC1L1とフロチリン-1,2との相互作用を減弱させ,マイクロドメインへの局在化を抑制することでNPC1L1の機能を抑制することが明らかとなっている40, 43).フロチリンは,形質膜コレステロール,ガングリオシドを含むスフィンゴ脂質とともにマイクロドメインを形成し,NPC1L1近傍の領域でコレステロールに富む微小環境を作り出すことで,エンドサイトーシスによるコレステロール吸収効率の向上に寄与しているのではないかと考えられているものの,マイクロドメインがNPC1L1の機能においてどのような役割を果たしているのかについてはより詳細な解析が必要である.また,ガングリオシドが実際にNPC1L1の機能にどのような機構で関与しているのか,NPC1L1の機能に寄与しうるガングリオシド分子種に特異性はあるのか等についても今後の研究課題となっている.
近年,スフィンゴ糖脂質を介した自然免疫応答の活性化・調節機構が急速に明らかとなりつつある.セラミドへのグルコース付加によって生じるGlcCerは,抗原提示細胞である樹状細胞において,C型レクチン受容体の一つであるMincleの活性化を引き起こす44).Mincleは,肥満時の脂肪組織で発現量が増加しており,さらにMincle KOマウスでは,メタボリックシンドロームの症状が緩和されることもわかってきている45, 46).続いて,GlcCerへのガラクトース付加で生成するLacCerは,好中球における自然免疫応答に関与する.LacCerは,抗酸菌細胞壁の糖脂質リポアラビノマンナンの認識に関与し,SrcファミリーチロシンキナーゼLynによるシグナル伝達を介して貪食後の食胞成熟と殺菌機構の活性化に大きく寄与する47).さらに,LacCerへのガラクトース,N-アセチルガラクトサミン付加で生じるグロボ系スフィンゴ糖脂質Gb3およびGb4は,血管内皮細胞やマクロファージにおけるTLR4活性化制御に関与することが報告されている44, 46).
脂肪細胞におけるGM3の発現は,組織マクロファージに由来する炎症性サイトカインTNF-αやIL-1βの刺激によって誘導される48, 49).肥満時には,脂肪組織へのマクロファージ浸潤が生じ,炎症性サイトカイン産生による慢性炎症を介して,インスリン抵抗性を呈することがよく知られている44, 45).食欲抑制ホルモンであるレプチンの欠損によって肥満・メタボリックシンドロームを呈するob/obマウスや,高脂肪食によって誘導された肥満モデルマウスの脂肪組織ではマクロファージ浸潤・慢性炎症が生じるが,内臓脂肪組織におけるGM3の発現量とGM3S遺伝子(St3gal5)の発現を調べると,それらが大幅に亢進している48, 49).GM3などのスフィンゴ糖脂質は,細胞膜上で互いに集合したクラスター,すなわち,脂質マイクロドメインと呼ばれるシグナル伝達プラットフォームを形成する3).我々は,GM3の異常な発現上昇によって,細胞膜上におけるインスリン受容体の拡散速度が影響を受け,シグナル伝達効率が大きく制限されることでインスリン抵抗性を生じることを生細胞分子イメージング法によって示した50).一方,GlcCer合成酵素阻害薬であるD-PDMPやGenz-123346を用いてGM3の合成を阻害すると,脂肪細胞におけるインスリン抵抗性が解除される51).興味深いのは,GM3S KOマウスにおいては,全身のインスリン感受性が改善するだけでなく,肥満による慢性炎症も大きく緩和されていることである49, 52).このことは,インスリン抵抗性よりも上流で,GM3を介した慢性炎症メカニズムが存在することを示唆している.メタボリックシンドロームに関連するTLR4リガンドには,肥満時に脂肪組織中の発現量や血清中への分泌量が増加する特徴があり,GM3もその特徴を満たしている.そこで,実際にGM3がTLR4を介して自然免疫応答を活性化する可能性を検討することにした.
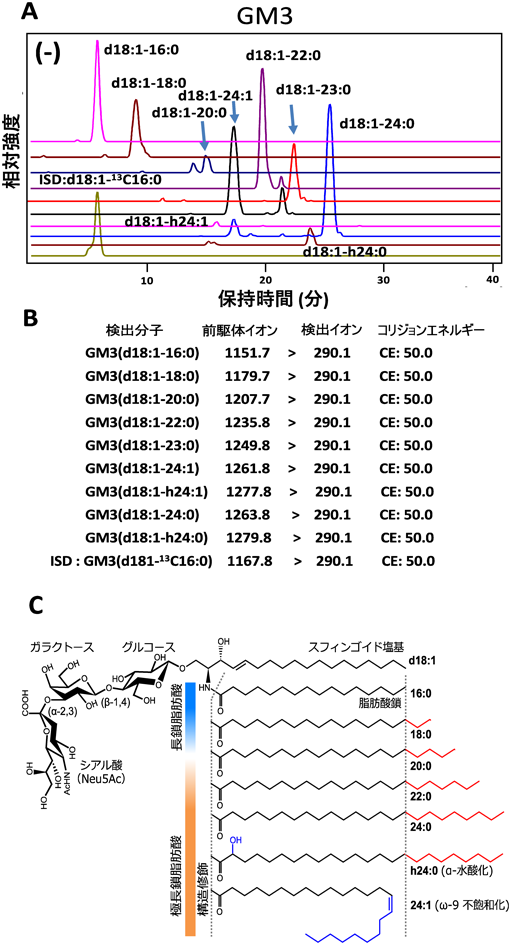
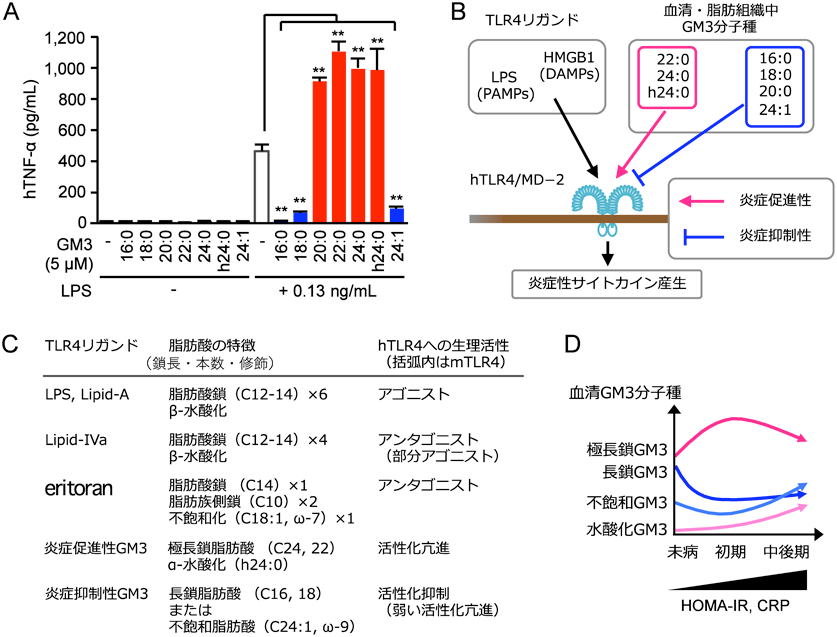
脂肪組織や血清中に存在するGM3には,同じ糖鎖を持ちながら,異なるセラミド構造を持つ多様な分子種が存在している(図3C).特に,スフィンゴシンと脂肪酸からなるセラミド構造のうち,脂肪酸鎖の鎖長[長鎖脂肪酸(16 : 0, 18 : 0, 20 : 0),極長鎖脂肪酸(22 : 0, 24 : 0)]と構造修飾[α-水酸化(h24 : 0),ω-9不飽和化(24 : 1)]について,それらの組合わせによる幅広い多様性がみられる(図3C).興味深いことに,これらのGM3分子種の血清中発現パターンが,メタボリックシンドロームの発症過程で変動することはわかってきたが12),一方で各分子種の生理活性とその変動の意義は不明のままであった.
そこで,ヒト末梢血由来単球における自然免疫応答を指標に,代表的なGM3分子種(16 : 0, 18 : 0, 20 : 0, 22 : 0, 24 : 0, h24 : 0, 24 : 1)の生理活性を検討した(図7A).その結果,ヒトTLR4/MD-2複合体を介した炎症性サイトカイン産生に対して,長鎖脂肪酸のGM3分子種(16 : 0, 18 : 0)は抑制的に作用し,一方,極長鎖脂肪酸のGM3分子種(22 : 0, 24 : 0, h24 : 0)はTLR4活性化を強く促進することがわかった53).一方で,極長鎖脂肪酸でも,不飽和化を受けたGM3分子種(24 : 1)は,TLR4に対して抑制的に作用した.興味深いことに,これらの作用は,LPSやLipid-A, HMGB1などのTLR4リガンドに対して選択的に生じ,その他のTLRリガンドに対しては影響を及ぼさなかった.また,GM3単独では活性化・抑制作用を示さず,TLR4リガンドの存在下で初めて,活性化制御を示す点も特徴的であった.これらを総括すると,GM3分子種は,その脂肪酸構造に依存して炎症抑制性と炎症促進性を併せ持つ,TLR4選択的な内因性モジュレーターであると考えられる(図7B).
加えて,マウスTLR4/MD-2複合体を介した自然免疫応答に対しても,GM3分子種の生理活性を検討した.極長鎖脂肪酸のGM3分子種については,ヒトの場合と同様にTLR4活性化を強く促進した.ところが,長鎖脂肪酸や不飽和脂肪酸のGM3分子種では,ヒトTLR4に対するような抑制性は認められず,TLR4活性化を弱く促進した.すなわち,マウスTLR4に対しては,GM3分子種全体が炎症促進性を持つこと,その生理活性がアシル鎖長に比例して増大することがわかった.
前述したGM3分子種の生理活性や,ヒトとマウスにおける作用の違いはなぜ生じ,どのようにしてTLR4/MD-2によるGM3認識機構と関係しているのだろうか.LPSがTLR4リガンドとして作用する場合,糖鎖構造はTLR4が,脂肪酸構造はMD-2が,それぞれ認識する54, 55).さらにLPSでは,脂肪酸構造の多様性と生理活性の変化について多くの報告がある55–60).LPSのコア構造であるLipid-Aは,6本の脂肪酸を持ち,ヒト・マウスのTLR4/MD-2に対してともにアゴニストとして作用する(図7C).一方,Lipid-Aの前駆体であるLipid-IVaは,4本の脂肪酸を持ち,ヒトTLR4/MD-2ではアンタゴニストとして,マウスTLR4/MD-2では部分アゴニストとして作用する(図7C).そして,上記の生理活性と脂肪酸数の相関性は,MD-2の生物種に依存しており,マウスTLR4/ヒトMD-2キメラ複合体に対しては,ヒトTLR4/MD-2複合体と同様に,Lipid-IVaによる抑制効果がみられる.さらに,Lipid-IVaアナログであるTLR4阻害剤eritoranは,MD-2への結合を介した阻害効果に関与する不飽和脂肪酸(18 : 1, ω7)を持つ(図7C)61).この二重結合部位で,不飽和脂肪酸鎖は180°反転しつつMD-2の疎水性ポケットに結合しており,見かけの鎖長の短縮と結合力(疎水性)の増大を同時に達成していると考えられる.
GM3は,グルコース,ガラクトース,シアル酸からなる糖鎖と,異なる脂肪酸構造を含むセラミド部分を持つ点で,すなわち糖脂質自体の性質でLPSとよく類似している.したがって,MD-2がGM3の脂肪酸構造の認識に関与する可能性は十分に考えられる.そこで,マウスTLR4/MD-2複合体,ヒトTLR4/MD-2複合体,そしてマウスTLR4/ヒトMD-2からなるキメラ複合体を用いて,GM3 16 : 0の生理活性を比較検討した.その結果,マウスTLR4/ヒトMD-2キメラ複合体に対しても,ヒトTLR4/MD-2複合体と同様に,GM3 16 : 0は抑制的に作用した.すなわち,脂肪酸構造にもとづくGM3の生理活性は,MD-2に依存することがわかった.この結果は,もう一つの重要な側面として,GM3が脂質膜上からTLR4を制御する可能性に加え,LPSと同様に糖脂質リガンドとしてMD-2を介してTLR4に作用する可能性を示唆している.Native-PAGE法などを用いたTLR4/MD-2複合体(細胞外ドメイン)とGM3分子種の相互作用解析によっても,GM3とTLR4/MD-2の相互作用や,TLR4/MD-2複合体の二量体化・多量体化と考えられる分子量の増大が確認できた.上記のようなGM3分子種でみられた生理活性と脂肪酸鎖長・修飾の関係性,MD-2への依存性は,Lipid-A/IVaやeritoranの場合とよく類似しており(図7C),脂質構造の大きさによるTLR4の活性化制御機構は,糖脂質性のリガンド間において保存されていると考えられる.
では,どのようにしてGM3分子種の脂肪酸構造の変化がメタボリックシンドロームの発症や進行と関わるのだろうか.そこで,メタボリックシンドロームの発症過程におけるヒト血清GM3分子種の発現量を質量分析法によって測定し,その発現変動パターンを解析した(図7D).自然免疫応答に対する生理活性をもとにGM3分子種を分類すると,長鎖GM3分子種(16 : 0, 18 : 0, 20 : 0)は炎症抑制性,極長鎖GM3分子種(22 : 0, 24 : 0, h24 : 0)は炎症促進性であり,極長鎖不飽和GM3分子種(24 : 1, h24:1)は炎症抑制性と考えられる.その結果,炎症抑制性のGM3分子種(16 : 0, 18 : 0)は,未病の肥満や初期メタボリックシンドロームにおいて急激に減少していた.一方,炎症促進性のGM3分子種(22 : 0, 23 : 0, 24 : 0, h24 : 0)は大きく増加していた.特に,水酸化極長鎖GM3 h24 : 0は,肥満の指標であるBMI,腹囲,そして慢性炎症の指標かつ炎症性サイトカインIL-6の代替マーカーであるCRPおよびインスリン抵抗性の指標であるHOMA-IRと,強い正の相関を示した.また,より重度の肥満・メタボリックシンドロームでは,肥満時に増加した極長鎖GM3が減少に転じ,代わりに不飽和化極長鎖GM3(22 : 1, 24 : 1, h24 : 1)の発現が増加した.これらを総括すると,肥満やメタボリックシンドローム発症初期においては,GM3分子種の炎症促進性シフトに伴って慢性炎症が生じていると考えられる.重症期では,極長鎖脂肪酸の不飽和化によって,GM3の炎症促進性を抑える機構が働いていると考えられる.さらに,肥満モデルマウス(ob/obマウス,および高脂肪食負荷マウス)の内臓脂肪組織についてもGM3分子種を解析した.その結果,水酸化極長鎖GM3分子種が大きく増加していた.おそらく,ヒト血清中の水酸化極長鎖GM3の増加は,内臓脂肪組織におけるGM3分子種の変化が反映された可能性がある.これらに加え,内臓脂肪組織における水酸化極長鎖GM3の増加は,TLR4の機能欠損変異体(C3H/HeJ)マウスにおいて緩和されていた.したがって,炎症促進性GM3の発現増加は,その受容体であるTLR4を介した炎症性サイトカイン産生に一部依存していると考えられる.
ガングリオシドの生合成メカニズムは,スフィンゴイド塩基,脂肪酸,そしてシアル酸を含む糖鎖に至るまで,幅広い生体関連因子の生合成・代謝経路に依存している.それゆえ,GM3分子種の発現量を制御する分子メカニズムは,きわめて複雑である.GM3分子種全体の発現量に関わるGM3S遺伝子の発現量は,前述のように,組織マクロファージに由来する炎症性サイトカインTNF-αやIL-1βの刺激によって制御されている48, 49).一方で,脂肪酸鎖長の制御に関わる因子としては,これまでに脂肪酸伸長酵素ELOVLが知られている.特に,Elovl3-KOマウスやElovl6-KOマウスでは,肥満によるメタボリックシンドロームの進行が緩和されることが知られている62, 63).ELOVL6は長鎖脂肪酸16 : 0を18 : 0へ,ELOVL3は18 : 0を20 : 0に伸長する反応を担っており,極長鎖脂肪酸の前駆体の生合成に関与している.野生型と比べてElovl6-KOマウスの脂肪酸組成は,18 : 0から24 : 0において減少しており,マウスTLR4に対する主要な炎症促進性GM3分子種が減少している可能性が予想される.加えて,炎症反応の後期では,脂肪酸の不飽和化が生じ,自然免疫応答の終息に不可欠であることが報告されている64).これは,GM3においても,重症期の不飽和GM3の増加として反映されていると考えられる.一方,水酸化修飾は,水酸化による水溶性の増大が血清中へのGM3分泌量に影響する可能性や,α-酸化を介した極長鎖脂肪酸の分解亢進との関連性が考えられる51).さらには,肥満時に生じる,セラミド合成酵素CerS2/6の発現変化やβ-酸化の障害も,GM3分子種のバランスの変化に関与する可能性がある65, 66).CerS2/6には,長鎖脂肪酸と極長鎖脂肪酸の選択性に違いがあり,それらの発現バランスによってセラミドの脂肪酸組成が制御されうる.これらの分子メカニズムとGM3分子種変化との関連を解明するには,セラミドからGM3に至るまでの網羅的な分子種発現解析と遺伝子発現解析が必要であり,今後の進展が望まれる.このように,GM3分子種は複雑な発現メカニズムを有しているが,一方で,多くの因子に依存するということは,多くの調節点を持つことに他ならない.GM3分子種の発現調節メカニズムは,さまざまなストレスや脂質代謝の変化を受けとり,それをTLR4経由の自然免疫応答へと反映させることが可能なシステムであるのかもしれない.その破綻が,恒常性維持機構としての自然免疫応答を,疾患発症原因である慢性炎症へと導くというのは,想像にかたくない.
引用文献References
1) Yamakawa, T. & Suzuki, S. (1951) The chemistry of the lipids of posthemolytic residue or stroma of erythrocytes. I. Concerning the ether-insoluble lipids of lyophilized horse blood stroma. J. Biochem., 38, 199–212.
2) Ishii, A., Ohta, M., Watanabe, Y., Matsuda, K., Ishiyama, K., Sakoe, K., Nakamura, M., Inokuchi, J., Sanai, Y., & Saito, M. (1998) Expression cloning and functional characterization of human cDNA for ganglioside GM3 synthase. J. Biol. Chem., 273, 31652–31655.
3) Inokuchi, J., Inamori, K., Kabayama, K., Nagafuku, M., Uemura, S., Go, S., Suzuki, A., Ohno, I., Kanoh, H., & Shishido, F. (2018) Biology of GM3 ganglioside. Prog. Mol. Biol. Transl. Sci., 156, 151–195.
4) 井ノ口仁一(2015)ガングリオシドファミリーの分子種選択的発現と生理活性脂質としての意義.生化学,87, 558–570.
5) Yu, R.K., Yanagisawa, M., & Ariga, T. (2007) Glycosphingolipid structures, in Comprehensive Glycoscience, pp. 73–122, Elsevier, Oxford, UK.
6) Merrill, A.H. Jr. (2011) Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem. Rev., 111, 6387–6422.
7) Simons, K. & Gerl, M.J. (2010) Revitalizing membrane rafts: new tools and insights. Nat. Rev. Mol. Cell Biol., 11, 688–699.
8) Suzuki, A., Suzuki, M., Ito, E., Nitta, T., & Inokuchi, J.I. (2018) Mass spectrometry of gangliosides. Methods Mol. Biol., 1804, 207–221.
9) Tanaka, K., Suzuki, A., Aoki, D., & Iwamori, M. (2019) Characterization of a novel glycolipid with a difucosylated H-antigen in human blood group O erythrocytes with monoclonal antibody HMMC-1 and its detection in human uterine cervical carcinoma tissues. Glycoconj. J., 36, 219–226.
10) Silsirivanit, A., Phoomak, C., Teeravirote, K., Wattanavises, S., Seubwai, W., Saengboonmee, C., Zhan, Z., Inokuchi, J.I., Suzuki, A., & Wongkham, S. (2019) Overexpression of HexCer and LacCer containing 2-hydroxylated fatty acids in cholangiocarcinoma and the association of the increase of LacCer (d18:1–h23:0) with shorter survival of the patients. Glycoconj. J., 36, 103–111.
11) Ito, E., Waki, H., Miseki, K., Shimada, T., Sato, T.A., Kakehi, K., Suzuki, M., & Suzuki, A. (2013) Structural characterization of neutral glycosphingolipids using high-performance liquid chromatography-electrospray ionization mass spectrometry with a repeated high-speed polarity and MSn switching system. Glycoconj. J., 30, 881–888.
12) Veillon, L., Go, S., Matsuyama, W., Suzuki, A., Nagasaki, M., Yatomi, Y., & Inokuchi, J. (2015) Identification of ganglioside GM3 molecular species in human serum associated with risk factors of metabolic syndrome. PLoS One, 10, e0129645.
13) Oikawa, N., Matsubara, T., Fukuda, R., Yasumori, H., Hatsuta, H., Murayama, S., Sato, T., Suzuki, A., & Yanagisawa, K. (2015) Imbalance in fatty-acid-chain length of gangliosides triggers Alzheimer amyloid deposition in the precuneus. PLoS One, 10, e0121356.
14) Oikawa, N., Hatsuta, H., Murayama, S., Suzuki, A., & Yanagisawa, K. (2014) Influence of APOE genotype and the presence of Alzheimer’s pathology on synaptic membrane lipids of human brains. J. Neurosci. Res., 92, 641–650.
15) Nagafuku, M., Okuyama, K., Onimaru, Y., Suzuki, A., Odagiri, Y., Yamashita, T., Iwasaki, K., Fujiwara, M., Takayanagi, M., Ohno, I., et al. (2012) CD4 and CD8 T cells require different membrane gangliosides for activation. Proc. Natl. Acad. Sci. USA, 109, E336–E342.
16) Ito, E., Tominaga, A., Waki, H., Miseki, K., Tomioka, A., Nakajima, K., Kakehi, K., Suzuki, M., Taniguchi, N., & Suzuki, A. (2012) Structural characterization of monosialo-, disialo- and trisialo-gangliosides by negative ion AP-MALDI-QIT-TOF mass spectrometry with MS(n) switching. Neurochem. Res., 37, 1315–1324.
17) Kurokawa, K., Osakada, H., Kojidani, T., Waga, M., Suda, Y., Asakawa, H., Haraguchi, T., & Nakano, A. (2019) Visualization of secretory cargo transport within the Golgi apparatus. J. Cell Biol., 218, 1602–1618.
18) Yano, H., Yamamoto-Hino, M., Abe, M., Kuwahara, R., Haraguchi, S., Kusaka, I., Awano, W., Kinoshita-Toyoda, A., Toyoda, H., & Goto, S. (2005) Distinct functional units of the Golgi complex in Drosophila cells. Proc. Natl. Acad. Sci. USA, 102, 13467–13472.
19) Uemura, S., Yoshida, S., Shishido, F., & Inokuchi, J. (2009) The cytoplasmic tail of GM3 synthase defines its subcellular localization, stability, and in vivo activity. Mol. Biol. Cell, 20, 3088–3100.
20) Uemura, S., Shishido, F., Kashimura, M., & Inokuchi, J. (2015) The regulation of ER export and Golgi retention of ST3Gal5 (GM3/GM4 synthase) and B4GalNAcT1 (GM2/GD2/GA2 synthase) by arginine/lysine-based motif adjacent to the transmembrane domain. Glycobiology, 25, 1410–1422.
21) Giraudo, C.G. & Maccioni, H.J. (2003) Endoplasmic reticulum export of glycosyltransferases depends on interaction of a cytoplasmic dibasic motif with Sar1. Mol. Biol. Cell, 14, 3753–3766.
22) Michelsen, K., Schmid, V., Metz, J., Heusser, K., Liebel, U., Schwede, T., Spang, A., & Schwappach, B. (2007) Novel cargo-binding site in the beta and delta subunits of coatomer. J. Cell Biol., 179, 209–217.
23) Li, J., Yen, T.Y., Allende, M.L., Joshi, R.K., Cai, J., Pierce, W.M., Jaskiewicz, E., Darling, D.S., Macher, B.A., & Young, W.W. Jr. (2000) Disulfide bonds of GM2 synthase homodimers. Antiparallel orientation of the catalytic domains. J. Biol. Chem., 275, 41476–41486.
24) Shishido, F., Uemura, S., Kashimura, M., & Inokuchi, J. (2017) Identification of a new B4GalNAcT1 (GM2/GD2/GA2 synthase) isoform, and regulation of enzyme stability and intracellular transport by arginine-based motif. Biochim. Biophys. Acta Biomembr., 1859, 2001–2011.
25) Yeo, G.S. & Heisler, L.K. (2012) Unraveling the brain regulation of appetite: Lessons from genetics. Nat. Neurosci., 15, 1343–1349.
26) Heymsfield, S.B., Greenberg, A.S., Fujioka, K., Dixon, R.M., Kushner, R., Hunt, T., Lubina, J.A., Patane, J., Self, B., Hunt, P., et al. (1999) Recombinant leptin for weight loss in obese and lean adults: A randomized, controlled, dose-escalation trial. JAMA, 282, 1568–1575.
27) Considine, R.V., Sinha, M.K., Heiman, M.L., Kriauciunas, A., Stephens, T.W., Nyce, M.R., Ohannesian, J.P., Marco, C.C., McKee, L.J., Bauer, T.L., et al. (1996) Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N. Engl. J. Med., 334, 292–295.
28) Nordstrom, V., Willershauser, M., Herzer, S., Rozman, J., von Bohlen Und Halbach, O., Meldner, S., Rothermel, U., Kaden, S., Roth, F.C., Waldeck, C., et al. (2013) Neuronal expression of glucosylceramide synthase in central nervous system regulates body weight and energy homeostasis. PLoS Biol., 11, e1001506.
29) Ji, S., Ohkawa, Y., Tokizane, K., Ohmi, Y., Banno, R., Furukawa, K., Kiyama, H., & Furukawa, K. (2015) b-Series gangliosides crucially regulate leptin secretion in adipose tissues. Biochem. Biophys. Res. Commun., 459, 189–195.
30) Ji, S., Tokizane, K., Ohkawa, Y., Ohmi, Y., Banno, R., Okajima, T., Kiyama, H., Furukawa, K., & Furukawa, K. (2016) Increased a-series gangliosides positively regulate leptin/Ob receptor-mediated signals in hypothalamus of GD3 synthase-deficient mice. Biochem. Biophys. Res. Commun., 479, 453–460.
31) Inamori, K., Ito, H., Tamura, Y., Nitta, T., Yang, X., Nihei, W., Shishido, F., Imazu, S., Tsukita, S., Yamada, T., et al. (2018) Deficient ganglioside synthesis restores responsiveness to leptin and melanocortin signaling in obese KKAy mice. J. Lipid Res., 59, 1472–1481.
32) Balland, E., Dam, J., Langlet, F., Caron, E., Steculorum, S., Messina, A., Rasika, S., Falluel-Morel, A., Anouar, Y., Dehouck, B., et al. (2014) Hypothalamic tanycytes are an ERK-gated conduit for leptin into the brain. Cell Metab., 19, 293–301.
33) Rahmouni, K., Sigmund, C.D., Haynes, W.G., & Mark, A.L. (2009) Hypothalamic ERK mediates the anorectic and thermogenic sympathetic effects of leptin. Diabetes, 58, 536–542.
34) Yoneshige, A., Sasaki, A., Miyazaki, M., Kojima, N., Suzuki, A., & Matsuda, J. (2010) Developmental changes in glycolipids and synchronized expression of nutrient transporters in the mouse small intestine. J. Nutr. Biochem., 21, 214–226.
35) Jennemann, R., Kaden, S., Sandhoff, R., Nordstrom, V., Wang, S., Volz, M., Robine, S., Amen, N., Rothermel, U., Wiegandt, H., et al. (2012) Glycosphingolipids are essential for intestinal endocytic function. J. Biol. Chem., 287, 32598–32616.
36) Nihei, W., Nagafuku, M., Hayamizu, H., Odagiri, Y., Tamura, Y., Kikuchi, Y., Veillon, L., Kanoh, H., Inamori, K., Arai, K., et al. (2018) NPC1L1-dependent intestinal cholesterol absorption requires ganglioside GM3 in membrane microdomains. J. Lipid Res., 59, 2181–2187.
37) Betters, J.L. & Yu, L. (2010) NPC1L1 and cholesterol transport. FEBS Lett., 584, 2740–2747.
38) Altmann, S.W., Davis, H.R. Jr., Zhu, L.J., Yao, X., Hoos, L.M., Tetzloff, G., Iyer, S.P., Maguire, M., Golovko, A., Zeng, M., et al. (2004) Niemann–Pick C1 Like 1 protein is critical for intestinal cholesterol absorption. Science, 303, 1201–1204.
39) Davies, J.P., Scott, C., Oishi, K., Liapis, A., & Ioannou, Y.A. (2005) Inactivation of NPC1L1 causes multiple lipid transport defects and protects against diet-induced hypercholesterolemia. J. Biol. Chem., 280, 12710–12720.
40) Zhang, J.H., Ge, L., Qi, W., Zhang, L., Miao, H.H., Li, B.L., Yang, M., & Song, B.L. (2011) The N-terminal domain of NPC1L1 protein binds cholesterol and plays essential roles in cholesterol uptake. J. Biol. Chem., 286, 25088–25097.
41) Ge, L., Wang, J., Qi, W., Miao, H.H., Cao, J., Qu, Y.X., Li, B.L., & Song, B.L. (2008) The cholesterol absorption inhibitor ezetimibe acts by blocking the sterol-induced internalization of NPC1L1. Cell Metab., 7, 508–519.
42) Yu, L., Bharadwaj, S., Brown, J.M., Ma, Y., Du, W., Davis, M.A., Michaely, P., Liu, P., Willingham, M.C., & Rudel, L.L. (2006) Cholesterol-regulated translocation of NPC1L1 to the cell surface facilitates free cholesterol uptake. J. Biol. Chem., 281, 6616–6624.
43) Ge, L., Qi, W., Wang, L.J., Miao, H.H., Qu, Y.X., Li, B.L., & Song, B.L. (2011) Flotillins play an essential role in Niemann–Pick C1-like 1-mediated cholesterol uptake. Proc. Natl. Acad. Sci. USA, 108, 551–556.
44) Nagata, M., Izumi, Y., Ishikawa, E., Kiyotake, R., Doi, R., Iwai, S., Omahdi, Z., Yamaji, T., Miyamoto, T., Bamba, T., et al. (2017) Intracellular metabolite beta-glucosylceramide is an endogenous Mincle ligand possessing immunostimulatory activity. Proc. Natl. Acad. Sci. USA, 114, E3285–E3294.
45) Tanaka, M., Ikeda, K., Suganami, T., Komiya, C., Ochi, K., Shirakawa, I., Hamaguchi, M., Nishimura, S., Manabe, I., Matsuda, T., et al. (2014) Macrophage-inducible C-type lectin underlies obesity-induced adipose tissue fibrosis. Nat. Commun., 5, 4982.
46) Ichioka, M., Suganami, T., Tsuda, N., Shirakawa, I., Hirata, Y., Satoh-Asahara, N., Shimoda, Y., Tanaka, M., Kim-Saijo, M., Miyamoto, Y., et al. (2011) Increased expression of macrophage-inducible C-type lectin in adipose tissue of obese mice and humans. Diabetes, 60, 819–826.
47) Nakayama, H., Kurihara, H., Morita, Y.S., Kinoshita, T., Mauri, L., Prinetti, A., Sonnino, S., Yokoyama, N., Ogawa, H., Takamori, K., et al. (2016) Lipoarabinomannan binding to lactosylceramide in lipid rafts is essential for the phagocytosis of mycobacteria by human neutrophils. Sci. Signal., 9, ra101.
48) Nagafuku, M., Sato, T., Sato, S., Shimizu, K., Taira, T., & Inokuchi, J. (2015) Control of homeostatic and pathogenic balance in adipose tissue by ganglioside GM3. Glycobiology, 25, 303–318.
49) Tagami, S.J.I., Kabayama, K., Yoshimura, H., Kitamura, F., Uemura, S., Ogawa, C., Ishii, A., Saito, M., Ohtsuka, Y., Sakaue, S., et al. (2002) Ganglioside GM3 participates in the pathological conditions of insulin resistance. J. Biol. Chem., 277, 3085–3092.
50) Kabayama, K., Sato, T., Saito, K., Loberto, N., Prinetti, A., Sonnino, S., Kinjo, M., Igarashi, Y., & Inokuchi, J. (2007) Dissociation of the insulin receptor and caveolin-1 complex by ganglioside GM3 in the state of insulin resistance. Proc. Natl. Acad. Sci. USA, 104, 13678–13683.
51) Hama, H. (2010) Fatty acid 2-hydroxylation in mammalian sphingolipid biology. Biochim. Biophys. Acta, 1801, 405–414.
52) Yamashita, T., Hashiramoto, A., Haluzik, M., Mizukami, H., Beck, S., Norton, A., Kono, M., Tsuji, S., Daniotti, J.L., Werth, N., et al. (2003) Enhanced insulin sensitivity in mice lacking ganglioside GM3. Proc. Natl. Acad. Sci. USA, 100, 3445–3449.
53) Kanoh, H., Nitta, T., Go, S., Inamori, K., Veillon, L., Nihei, W., Fujii, M., Kabayama, K., Shimoyama, A., Fukase, K., et al. (2020) Homeostatic and pathogenic roles of GM3 ganglioside molecular species in TLR4 signaling in obesity. EMBO J., in press. https://www.embopress.org/doi/10.15252/embj.2019101732
54) Park, B.S., Song, D.H., Kim, H.M., Choi, B.S., Lee, H., & Lee, J.O. (2009) The structural basis of lipopolysaccharide recognition by the TLR4-MD-2 complex. Nature, 458, 1191–1195.
55) Mueller, M., Lindner, B., Kusumoto, S., Fukase, K., Schromm, A.B., & Seydel, U. (2004) Aggregates are the biologically active units of endotoxin. J. Biol. Chem., 279, 26307–26313.
56) Saitoh, S., Akashi, S., Yamada, T., Tanimura, N., Kobayashi, M., Konno, K., Matsumoto, F., Fukase, K., Kusumoto, S., Nagai, Y., et al. (2004) Lipid A antagonist, lipid IVa, is distinct from lipid A in interaction with Toll-like receptor 4 (TLR4)-MD-2 and ligand-induced TLR4 oligomerization. Int. Immunol., 16, 961–969.
57) Akashi, S., Nagai, Y., Ogata, H., Oikawa, M., Fukase, K., Kusumoto, S., Kawasaki, K., Nishijima, M., Hayashi, S., Kimoto, M., et al. (2001) Human MD-2 confers on mouse Toll-like receptor 4 species-specific lipopolysaccharide recognition. Int. Immunol., 13, 1595–1599.
58) Wang, M.H., Feist, W., Herzbeck, H., Brade, H., Kusumoto, S., Rietschel, E.T., Flad, H.D., & Ulmer, A.J. (1990) Suppressive effect of lipid A partial structures on lipopolysaccharide or lipid A-induced release of interleukin 1 by human monocytes. FEMS Microbiol. Immunol., 2, 179–185.
59) Galanos, C., Luderitz, O., Rietschel, E.T., Westphal, O., Brade, H., Brade, L., Freudenberg, M., Schade, U., Imoto, M., Yoshimura, H., et al. (1985) Synthetic and natural Escherichia coli free lipid A express identical endotoxic activities. Eur. J. Biochem., 148, 1–5.
60) Galanos, C., Lehmann, V., Luderitz, O., Rietschel, E.T., Westphal, O., Brade, H., Brade, L., Freudenberg, M.A., Hansen-Hagge, T., Luderitz, T., et al. (1984) Endotoxic properties of chemically synthesized lipid A part structures. Comparison of synthetic lipid A precursor and synthetic analogues with biosynthetic lipid A precursor and free lipid A. Eur. J. Biochem., 140, 221–227.
61) Kim, H.M., Park, B.S., Kim, J.I., Kim, S.E., Lee, J., Oh, S.C., Enkhbayar, P., Matsushima, N., Lee, H., Yoo, O.J., et al. (2007) Crystal structure of the TLR4-MD-2 complex with bound endotoxin antagonist Eritoran. Cell, 130, 906–917.
62) Zadravec, D., Brolinson, A., Fisher, R.M., Carneheim, C., Csikasz, R.I., Bertrand-Michel, J., Boren, J., Guillou, H., Rudling, M., & Jacobsson, A. (2010) Ablation of the very-long-chain fatty acid elongase ELOVL3 in mice leads to constrained lipid storage and resistance to diet-induced obesity. FASEB J., 24, 4366–4377.
63) Matsuzaka, T., Shimano, H., Yahagi, N., Kato, T., Atsumi, A., Yamamoto, T., Inoue, N., Ishikawa, M., Okada, S., Ishigaki, N., et al. (2007) Crucial role of a long-chain fatty acid elongase, Elovl6, in obesity-induced insulin resistance. Nat. Med., 13, 1193–1202.
64) Oishi, Y., Spann, N.J., Link, V.M., Muse, E.D., Strid, T., Edillor, C., Kolar, M.J., Matsuzaka, T., Hayakawa, S., Tao, J., et al. (2017) SREBP1 contributes to resolution of pro-inflammatory TLR4 signaling by reprogramming fatty acid metabolism. Cell Metab., 25, 412–427.
65) Turpin, S.M., Nicholls, H.T., Willmes, D.M., Mourier, A., Brodesser, S., Wunderlich, C.M., Mauer, J., Xu, E., Hammerschmidt, P., Bronneke, H.S., et al. (2014) Obesity-induced CerS6-dependent C16:0 ceramide production promotes weight gain and glucose intolerance. Cell Metab., 20, 678–686.
66) Raichur, S., Wang, S.T., Chan, P.W., Li, Y., Ching, J., Chaurasia, B., Dogra, S., Ohman, M.K., Takeda, K., Sugii, S., et al. (2014) CerS2 haploinsufficiency inhibits beta-oxidation and confers susceptibility to diet-induced steatohepatitis and insulin resistance. Cell Metab., 20, 687–695.
67) Kondo, Y., Ikeda, K., Tokuda, N., Nishitani, C., Ohto, U., Akashi-Takamura, S., Ito, Y., Uchikawa, M., Kuroki, Y., Taguchi, R., et al. (2013) TLR4-MD-2 complex is negatively regulated by an endogenous ligand, globotetraosylceramide. Proc. Natl. Acad. Sci. USA, 110, 4714–4719.
68) Nitta, T., Kanoh, H., Inamori, K., Suzuki, A., Takahashi, T., & Inokuchi, J. (2019) Globo-series glycosphingolipids enhance Toll-like receptor 4-mediated inflammation and play a pathophysiological role in diabetic nephropathy. Glycobiology, 29, 260–268.