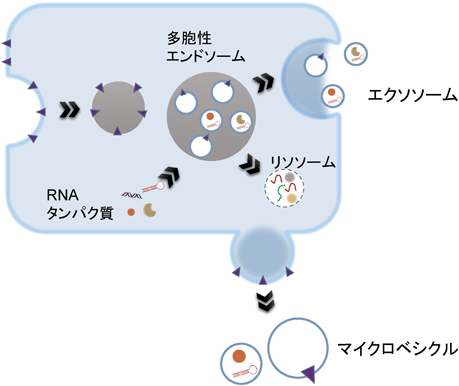
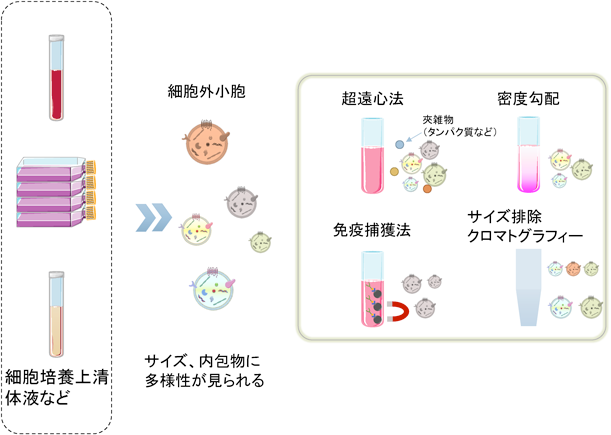
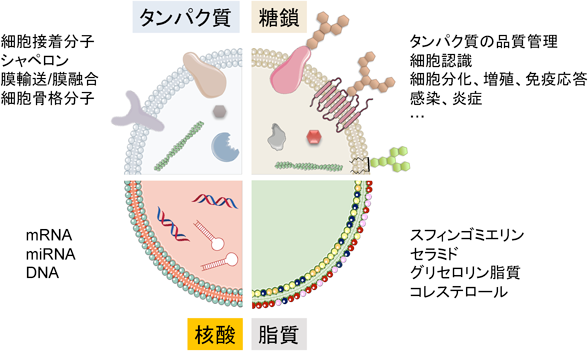
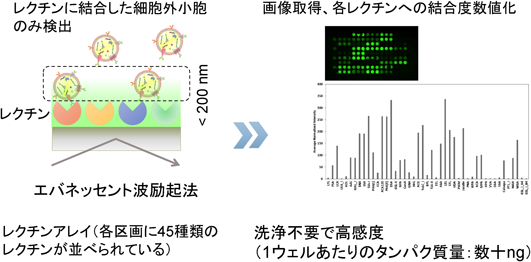
細胞外小胞・エクソソームのグライコミクスGlycomics of extracellular vesicles, exosomes
京都大学工学研究科Department of Polymer Chemistry, Graduate School of Engineering, Kyoto University ◇ 〒615–8510 京都府京都市西京区京都大学桂 京都大学工学研究科高分子化学専攻 ◇ Kyoto daigaku-katsura, Nishikyo-ku, Kyoto 615–8510