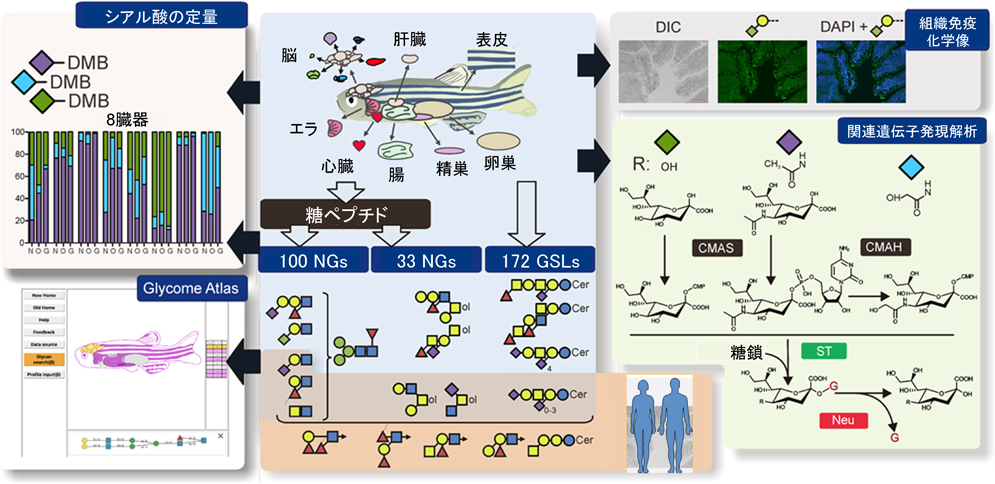
1)システムグライコミクスの必要性と課題
脊椎動物のゲノム遺伝子の1~2%が,さまざまな生物学的現象において役割を担う糖鎖の生合成と分解に関与する遺伝子からなると考えられている.中でも,脊椎動物においてシアル酸代謝には数多くの酵素が存在する13).たとえば,核とサイトゾルを往来するCMP-シアル酸合成酵素(CMAS)14),サイトゾルに存在するUDP-N-アセチルグルコサミン(GlcNAc)2-エピメラーゼ/N-アセチルマンノサミンキナーゼ(GNE),サイトゾル局在シチジン一リン酸(CMP)-N-アセチルノイラミン酸水酸化酵素(CMAH),CMP-シアル酸トランスポーター(SCL35A1),ゴルジ体局在シアル酸転移酵素(ST),シアリダーゼ(Neu)である.したがって,糖鎖の合成,輸送,寿命,局在のいずれかに不全が起こってもさまざまな病態につながる可能性を秘めている.実際,ゼブラフィッシュは,近年,基礎生物学のモデル生物としてだけでなく,中枢神経系の発生,軟骨形成,筋ジストロフィー,骨疾患,神経筋接合部疾患,神経皮膚症候群,炎症性腸疾患など糖鎖が関与する病気の検証実験にも利用されている15–22).同時に,ゼブラフィッシュの器官形成における革新的なin vivoイメージング技術も開発され,糖鎖の生合成と動態に関する新たな知見が得られるようになった23–25).
現在,糖鎖が関わるヒトの病理研究にゼブラフィッシュの利用が増加している.一方で,ゼブラフィッシュの成体臓器のグライコームおよびその決定因子に関する全体像は欠如しており,より意味のある分子機構の理解が得られていない.これまでゼブラフィッシュの胚と卵巣のグライコームが解明された他にはその知見は限定されている8–12).たとえば,ルイスX[Galβ1-4(Fucα1-3)GlcNAc],モノ・ジシアリル化T抗原[±Neu5Acα2-3Galβ1-3(Neu5Acα2-6)GalNAc]のようなヒトと共通な糖鎖エピトープだけでなく,Galβ1-4(Neu5Ac/Gcα2-3)Galβ1-4(Fucα1-3)GlcNAcおよびO-グリカンFucα1-3GalNAcβ1-4(Neu5Ac/Gcα2-3)Galβ1-3GalNAcのような種特異的構造が合成されることが明らかにされてきた.しかし,これらの糖鎖の形成過程に関わる遺伝子の情報は十分ではなかった.重要なことに,種特異的な遺伝子重複あるいは硬骨魚類に起こった3回目の遺伝子重複のために,ゼブラフィッシュにはヒトに比べてより多くのパラログ遺伝子が存在する.たとえば,STはヒトでは20種類であるのに対して,ゼブラフィッシュでは30種類もの遺伝子が存在する26, 27).すなわち,ST3Gal1A, ST3Gal1B, ST3Gal1C, ST3Gal1Dのように種特異的重複28),あるいはST6Gal2-r, ST3Gal3-r13, 28)のように3回目の重複によって増加したものもあれば,ST3Gal6のように消滅したものもある28).
糖鎖の機能研究を目的として,遺伝子操作によって糖鎖構造を適切に改変するためには,糖鎖構造とその形成に関わる糖鎖遺伝子との関係をきちんと理解する必要があり,ゼブラフィッシュの成体において臓器特異的な複合糖質パターンと酵素発現を系統的に調べることを開始した.図2にゼブラフィッシュのシステムグライコーム分析の流れを示す.
2)糖タンパク質糖鎖と糖脂質(GSLs)の調製
ゼブラフィッシュの成体から,表皮,肝臓,エラ,脳,腸,心臓,精巣,卵巣の8種類の臓器・器官を切り出し,速やかにN-グリカン(NGs),O-グリカン(OGs),糖脂質(GSLs)画分を調製した.具体的には,解剖により得た組織を水に懸濁して,ホモゲナイズし,凍結乾燥した.乾燥標品から一連のクロロホルム/メタノール抽出によって糖脂質を抽出し,糖脂質画分(GSLs)とした.その残渣をTris-HCl溶液に懸濁し,何段階かの操作を経て糖タンパク質を可溶性成分として得た.還元アルキル化した後,凍結乾燥した粉末に対してTPCK(tosylphenylalanyl chloromethyl ketone)処理したトリプシン消化,さらにキモトリプシン消化して粗ペプチド画分を得,さらにC18 Sep-Pakカラムにかけて,プロパノール溶出画分を得た.さらにペプチド:N-グリカナーゼ消化を行い,遊離されたN-グリカンはC18 Sep-Pakカラムによって精製した(NGs).さらに,ペプチド画分は,アルカリ-ボロヒドリド処理によってβ脱離反応を行い,O-グリカンを遊離させた(OGs).糖脂質画分は,クロロホルム/メタノール中で0.1 M NaOH処理して脱O-アシル化した.なお,遊離した糖鎖はMSとMS/MS分析によって同定および半定量を行った.並行して,各糖鎖の中のNeu5Ac, Neu5Gc,デアミノノイラミン酸(Kdn)のシアル酸量の比率を決定した.また,糖鎖遺伝子の発現パターンの解析も行った.
3)糖鎖の構造解析
調製した各NGs, OGs, GSLsは完全メチル化した後29),4800 MALDI TOF/TOF Analyzer mass spectrometer(AB Sciex)を用い,reflectronポジティブモードによってMALDI-TOFおよびMALDI-TOF/TOFスペクトルを測定した.試料は1 µLオリゴ糖溶液(1~5 pmol)を2,5-ジヒドロキシ安息香酸マトリックス溶液1 µLと混合して調製した.糖鎖を含むシグナルが得られたものはすべて,MALDI-TOF/TOF質量分析機上で衝突誘起解離(CID)を行って断片化して解析した.たいていの場合には,以上の方法で糖鎖構造が推定された.しかし,異性体が数種含まれる場合には,さらに特異的な酵素消化,HPLCによるオリゴ糖鎖の分離,GC/MSによる結合位解析,特異的抗体による反応性解析を行うことによって決定した9–11).各オリゴ糖の存在比率は,3回の独立した実験で得られるシグナルから求めた30).
4)データの公開
同定されたすべてのNGs, OGs, GSLsの構造データは,Linear Code-like formatに変換してGlycome Atlas(http://www.rings.t.soka.ac.jp/GlycomeAtlasV5/index.html)に搭載されている31).誰でもウェブサイトにおいて無料で利用することができる.このウェブサイトでは,ゼブラフィッシュの各臓器の位置を示す模式図が掲載されており,知りたい臓器をクリックすると,その臓器の糖鎖構造を参照することができる.
1)シアル酸について
Neu5Ac, Neu5Gc, Kdnの3種類のシアル酸分子種がすべて発現しており,臓器によってその量も種類も大きく異なる.全シアル酸量は腸と卵巣では高く,それぞれ22.1と41.1 nmol/mgタンパク質であり,その他の臓器では0.6~7.8 nmol/mgタンパク質である.このことから,シアル酸合成とシアル酸残基形成の制御は臓器によって異なることがわかる.また,腸においてKdnが全シアル酸の60~85%を占めており特徴的である.脳においては,どの生物種もNeu5Gcがほとんどないといわれているが,ゼブラフィッシュでは全シアル酸の1~9%にも及んでいた.腸と脳のシアル酸を含む糖鎖の詳細については後述する.
2)グライコーム解析
8種類の臓器のグライコーム解析によって,N-グリカン(NGs),O-グリカン(OGs),糖脂質(GSLs)がのべ249, 69種類,286種類検出された.いくつかの臓器にまたがって存在する糖鎖構造もあれば,臓器に特異的なものもある.NGsについては,95種類の複合型と混成型を含む100種類が,OGsについては33種類の異なる構造が同定された.GSLsについては172種類の異なる構造が同定され,その中で52種類の糖鎖については異なるセラミド構造に結合して存在していた.
a.N-グリカン(NGs)
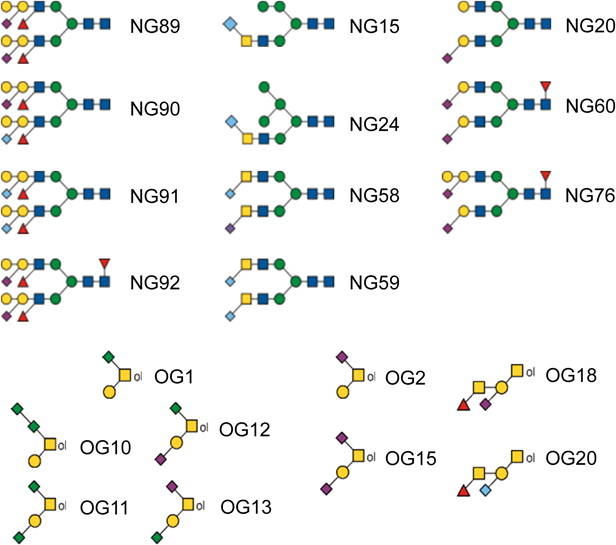
ゼブラフィッシュのNGsについて,100種類のNGsが同定され,その内訳はオリゴマンノース型,混成型,複合型がそれぞれ5種類,9種類,86種類であった.8種類の臓器から単離したNGsのMALDI-MSスペクトルの比較から,組織特異性がみえてきた.複合型/オリゴマンノース型比は5%(卵巣)から66%(エラ)と大きく異なる.構造不均一性の大きさも異なる.肝臓では9種類,エラでは46種類になる.どの臓器にも共通に存在するNGsはNG89, NG90, NG91の3種類であった(図3).これらは,コアフコースを持たない二本鎖にゼブラフィッシュに特有な構造Galβ1-4(Neu5Ac/Gcα2-3)Galβ1-4(Fucα1-3)GlcNAcが存在し,Neu5Ac/Neu5Gc比がNG89では2 : 0, NG90では1 : 1, NG91では0 : 2である.対照的に,表皮ではコアフコースを持つNG89(NG92)のみが見いだされた.
臓器を問わずゼブラフィッシュではほとんどのNGsはFuc残基を持つが,コアフコース型かLeX型フコースかはずいぶんと異なる.たいていの臓器ではNGsの40~60%はコアフコースを持ち,50~70%はLeX構造を持つ.脳ではコアフコースが顕著である.一方,NGs上のシアル酸残基は,3-1)項で議論したように,その量も種類も臓器によって異なる.注意すべきことは,MALDI-MSおよびMS解析においては,分子量が大きくシアル酸含量の高い糖鎖になるとイオン化されにくいため定量性に欠け,過小評価されがちである点である.現状では化学標識DMB(1,2-ジアミノ-4,5-メチレンジオキシベンゼン)化によるシアル酸定量がより信頼できる.
NGsにおいてシアル酸は,±Galβ1-4(Neu5Ac/Gcα2-3)Galβ1-4(±Fucα1-3)GlcNAcモチーフにおける糖鎖内部Gal残基にα2-3結合するものが圧倒的に多い.このゼブラフィッシュに特徴的な構造中のα2-3結合は,我々の手法ではMS/MS解析だけではα2-6結合との区別がつかないため,メチル化-GC/MS解析によって結合位置の決定を行った.Hanzawaらは,その体積の大半を占める卵黄を除去した初期胚には主としてα2-6結合シアル酸を持つN-グリカンが存在すること,また,そのα2-6結合シアル酸は受精後6時間から48時間の発生過程で減少し,その後,α2-3結合シアル酸が増加することを報告している12).一方,我々も同様に卵巣においてLacdiNAcのGalNAc上にα2-6結合シアル酸残基を持つ糖鎖を見いだしており(NG15, NG24, NG58, NG59)(図3),また,胚から成体に向けて全シアル酸量の減少と,α2-6結合からα2-3結合への結合様式シフトも見いだしている.また,このシアル酸の量的および結合様式シフトは,卵巣だけでなく種々の臓器でも起こっていることが明らかになった(NG20とNG60;図3).なお,NGsにおいてはNeu5AcとNeu5Gcに比べてKdnは極度に少ない.
ゼブラフィッシュのN-グリカンは,タイプ2 LacNAc(Galβ1-4GlcNAc)構造をアンテナ鎖として,そのGlcNAc上にFucα1-3が,さらにGal上にSiaα2-3が連結し,哺乳類糖タンパク質と共通のLeXとSLeXエピトープをもつ.ゼブラフィッシュではその構造にさらに非還元末端Galβ1-4残基が連結する,ヒトや哺乳類ではみられない構造が形成される.また,数種の臓器でGalNAcβ1-3/4GlcNAcをアンテナ鎖に,シアル酸残基が連結する構造が見いだされる(特に卵巣,精巣,表皮において顕著).GalNAcβ1-4GlcNAcはLacdiNAcと呼ばれ,無脊椎動物では共通に頻繁にみられるが32–35),ヒトでは数多くのがんの診断マーカーになるかもしれない36, 37).
b.O-グリカン(OGs)
8種類の臓器から33種類のムチン型O-グリカンが,完全メチル化誘導体のMSとMS/MS分析によって同定された.O-Man, O-Fuc,あるいはO-Glcのようなムチン型以外のO-グリカンは微量と思われ検出されなかった.主要構造は,ヒトを含む哺乳類でも広く存在するコア1(Galβ1-3GalNAc)とコア2[Galβ1-3(GlcNAcβ1-6)GalNAc]であり,コア3(GlcNAcβ1-3GalNAc)とコア4[GlcNAcβ1-3(GlcNAcβ1-6)GalNAc]は極微量成分であった.また,ヒトではみられないゼブラフィッシュ特有の構造として,GalNAcβ1-4Galβ1-3GalNAc構造が精巣と卵巣に大量に存在し,N-グリカンにも共通なGalβ1-4Galβ1-4(Fucα1-3)GlcNAc配列が同定された.
OGsの構造にはNGsよりさらに高度に組織特異性がある.Fuc残基の存在率は脳の20%から卵巣の80%まで多様であり,各臓器において厳密なフコース修飾制御が示唆される.全組織を通じて,OGs上で最も広く存在するシアル酸はNeu5Acである.ただし,卵巣ではNeu5Gcが優性であった.Kdn含有糖鎖は腸において5種類のコア1 OGs(OG1, OG10, OG11, OG12, OG13)が同定された(図3).特徴的な点は,NGsに比して構造多様性が低いにもかかわらず,OGsには全組織共通の構造が存在しないことである.最も共通な構造は,7種類の臓器で見いだされたGalβ1-3(Neu5Acα2-6)GalNAc(OG2)とNeu5Acα2-3Galβ1-3(Neu5Acα2-6)GalNAc(OG15)である(図3).また,初期胚における主要構造はコア1 OGs(OG18, OG20;図3)に限定されるのに対して,成体臓器では全体として大きな構造多様性を示した.興味深いことに,卵巣のO-グライコームは,受精後1時間後の胚ととてもよく似ていた.胚においては,上記の2種類の他に,LeXが伸長したコア2糖鎖とオリゴシアル酸化されたコア2糖鎖でNeu5Gc残基によって置換された構造が同定された.これらの希少OGs構造はほとんどが胚そのものではなく,囲卵腔に局在する可溶性複合糖質を修飾している10).
c.糖脂質(GSLs)
すべての臓器において,グルコシル(ガラクトシル)セラミド(Hex-Cer),ラクトシルセラミド(Lac-Cer)が全糖脂質のおよそ80%を占めていた.それ以外の複雑な構造を持つ糖脂質(GSLs)についても,脊椎動物の既知のGSLs糖鎖の生合成経路およびMS/MS解析結果に基づいて構造の帰属を行い,46種類のガラシリーズ(Galβ1-1′Cer),20種類のヘマトシリーズ(Galβ1-4Glcβ1-1′Cer),1種類のラクト/ラクトネオシリーズ(Galβ1-3/4GlcNAcβ1-4Galβ1-4Glcβ1-1′Cer),49種類のラクトガングリオシリーズ[GlcNAcβ1-3(GalNAcβ1-4)Galβ1-4Glcβ1-1′Cer],56種類のガングリオシリーズ(GalNAcβ1-4Galβ1-4Glcβ1-1′Cer)のGSLsが同定された.これら172種類のGSLsは52種類の異なる糖鎖構造と多様なセラミド構造からできている.
GSLsは糖鎖とセラミドの両者において臓器特異性が高い.スフィンゴイド塩基については,d18 : 1スフィンゴシンは全組織の主要成分であった.その他の種類についても,t18 : 0ファイトスフィンゴシンは表皮,肝臓,腸,精巣,卵巣に,d18 : 0スフィンガニンは表皮と精巣に見いだされた.MS/MS分析から,d18 : 1/C16 : 0およびd18 : 1/C24 : 0の組合わせを持つセラミドは,脳以外では広く存在するセラミド種であった.脳では,ほとんどのセラミドはd18 : 1/C18 : 0の他と違う種類の組合わせであった.糖鎖部分も糖脂質シリーズ,フコース残基の存在率,シアル酸の種類の違いによって高い臓器特異性があった.GSLの種類も臓器により異なり,肝臓の27種類から卵巣の43種類まで検出され,糖脂質シリーズの種類も異なっていた.ラクトガングリオシリーズは卵巣で60%以上を占めるが,脳や心臓では存在せず,他の臓器も20%程度である.GSLsにおけるフコース残基の存在率はNGsやOGsに比べてさらに臓器特異性が高い.脳は0%であるのに対して卵巣では40%を占めた.また,各臓器におけるシアル酸種の分布については,NGsやOGsとほぼ同等でNeu5Acが圧倒的に多かった.GSLsがNGsやOGsと唯一異なる臓器は卵巣であり,NGsとOGsではNeu5Gcが多いのに対して,GSLsではNeu5Acであった.また,NGsやOGsでも観測されたように,腸ではKdn含有糖脂質が検出されるが,腸のGSLsは唯一Kdnが極端に多いという特徴があった.
3)臓器シアロームとシアル酸代謝関連遺伝子発現
ゼブラフィッシュのグライコームにシアル酸が頻繁に登場することから,その生合成と分解に関わる遺伝子発現に着目した.シアル酸を含む糖鎖にのみ着目するグライコームは,特にシアロームと呼ばれる.シアローム解析はシアル酸代謝関連遺伝子のトランスクリプトームとの関係を検証することにもつながる.まず,データーベース上でシアル酸転移酵素(ST)遺伝子,シアリダーゼ(neu),CMP-Neu5Ac合成酵素(cmas),CMP-Neu5Ac水酸化酵素(cmah)27, 38)を検索すると,11種類のα2,6-ST(st6galとst6galnac),10種類のα2,3-ST(st3gal),7種類のα2,8-ST(st8sia),2種類のCMAS(cmas1とcmas2),7種類のシアリダーゼ(1種類のneu1, 5種類のneu3, 1種類のneu4),1種類のcmahが見つかったので,実際にRT-PCRによって発現レベルを調べた.最近報告されたα2,3-STであるst3gal1関連遺伝子(st3gal1Cとst3gal1D)とst3gal328),膜結合性シアリダーゼneu439)の発現は検出限界以下であった.一方,シアリダーゼ遺伝子neu3.5とneu139),硬骨魚特異的st3gal3-r28),2種類のCMAS遺伝子とCMAH遺伝子は全臓器に発現していた.GMs合成酵素遺伝子(st3gal5)は全臓器で発現しており,GM3とGM2の存在と一致する.また,GD3合成酵素とGT3合成酵素(それぞれSAT-IIとSAT-Vとも呼ばれる)遺伝子st8sia1とst8sia5は脳に限局された発現が認められ,脳におけるジ/オリゴシアル酸を含むGSLsの存在と一致している.また,心臓に見いだされるモノα2-3-シアル酸含有コア1構造(OGs)は,st3gal1関連遺伝子がまったく発現していないことからST3Gal II活性によって生ずると推定された.腸において,モノおよびジシアル酸含有OGs糖鎖構造は,腸において高発現しているST6GalNAc IA, ST6GalNAc IB, ST3Gal IAの酵素活性により形成が担われていることが推定された.さらに,OGs上のジシアル酸エピトープは腸,脳,心臓でも同定されており,これらはおそらくマウスとヒトでも報告されているST8Sia VI酵素活性によって形成されると思われる40, 41).
1)腸のシアローム
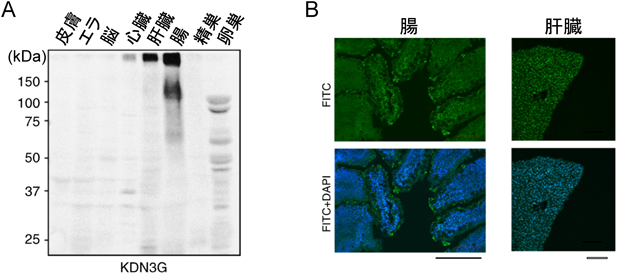
臓器グライコーム解析を行った結果,予想すらしていなかった顕著な特徴が明らかになってきたが,その中で最も驚くべきことは,腸における顕著なKdnの存在である.Kdnα2-3Gal特異的なモノクローナル抗体KDN3Gによるウェスタンブロッティングでは,125 kDa付近と250 kDaを超える領域に2種類の強いブロードなスメアが検出された(図4A).肝臓と心臓にも弱いながら同様の染色像が得られたが,腸の染色性ははるかに強い.腸にはムチン様タンパク質が存在し,これらはきわめて大きく,ウェスタンブロッティングの分離ゲルに入ってこなかった.KDN3Gによる免疫組織染色では,ゼブラフィッシュの腸の内腔側に並んでいる上皮細胞の表面に点状粒子として観察された(図4B).この観察は腸の粘膜に存在するムチンタンパク質の存在と矛盾しない.しかし,Kdn残基はムチン型OGs上だけでなく,NGsやGSLsにも存在することから,KDN3GはN-グリカンと糖脂質も検出していると考えられる.腸上皮細胞に比べて,肝臓細胞表面もまんべんなくKDN3Gエピトープが観察されることから,Kdn残基は必ずしもムチン様分泌タンパク質上に存在するわけではないと思われる.
質量分析,シアル酸分析,ウェスタンブロッティング,免疫組織染色を総合的に考慮すると,腸は相当量のKdnを含む唯一の臓器であるといえる.腸の内腔側は相当量のシアル酸が含まれ,個体差は大きいものの乾燥重量あたりNeu5Acは3 pmol/mg, Neu5Gcは5 pmol/mg, Kdnは37 pmol/mgに及ぶ.腸は食物分解物が通過し吸収される場であり微生物共生の場でもある.その由来を探るために,まず餌を調べたところ,餌にはKdnは含まれなかった.次に,糞をNycodenz密度勾配遠心法42)で分離してKdnの存在量を調べたところ,Kdnは不溶性の餌の残渣ではなく,微生物叢画分に存在することが明らかになった.微生物叢画分において,おそらく遊離のKdnというよりもKdn含有多糖として存在すると思われ,この微生物叢ではKdnを合成していることが示唆される.この関連で,最近,腸内共生細菌Bacterioides thetaiotaomicronがKdnを新生し,莢膜多糖上に転移することが報告されており興味深い43).一方,OGs, NGs, GSLsに見いだされたKdn含有糖鎖は紛れもなくゼブラフィッシュに特徴的な構造である.すなわち,腸における多量のKdnの由来は,腸内腔に存在するKdnを上皮細胞が直接取り込んで,ゼブラフィッシュの糖鎖として組み込む省エネルギーシステムによって存在していると考えられる.腸壁を通ってシアル酸が吸収除去されるという報告は数多く44),腸組織にKdnが偏在する理由が説明できる.しかし,腸内細菌由来のKdnは,上皮細胞の種々ある成分の中のムチン型複合糖質の形成に再利用される過程で,腸内グライコーム全体にも直接的に影響を及ぼすという仮説が立てられる.あるいは,Kdnは細胞外の細菌由来シアル酸転移酵素によって細胞外複合糖質上に転移されるかもしれないが,Neu5Ac含有糖鎖とKdn含有糖鎖の構造が同一であることを考えると,内在性酵素の働きによって転移されていると考えるのが妥当である.腸管に存在するKdnは二次的に血流にのって他組織,特に肝臓に運ばれて複合糖質代謝に利用されることも考えられる.この考えを補足する事実として,ゼブラフィッシュには2種類のCMASが発現している事実がある.Otocephalaクレードの硬骨魚のゲノムには2種類のCMASホモログが存在し,ゼブラフィッシュにはdreCmas1とdreCmas2が存在する.dreCmas1はすべての臓器において恒常的に発現しており,Neu5Acに対する活性が高いのに対して,dreCmas2はKdnを優先利用できる性質を持ち,その発現も腸,肝臓,表皮において高く,卵巣,脳,心臓ではほとんど発現していない.興味深いことに,これらの臓器ではKdn複合糖質の発現が顕著に高い.以上のことから,Kdn残基の存在量が腸において特に高い唯一の理由とはならないが,少なくともKdn基質の存在がKdn特異的Cmasの発現を高めると考えることができる.興味深いことに近年報告されたst3gal5関連遺伝子st3gal728)はGM4合成酵素遺伝子45)に相当するが,この発現は上記Kdn特異的CMAH(dreCmas2)と同じパターンを示す.この酵素もGalCerのGal残基上にKdnを転移することが示唆される.
2)脳のシアローム
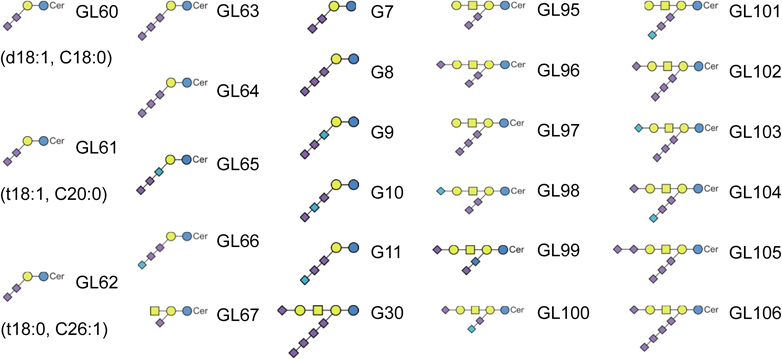
脳のグライコームにもシアル酸修飾に関してきわだった特徴がみられる.まず,多量のオリゴシアル酸構造が存在することである.GSLsの約90%はシアル酸含有脂質であり,75%はジ,トリ,テトラシアル酸エピトープを持つ.これらのエピトープは,ヘマトシリーズのLac-Cerコア(GL60~66, G7~11;図5)あるいはガングリオシリーズ3糖の内部Gal残基に結合している(GL95~106).新たにGP1d(GL106, G30)まで見いだされた(図5).ガングリオシリーズGSLsは脊椎動物脳の主要糖脂質であることはよく知られているが,ヒトを含む哺乳類脳のガングリオシドにおいては,GM1, GD1a, GD1b(GL95),GT1b(GL96, GL98~100)のように1~3シアル酸残基を持つものが主要であるのに対して,ゼブラフィッシュ脳ではGT1b(GL96, GL98~100),GT1c(GL97, GL101),GQ1c(GL104, GL104),GP1d(GL106)のように3~5シアル酸残基を持つものが主要であった.この高度にシアリル化されるという特徴はタラ,エイ,サメの脳にも共通である46–48).GSLs同様,脳由来OGsのほとんどはシアリル化されており,シアル酸を4残基持つ構造も見いだされた.脳にはコア1構造Galβ1-3GalNAcに対するシアリル化がほとんどであるが,GalNAc残基のC6位にNeu5AcまたはNeu5Gcが存在したり,Gal残基のC3位に1~2シアル酸残基が存在したり,さらにはSiaα2-6GalNAcのSiaのC8位にシアル酸残基が存在することで多様な構造が生み出されていた.すなわち,脳は最も多様なSTが発現する唯一の臓器であり,st6galnac遺伝子メンバーのすべての8種類とst6gal遺伝子の3種類が発現していた.この多様なST遺伝子発現はOGsのほとんどがシアル酸残基を持つ基盤である.同様に,GD3とGT3のシアル酸鎖の伸長に関わるといわれているST8Sia1とST8Sia3の発現は脳に限局されており,ジ,トリ,テトラシアル酸エピトープをもつガングリオシドが脳に特異的であることと符合する.ところで,ポリシアル酸構造については,神経細胞接着分子(NCAM)上における存在とその生合成に関与するst8sia2とst8sia4遺伝子の発現は,以前のニジマス脳での証明と同様に49),ゼブラフィッシュにおいても証明された.その存在は免疫化学的にも証明されている50).しかし,その質量分析による存在証明は今回の分析技術の限界からできていない.
次に,ゼブラフィッシュ脳のシアロームの特徴としてNeu5Gcの存在があげられる.Neu5Gcは脊椎動物脳においてごく微量にしか発現しないことが知られているが,神経系における発現について議論の余地がある51).ゼブラフィッシュ脳でもNeu5Gcは他臓器に比べると最小レベルであるものの,全シアル酸に対してGSLsでは1%,OGsでも8%は存在した52).その原因は,すでに報告があるように53),脳におけるCMAHの発現が他の臓器に比べて低いことにある.CMAHの発現は低いもののNeu5Gcは無視できない量であり,Neu5Gc含有シアロ糖鎖の存在も明らかである.特に,主要な3種類のNGsに存在するいわゆるゼブラフィッシュエピトープGalβ1-4(Neu5Ac/Gcα2-3)Galβ1-4(Fucα1-3)GlcNAc(NG89~91;図3)と数種類のガングリオシドにおける存在(GL98~99, GL101, GL103, 104;図5)は明白である.ガングリオシドGT1(GL96~GL101)やGP1(GL105, GL106)のMS/MS開裂パターンをみると,随所にNeu5AcがNeu5Gcに置換されている構造が観測された.さらに他の生物のガングリオシドにおいてもNeu5Gcを持つガングリオシドの存在は証明されており,脳におけるNeu5Gc含有糖鎖の存在は疑う余地はない38, 54, 55).興味深い点は,Neu5Gcの発現部位が血管内皮細胞や血球細胞ではなく神経細胞であることである.まず,Neu5GcとNeu5Acは同じ糖鎖構造に対して同じ様式で結合しており,神経組織に特異的なオリゴシアル酸含有ガングリオシドもその特徴を持っている.すなわち,Neu5Gc-GSLsとNeu5Ac-GSLsが同一のコア糖鎖を持つだけでなく,脂質組成も脳特異的セラミド構造を持っていた.以上のことから,脳神経組織におけるNeu5Gcは今後,構造および機能的にも注目するべきポイントになると思われる.
最後に,脳内の異なる部位(嗅球,終脳,視蓋,小脳,延髄,視床下部)56)での脳部位特異的グライコームの差異をNGsについて調べると,まず,各部位においてNeu5Gcは1%以下である.しかし,部位特異的なNGsのグライコームは見いだされず,小脳以外では複合型糖鎖の比率が高い.小脳ではオリゴマンノース型の比率が複合型より高い.脳の各部位を通じて,フコースが遍在しているという特徴は変わらない.どの部位についても,全脳の分析結果と同様に,主要な複合型NGsのほとんどがコアフコースを持っている.NG76(図3)は,その存在率は脳部位によって異なるものの脳内NGsの主要成分であった.Neu5Gcを持つNG90とNG91(図3)は脳のどの部位にも存在するが,嗅球では特に顕著であった.
引用文献References
1) Westerfield, M. (2007) The Zebrafish Book: A guide for the laboratory use of zebrafish (Danio rerio), 5th Edition, University of Oregon Press, Eugene.
2) Kinoshita, M., Murata, K., Naruse, K., & Tanaka, M. (2009) Medaka: Biology, Management, and Experimental Protocols, Willey-Blackwell, Print ISBN: 9780813808710; Online ISBN: 9780813818849
3) Tonoyama, Y., Anzai, D., Ikeda, A., Kakuda, S., Kinoshita, M., Kawasaki, T., & Oka, S. (2009) Essential role of β-1,4-galactosyltransferase 2 during medaka (Oryzias latipes) gastrulation. Mech. Dev., 126, 580–594.
4) Anzai, D., Tonoyama, Y., Ikeda, A., Kawasaki, T., & Oka, S. (2009) Regulated expression of the HNK-1 carbohydrate is essential for medaka (Oryzias latipes) embryogenesis. Glycobiology, 19, 868–878.
5) Avsar-Ban, E., Ishikawa, H., Manya, H., Watanabe, M., Akiyama, S., Miyake, H., Endo, T., & Tamaru, Y. (2010) Protein O-mannosylation is necessary for normal embryonic development in zebrafish. Glycobiology, 20, 1089–1102.
6) Moore, C.J., Goh, H.T., & Hewitt, J.E. (2008) Genes required for functional glycosylation of dystroglycan are conserved in zebrafish. Genomics, 92, 159–167.
7) Yamakawa, N., Vanbeselaere, J., Chang, L.-Y., Yu, S.-Y., Ducrocq, L., Harduin-Lepers, A., Kurata, J., Aoki-Kinoshita, K.F., Sato, C., Khoo, K.-H., et al. (2018) Systems glycomics of adult zebrafish identifies organ-specific sialylation and glycosylation patterns. Nat. Commun., 9, 4647.
8) Takemoto, T., Natsuka, S., Nakakita, S.-I., & Hase, S. (2005) Expression of complextype N-glycans in developmental periods of zebrafish embryo. Glycoconj. J., 22, 21–26.
9) Guérardel, Y., Chang, L.-Y., Maes, E., Huang, C.-J., & Khoo, K.-H. (2006) Glycomic survey mapping of zebrafish identifies unique sialylation pattern. Glycobiology, 16, 244–257.
10) Chang, L.-Y., Mir, A.M., Thisse, C., Guérardel, Y., Delannoy, P., Thisse, B., & Harduin-Lepers, A. (2009) Developmental regulation of oligosialylation in zebrafish. Glycoconj. J., 26, 247–261.
11) Vanbeselaere, J., Vanbeselaere, J., Chang, L.-Y., Harduin-Lepers, A., Fabre, E., Yamakawa, N., Slomianny, C., Biot, C., Khoo, K.-H., & Guerardel, Y. (2012) Mapping the expressed glycome and glycosyltransferases of zebrafish liver cells as a relevant model system for glycosylation studies. J. Proteome Res., 11, 2164–2177.
12) Hanzawa, K., Suzuki, N., & Natsuka, S. (2017) Structures and developmental alterations of N-glycans of zebrafish embryos. Glycobiology, 27, 228–245.
13) Teppa, R.E., Petit, D., Plechakova, O., Cogez, V., & Harduin-Lepers, A. (2016) Phylogenetic-derived insights into the evolution of sialylation in Eukaryotes: comprehensive analysis of vertebrate β-galactoside α2,3/6-sialyltransferases (ST3Gal and ST6Gal). Int. J. Mol. Sci., 17, E1286.
14) Fujita, A., Sato, C., & Kitajima, K. (2007) Identification of the nuclear export signals that regulate the intracellular localization of the mouse CMP-sialic acid synthetase. Biochem. Biophys. Res. Commun., 355, 174–180.
15) Song, Y., Willer, J.R., Scherer, P.C., Panzer, J.A., Kugath, A., Skordalakes, E., Gregg, R.G., Willer, G.B., & Balice-Gordon, R.J. (2010) Neural and synaptic defects in slytherin, a zebrafish model for human congenital disorders of glycosylation. PLoS One, 5, e13743.
16) Bentrop, J., Marx, M., Schattschneider, S., Rivera-Milla, E., & Bastmeyer, M. (2008) Molecular evolution and expression of zebrafish St8SiaIII, an alpha-2,8-sialyltransferase involved in myotome development. Dev. Dyn., 237, 808–818.
17) Thornhill, P., Bassett, D., Lochmüller, H., Bushby, K., & Straub, V. (2008) Developmental defects in a zebrafish model for muscular dystrophies associated with the loss of fukutin-related protein (FKRP). Brain, 131, 1551–1561.
18) Manzini, M.C., Tambunan, D.E., Hill, R.S., Yu, T.W., Maynard, T.M., Heinzen, E.L., Shianna, K.V., Stevens, C.R., Partlow, J.N., Barry, B.J., et al. (2012) Exome sequencing and functional validation in Zebrafish identify GTDC2 mutations as a cause of Walker–Warburg syndrome. Am. J. Hum. Genet., 91, 541–547.
19) Carss, K.J., Stevens, E., Foley, A.R., Cirak, S., Riemersma, M., Torelli, S., Hoischen, A., Willer, T., van Scherpenzeel, M., Moore, S.A., et al.; UK10K Consortium. (2013) Mutations in GDP-mannose pyrophosphorylase B cause congenital and limb-girdle muscular dystrophies associated with hypoglycosylation of α-dystroglycan. Am. J. Hum. Genet., 93, 29–41.
20) Wiweger, M.I., Avramut, C.M., de Andrea, C.E., Prins, F.A., Koster, A.J., Ravelli, R.B., & Hogendoorn, P.C. (2011) Cartilage ultrastructure in proteoglycan-deficient zebrafish mutants brings to light new candidate genes for human skeletal disorders. J. Pathol., 223, 531–542.
21) Thakur, P.C., Davison, J.M., Stuckenholz, C., Lu, L., & Bahary, N. (2013) Dysregulated phosphatidylinositol signaling promotes endoplasmic reticulum-stress-mediated intestinal mucosal injury and inflammation in zebrafish. Dis. Model. Mech., 7, 93–106.
22) Boccuto, L., Aoki, K., Flanagan-Steet, H., Chen, C.F., Fan, X., Bartel, F., Petukh, M., Pittman, A., Saul, R., Chaubey, A., et al. (2014) A mutation in a ganglioside biosynthetic enzyme, ST3GAL5, results in salt & pepper syndrome, a neurocutaneous disorder with altered glycolipid and glycoprotein glycosylation. Hum. Mol. Genet., 23, 418–433.
23) Dehnert, K.W., Baskin, J.M., Laughlin, S.T., Beahm, B.J., Naidu, N.N., Amacher, S.L., & Bertozzi, C.R. (2012) Imaging the sialome during zebrafish development with copper-free click chemistry. Chembiochem Eur. J. Chem. Biol., 13, 353–357.
24) Laughlin, S.T., Baskin, J.M., Amacher, S.L., & Bertozzi, C.R. (2008) In vivo imaging of membrane-associated glycans in developing zebrafish. Science, 320, 664–667.
25) Dehnert, K.W., Beahm, B.J., Huynh, T.T., Baskin, J.M., Laughlin, S.T., Wang, W., Wu, P., Amacher, S.L., & Bertozzi, C.R. (2011) Metabolic labeling of fucosylated glycans in developing zebrafish. ACS Chem. Biol., 6, 547–552.
26) Harduin-Lepers, A., Vallejo-Ruiz, V., Krzewinski-Recchi, M.A., Samyn-Petit, B., Julien, S., & Delannoy, P. (2001) The human sialyltransferase family. Biochimie, 83, 727–737.
27) Harduin-Lepers, A. (2010) Comprehensive analysis of sialyltransferases in vertebrate genomes. Glycobiol. Insights, 2, 29–61.
28) Petit, D., Teppa, E., Mir, A.M., Vicogne, D., Thisse, C., Thisse, B., Filloux, C., & Harduin-Lepers, A. (2015) Integrative view of α2,3-sialyltransferases (ST3Gal) molecular and functional evolution in deuterostomes: significance of lineage-specific losses. Mol. Biol. Evol., 32, 906–927.
29) Ciucanu, I. & Kerek, F. (1984) A simple and rapid method for the permethylation of carbohydrates. Carbohydr. Res., 131, 209–217.
30) Aoki, K., Perlman, M., Lim, J.M., Cantu, R., Wells, L., & Tiemeyer, M. (2007) Dynamic developmental elaboration of N-linked glycan complexity in the Drosophila melanogaster embryo. J. Biol. Chem., 282, 9127–9142.
31) Konishi, Y. & Aoki-Kinoshita, K.F. (2012) The GlycomeAtlas tool for visualizing and querying glycome data. Bioinformatics, 28, 2849–2850.
32) Sasaki, N., Yoshida, H., Fuwa, T.J., Kinoshita-Toyoda, A., Toyoda, H., Hirabayashi, Y., Ishida, H., Ueda, R., & Nishihara, S. (2007) Drosophila beta 1,4-N-acetylgalactosaminyltransferase-A synthesizes the LacdiNAc structures on several glycoproteins and glycosphingolipids. Biochem. Biophys. Res. Commun., 354, 522–527.
33) Khoo, K.H., Chatterjee, D., Caulfield, J.P., Morris, H.R., & Dell, A. (1997) Structural mapping of the glycans from the egg glycoproteins of Schistosoma mansoni and Schistosoma japonicum: identification of novel core structures and terminal sequences. Glycobiology, 7, 663–677.
34) Sato, T., Gotoh, M., Kiyohara, K., Kameyama, A., Kubota, T., Kikuchi, N., Ishizuka, Y., Iwasaki, H., Togayachi, A., Kudo, T., et al. (2003) Molecular cloning and characterization of a novel human beta 1,4-N-acetylgalactosaminyltransferase, beta 4GalNAc-T3, responsible for the synthesis of N,N′-diacetyllactosediamine, GalNAc beta 1-4GlcNAc. J. Biol. Chem., 278, 47534–47544.
35) Do, K.Y., Do, S.I. II, & Cummings, R.D. (1997) Differential expression of LacdiNAc sequences (GalNAc beta 1-4GlcNAc-R) in glycoproteins synthesized by Chinese hamster ovary and human 293 cells. Glycobiology, 7, 183–194.
36) Kitamura, N., Guo, S., Sato, T., Hiraizumi, S., Taka, J., Ikekita, M., Sawada, S., Fujisawa, H., & Furukawa, K. (2003) Prognostic significance of reduced expression of beta-N-acetylgalactosaminylated N-linked oligosaccharides in human breast cancer. Int. J. Cancer, 105, 533–541.
37) Hirano, K., Matsuda, A., Shirai, T., & Furukawa, K. (2014) Expression of LacdiNAc groups on N-glycans among human tumors is complex. BioMed Res. Int., 2014, 981627.
38) Mikami, T., Kashiwagi, M., Tsuchihashi, K., Daino, T., Akino, T., & Gasa, S. (1998) Further characterization of equine brain gangliosides: the presence of GM3 having N-glycolyl neuraminic acid in the central nervous system. J. Biochem., 123, 487–491.
39) Manzoni, M., Colombi, P., Papini, N., Rubaga, L., Tiso, N., Preti, A., Venerando, B., Tettamanti, G., Bresciani, R., Argenton, F., et al. (2007) Molecular cloning and biochemical characterization of sialidases from zebrafish (Danio rerio). Biochem. J., 408, 395–406.
40) Takashima, S., Ishida, H.K., Inazu, T., Ando, T., Ishida, H., Kiso, M., Tsuji, S., & Tsujimoto, M. (2002) Molecular cloning and expression of a sixth type of alpha 2,8-sialyltransferase (ST8Sia VI) that sialylates O-glycans. J. Biol. Chem., 277, 24030–24038.
41) Teintenier-Lelièvre, M., Julien, S., Juliant, S., Guerardel, Y., Duonor-Cérutti, M., Delannoy, P., & Harduin-Lepers, A. (2005) Molecular cloning and expression of a human hST8Sia VI (alpha2,8-sialyltransferase) responsible for the synthesis of the diSia motif on O-glycosylproteins. Biochem. J., 392, 665–674.
42) Hevia, A., Delgado, S., Margolles, A., & Sánchez, B. (2015) Application of density gradient for the isolation of the fecal microbial stool component and the potential use thereof. Sci. Rep., 5, 16807.
43) Wang, L., Lu, Z., Allen, K.N., Mariano, P.S., & Dunaway-Mariano, D. (2008) Human symbiont Bacteroides thetaiotaomicron synthesizes 2-keto-3-deoxy-D-glycero-D-galacto-nononic acid (KDN). Chem. Biol., 15, 893–897.
44) Bardor, M., Nguyen, D.H., Diaz, S., & Varki, A. (2005) Mechanism of uptake and incorporation of the non-human sialic acid N-glycolylneuraminic acid into human cells. J. Biol. Chem., 280, 4228–4237.
45) Chisada, S., Yoshimura, Y., Sakaguchi, K., Uemura, S., Go, S., Ikeda, K., Uchima, H., Matsunaga, N., Ogura, K., Tai, T., et al. (2009) Zebrafish and mouse alpha2,3-sialyltransferases responsible for synthesizing GM4 ganglioside. J. Biol. Chem., 284, 30534–30546.
46) Nakamura, K., Tamai, Y., & Kasama, T. (1997) Gangliosides of dogfish (Squalus acanthias) brain. Neurochem. Int., 30, 593–604.
47) Nakamura, K., Kojima, H., Suzuki, M., Suzuki, A., & Tamai, Y. (2000) Novel polysialogangliosides of skate brain structural determination of tetra, penta and hexasialogangliosides with a NeuAc-GalNAc linkage. Eur. J. Biochem., 267, 5198–5208.
48) Ando, S. & Yu, R.K. (1979) Isolation and characterization of two isomers of brain tetrasialogangliosides. J. Biol. Chem., 254, 12224–12229.
49) Asahina, S., Sato, C., Matsuno, M., Matsuda, T., Colley, K., & Kitajima, K. (2006) Involvement of the alpha2,8-polysialyltransferases II/STX and IV/PST in the biosynthesis of polysialic acid chains on the O-linked glycoproteins in rainbow trout ovary. J. Biochem., 140, 687–701.
50) Adolf, B., Chapouton, P., Lam, C.S., Topp, S., Tannhäuser, B., Strähle, U., Götz, M., & Bally-Cuif, L. (2006) Conserved and acquired features of adult neurogenesis in the zebrafish telencephalon. Dev. Biol., 295, 278–293.
51) Davies, L.R.L. & Varki, A. (2005) Why is N-glycolylneuraminic acid rare in the vertebrate brain? Top. Curr. Chem., 366, 31–54.
52) Davies, L.R.L., Pearce, O.M., Tessier, M.B., Assar, S., Smutova, V., Pajunen, M., Sumida, M., Sato, C., Kitajima, K., Finne, J., et al. (2012) Metabolism of vertebrate amino sugars with N-glycolyl groups: resistance of α2-8-linked N-glycolylneuraminic acid to enzymatic cleavage. J. Biol. Chem., 287, 28917–28931.
53) Malykh, Y.N., Shaw, L., & Schauer, R. (1998) The role of CMP-N-acetylneuraminic acid hydroxylase in determining the level of N-glycolylneuraminic acid in porcine tissues. Glycoconj. J., 15, 885–893.
54) Nakao, T., Kon, K., Ando, S., & Hirabayashi, Y.A. (1991) NeuGc-containing trisialoganglioside of bovine brain. Biochim. Biophys. Acta Lipids Lipid Metab., 1086, 305–309.
55) Casellato, R., Brocca, P., Li, S.C., Li, Y.T., & Sonnino, S. (1995) Isolation and structural characterization of N-acetyl- and N-glycolylneuraminic-acid containing GalNAc-GD1a isomers, IV4GalNAcIV3Neu5AcII3Neu5Gc GgOse4Cer and IV4GalNAcIV3Neu5GcII3Neu5AcGgOse4Cer, from bovine brain. Eur. J. Biochem., 234, 786–793.
56) Gupta, T. & Mullins, M.C. (2010) Dissection of organs from the adult zebrafish. J. Vis. Exp.