すべての細胞表面を覆い,そしてほとんどのタンパク質を修飾している“糖鎖”は,核酸やタンパク質に続く第三の生命鎖として注目され,ポストゲノム研究として勢力的に進められている.糖鎖と一口にいってもエネルギー貯蔵源であるグリコーゲンのように,多数のグルコースが重合し枝分かれ構造をとったホモポリマーとして存在しているものもあるが,多くの糖鎖は10種類ほどの単糖がさまざまな糖水酸基の位置とαもしくはβ-グリコシド結合を形成しているので膨大な構造多様性を示す.そして一般的にはこのような糖鎖がタンパク質や脂質と結合した複合糖質として存在している.複合糖質は,異なる生合成経路によってN型糖鎖,O型糖鎖,グリコサミノグリカン(glycosaminoglycan:GAG),スフィンゴ糖脂質(glycosphingolipid:GSL)糖鎖などのサブグライコームに分類される.現在では,特異的な糖鎖構造が診断バイオマーカーや細胞表面マーカーとして利用されているものも数多くあるが,そのためには糖鎖一次構造解析が不可欠であった.本稿では,これまでの報告されてきたN型糖鎖解析,O型糖鎖解析,GSL糖鎖解析などのサブグライコーム解析の技術要素と,我々が近年取り組んできた糖鎖解析法を交えながら紹介していく.また,サブグライコームを統合し糖鎖の全体像を把握する“総合グライコーム”や,国内外問わず非常に盛んに行われている質量分析によるシアル酸の結合様式識別法についても紹介したい.
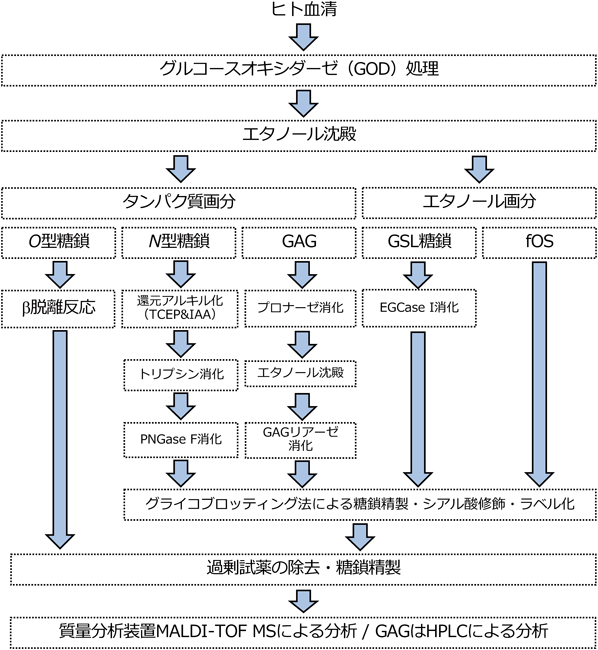
N型糖鎖付加はタンパク質の翻訳後修飾の一つであり,アスパラギン(Asn)残基の側鎖に結合している.結合部位にはAsn-X-Ser/Thr(Xはプロリン以外のアミノ酸)のコンセンサス配列が必要であり,結合しているN型糖鎖は構造によってハイマンノース型,コンプレックス型,ハイブリッド型に大きく分類される.このようなN型糖鎖のタンパク質修飾はタンパク質輸送,分子間相互作用,折りたたみ(フォールディング)や安定性などに重要な役割を果たしている.たとえば,貧血治療タンパク質製剤であるエリスロポエチンにおけるN型糖鎖修飾は赤血球増殖活性や血中における安定性に寄与し,さらに糖鎖の数や糖鎖結合部位が薬理活性に影響を及ぼすことが報告されている1).ヒト血清中における分泌タンパク質も50%以上が糖鎖修飾を受けており,さまざまな疾患を対象としたN型糖鎖の構造解析が数多く報告されている2, 3).門松の稿でも述べられていたが,糖切断酵素であるペプチドN-グリコシダーゼF(peptide N-glycosidase F:PNGase F)が構造解析に大きな威力を発揮する.PNGase F消化により,植物や昆虫などを除くほとんどのN型糖鎖を網羅的に切断することが可能である.このように切断されたN型糖鎖の組成や構造を迅速かつ高感度に解析する技術が求められ,これまでに高速液体クロマトグラフィー(high performance liquid chromatography:HPLC),キャピラリー電気泳動(capillary electrophoresis:CE),質量分析など多くの糖鎖解析技術が開発されてきた.代表的な解析法であるピリジルアミノ化法(PA化)は,切断したN型糖鎖を2-アミノピリジンにより蛍光標識後,陰イオン交換カラム,ODS(オクタデシルシリル)カラム,アミドカラムの3種類のカラムを用いてHPLC分析により糖鎖を分離し,糖鎖溶出時間より2次元あるいは3次元マップを作成し,データベースと照合することで糖鎖構造を同定する方法である4, 5).CEによる糖鎖分析では,生体サンプルに含まれる非常に複雑な糖鎖の分離が報告されており,アルゴンレーザー励起蛍光検出と組み合わせることでfmolオーダーでの糖鎖分析が達成されている6).我々の研究室でもN型糖鎖を対象として,サンプルの前処理法や糖鎖精製・標識法を開発し,MALDI-TOF MS(matrix assisted laser desorption/ionization-time of flight mass spectrometry)解析による網羅的かつ定量的なグライコーム解析に取り組んできた.本稿ではヒト血清を対象としたグライコーム解析を紹介する(図1).はじめに血清をグルコースオキシダーゼによって処理するのだが,これは血清中のGSL糖鎖解析を行うために有用な方法であり次節で詳細を述べたい.次にエタノール沈殿法によって血清から分泌タンパク質を回収している.この操作は血清中に存在する遊離オリゴ糖(free oligosaccharides:N型遊離糖鎖を含むfOS)やGSLを分けるためであり,分画した上清中の遊離オリゴ糖やGSL糖鎖も後述する総合グライコームの一つのサブグライコームとして解析している.エタノール沈殿法では,通常4~9倍量のエタノールを血清に加えてタンパク質を沈殿させるが,エタノールに対して感受性が高いウイルスの不活性化も同時に行うことができる.次にN-グライコーム解析を行うには,エタノール沈殿により調製したタンパク質から糖鎖を切断する必要がある.回収したタンパク質は,一般的な試薬を用いてジスルフィド結合を含むチオール基を還元アルキル化し,さらにトリプシンによる消化を行う.その後PNGase F消化することで効率的にN型糖鎖を切断することができる7).このように調製された溶液には,アルキル化試薬やトリプシン消化ペプチドなどの夾雑物を多く含むため,この中から糖鎖の精製が必要になる.我々は,グライコブロッティング法によって切断したN型糖鎖の精製を行っている.糖鎖還元末端に存在するヘミアセタール(開環した場合にはアルデヒド)基は生体内の他の分子にはほとんど存在しない.そこで糖鎖還元末端に特異的に存在するアルデヒド基に着目し,アルデヒド基と選択的かつ温和な条件でヒドラゾンを形成できるヒドラジド基を高密度に提示した固相担体を用いて糖鎖のみを捕捉する手法を開発し,これをグライコブロッティング法と呼んでいる.固相担体にはN型糖鎖が化学ライゲーションにより選択的に捕捉され,固相担体を徹底的に洗浄することでペプチドや脂質などの夾雑物を除去できる.質量分析装置による糖鎖解析の問題点の一つとして,糖鎖非還元末端に存在するシアル酸がα-グリコシド結合の切断により分析中に脱離してしまうことがあげられるが,問題を解決するためにさまざまなシアル酸の化学修飾法が開発されてきた.関谷らは塩化アンモニウムと縮合剤[4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride:DMT-MM]を用いることでシアル酸のカルボキシ基をアミド化し,アミド化されたシアル酸が質量分析中の脱離抑制に有効であることを報告している8).我々はエステル化剤である1-メチル-3-p-トリルトリアゼン試薬(1-methyl-3-p-tolyltriazene:MTT)を用いることで,固相担体上でのシアル酸のカルボキシ基をメチル化修飾し,中性糖鎖と酸性糖鎖の一斉定量解析法を確立した9).最後は,糖鎖を固相担体から回収する工程になるが,本手法ではオキシムの安定性を利用した高収率な回収を行っている.つまり,ヒドラゾン形成している糖鎖捕捉担体に過剰のアミノオキシ試薬を加えることで,ヒドラゾンからより安定なオキシムへ変換され回収する方法(イミン交換反応)である10).この際に,篠原らが開発した高感度な標識試薬が持つペプチド配列を模倣して11),アミノオキシ基を有する標識試薬aoWR[N-((aminooxy)acetyl)tryptophylarginine methyl-ester]を合成した.aoWR試薬で標識された糖鎖は非標識糖鎖と比較して100倍以上の感度を有し,グアニジノ基の高いプロトン親和性によりプロトン付加分子[M+H]+として検出できる12).グライコブロッティング法は,還元末端が未標識な糖鎖としても回収できる汎用性の高い手法であり,HPLC装置で分析する場合にはPAや2-AB(2-アミノベンズアミド)など目的に応じた試薬で標識することができる.
ここまで述べたようなサンプル前処理や糖鎖の精製・標識の工程を自動で行うことができる糖鎖自動前処理装置の開発も進められている.Stöckmannらは血清からIgGを調製し,IgG上の糖鎖の遊離・精製・標識を全自動で行う装置を開発している13).Marcoらは96検体のヒト血漿N型糖鎖の遊離・精製・標識を約2.5時間,そしてサンプルセットに約1時間,合計3.5時間程度で行うことができるliquid-handling robot systemを開発している14).我々もこれまでに96ウェルプレートをフォーマットとしてサンプル前処理,糖鎖精製そして標識までを行える糖鎖自動前処理装置(SweetBlot)を開発し,網羅的な定量解析を達成している15).後述するが,シアル酸結合様式特異的な修飾法をはじめとする新しい解析技術に対応するためには,装置の改良やアップデートが必要であり開発要素はまだ残されている.その中で自動化技術の構築はさまざまな生体試料や疾患に関連した糖鎖プロファイルの蓄積,そして本特集のキーワードでもあるHuman Glycome Projectにおいても貢献できるであろう.
細胞膜などの生体膜は脂質二重層により構成されており,その主な構成脂質成分はグリセロ脂質とスフィンゴ脂質に大別される.スフィンゴシン塩基を持つ脂質はスフィンゴ脂質と呼ばれており,スフィンゴシン1-リン酸,スフィンゴミエリン,セラミド,そしてセラミドに糖が結合したスフィンゴ糖脂質(GSL)が存在する.GSLグライコームは,バリエーションの違いから数百種類もの糖鎖構造が報告されており,Merrilらが構造ならびに生合成経路を公開しているSphinGOMAP(http://www.sphingomap.org)にアクセスするとその構造の多様性を垣間見ることができる16).GSLは糖鎖構造の他にセラミドの脂肪酸鎖長ならびに二重結合の有無などに起因する膨大な構造多様性を有する.GSLはセラミドより切断した糖鎖と比較するとイオン化効率は高いが,糖鎖と脂質の多様性から生じる膨大な数の分子種が存在するため解析は困難を極める.このような複雑性をクリアする方法の一つは,糖鎖とセラミドを切断することで脂質の多様性を排除し,複雑性が低減したGSL糖鎖を解析することである.GSLから糖切断酵素としてエンドグリコセラミダーゼII(endoglycoceramidase II:EGCase II)が市販されているが,SSEA-3やSSEA-4のようなグロボシド系列の糖鎖に対しては活性が低いことが知られている.我々の研究室では,伊東らが見いだした基質特異性が広い糖切断酵素EGCase Iを用いたGSL糖鎖の解析プロトコルを構築した17, 18).この酵素により切断されたGSL糖鎖は,還元末端にヘミアセタール構造を有するのでN型糖鎖同様にグライコブロッティング法で精製することができる.それでは,本手法を用いた血清中のGSL糖鎖の解析について少し紹介したい.
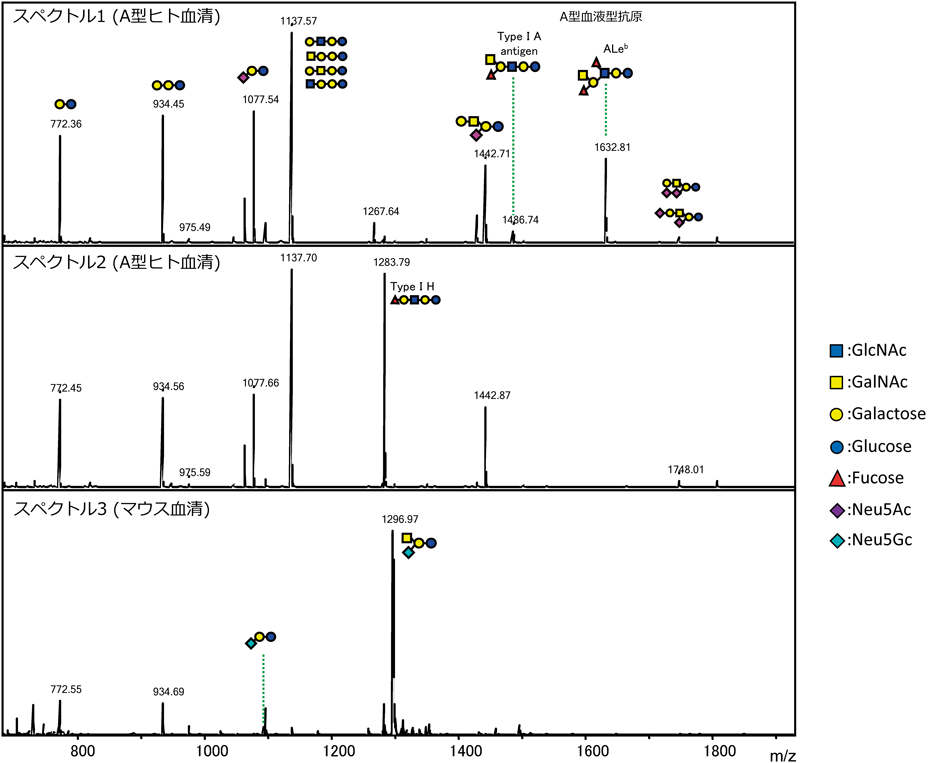
血中におけるGSLの大部分は赤血球に存在しているか,あるいは分泌タンパク質のリポタンパク質上に存在している.しかしGSL糖鎖は糖タンパク質糖鎖と比較するときわめて微量であること,そして3.9~6.1 mmol/Lの血糖(グルコース)の存在が分析を困難にしていた.我々は,グルコースオキシダーゼ(glucose oxidase:GOD)処理により,グルコースがヘミアセタールを持たないD-グルコノ-1,5-ラクトンへと変換され,微量のGSL糖鎖解析を達成している.血清中のGSL糖鎖のスペクトルを図2に示す.スペクトル1と2は両者とも血液型Aのヒト血清中のGSL糖鎖である.スペクトル1ではA型の血液型抗原糖鎖が検出されたが,スペクトル2の検体ではA型の糖鎖エピトープが検出されなかった.これまで血液型Aのヒト血清を10検体測定したが,このGSL糖鎖パターンを示したのはこの1検体のみであった.Lewis式血液型の解析は行っていないが,おそらくスペクトル2の検体は血液型抗原が分泌されない非分泌型(Lea+,Leb−)なのであろう.一方でマウス血清のGSL糖鎖(スペクトル3)では,ほとんどがガングリオシド系列のGM2糖鎖であり,ヒトでみられたGSL糖鎖とは大きく異なっていた.したがって,GSL糖鎖のようにヒトとマウスでまったく異なる発現プロファイルを示す糖鎖サブクラスについては,モデル動物を用いた疾患研究では注意が必要だろう.このようにGSL糖鎖もN型糖鎖と同様に網羅的かつ定量的に解析できるようになった.これまでに特定のGSL糖鎖を対象とした肥満やインスリン抵抗性など代謝性疾患とGSLとの関連が報告されてきたが19, 20),網羅的なGSL糖鎖解析技術がさまざまな疾患とGSL糖鎖の新しい関連を見いだすツールとなり,生命現象の解明に近づけることを期待している.
N型糖鎖と同様にタンパク質に結合しているO型糖鎖はセリン(Ser)やトレオニン(Thr)の水酸基に結合しているが,N型糖鎖のようなコンセンサス配列は存在しないことから,タンパク質の一次配列からO型糖鎖の結合部位を推測することはできない.O型糖鎖はセリンやトレオニンに結合する単糖の種類によって,O-GalNAc型,O-GlcNAc型,O-キシロース型,O-マンノース型,O-フコース型,O-グルコース型,O-ガラクトース型など多くの種類が存在する.なかでもO-GalNAc型はムチンと呼ばれる最も一般的なO型糖鎖であり,GalNAcへ結合する糖鎖やその結合位置の違いによりコア1~8構造に分類される.
それではグライコーム解析に話を戻そう.N型糖鎖はPNGase F消化によりほぼ網羅的に切断できるが,O型糖鎖の場合は広い特異性を持つO-グリカナーゼが見つかっていないため,糖鎖の切断は化学的な手法に強く依存しているといっても過言ではない.水酸化ナトリウムなどの強塩基,アンモニアやアミンによるβ脱離やヒドラジン分解による化学的な切断方法が報告されているが,ピーリング反応と呼ばれる副反応により糖鎖の分解が生じる21, 22).Carlsonらにより報告された還元的β脱離反応は,O型糖鎖の切断と同時に糖アルコールへと還元することで,ピーリング反応を最小限に抑制している23).最近の知見として,糖鎖還元末端のヘミアセタールとの反応性が高いヒドロキシルアミンを加えることでピーリング反応を抑制し,有機強塩基を用いてO型糖鎖を切断する方法も報告されている24).我々も独自のO型糖鎖解析法を開発してきた.ピラゾロン試薬による糖鎖の標識法は本田らにより報告されており25),この反応条件をより塩基性にすることでタンパク質からの切断と標識を同時に行うことが可能となった(BEP法)26).この方法では,アルカリ条件下で切断された糖鎖が直ちにピラゾロン試薬によって標識されるため,糖鎖の還元末端アルデヒド基の存在に起因して起こるピーリング反応を最小限に抑えることができる.また,BEP法では脱グリコシル化されたセリン/トレオニン残基もマイケル付加反応によりピラゾロン試薬を導入できるため,糖鎖とその結合部位の両方を同定できる手法である.本方法でヒトおよびマウスの血清におけるO型糖鎖を解析した.ヒトとマウスではシアル酸の種類こそ異なるが[ヒトはN-アセチルノイラミン酸(Neu5Ac),マウスはN-グリコリルノイラミン酸(Neu5Gc)],O型糖鎖プロファイルは非常に類似していることがわかる(図3).しかし,BEP法により回収されたO型糖鎖のシアル酸はMTTによるメチル化修飾が行えないため,質量分析中におけるシアル酸の脱離などの課題も残されている.この課題を解決する方策の一つとして,西風らが報告している溶液中におけるSALSA法27)(後述)が適用できれば,シアリル化糖鎖の安定化と結合様式の識別が可能になるであろう.
最近のO型糖タンパク質の解析では,糖鎖の解析(O-グライコーム解析)よりグライコプロテオミクス解析が勢力的に行われている.近年,GENOVIS社から販売されている糖タンパク質のO型糖鎖結合部位を特異的に切断するプロテアーゼOpeRATOR™は,ムチン型糖鎖であるO-GalNAc型糖鎖が結合したセリン・トレオニンのN末端を特異的に切断できるユニークな酵素であり,酵素処理した糖ペプチドを分析することでペプチド配列における糖鎖付加部位および糖鎖の構造が解析できる.たとえば,タンパク質製剤のリンカー配列における意図しないO型糖鎖修飾による品質や生物活性への影響が危惧されている28).特異的なプロテアーゼOpeRATOR™は,Fc融合タンパク質,バイオシミラー等のバイオ医薬品の品質評価などさまざまな利用が期待されている.
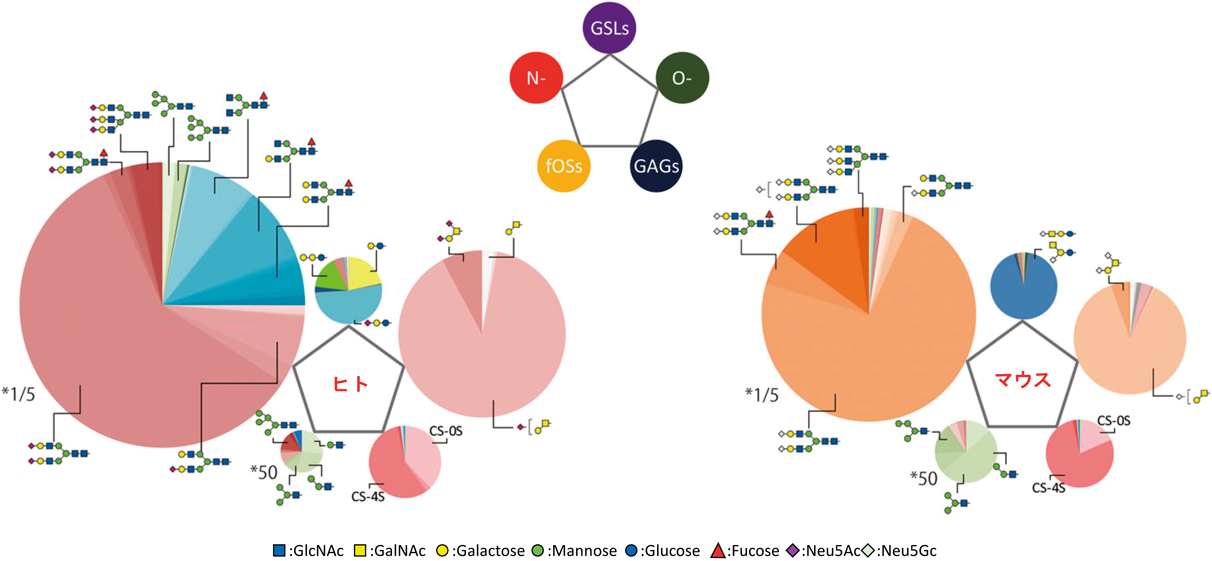
ここまでにサブグライコーム解析としてN型糖鎖,O型糖鎖,GSL糖鎖の解析について紹介してきた.本稿では,fOSやGAGの詳細な解析については割愛したが,生体サンプルにおける主要な複合糖質糖鎖を包括的に捉える“総合グライコーム”について紹介したい.我々の最初の総合グライコーム解析は,培養細胞を対象として行った.その結果,iPS細胞やHeLa細胞などのヒト由来の培養細胞の総合グライコームを解析し,総合グライコームが細胞の特徴を示す記述子となるだけではなく,糖鎖関連未分化マーカー分子の網羅的探索や細胞の形質変化に伴う複合糖質糖鎖の発現変動を捉えることができた.誌面の制限から詳細については引用文献29, 30)を参照されたい.現在では,総合グライコーム解析を細胞以外の生体サンプルでも行っており,本稿では血清の総合グライコームについて紹介する.ヒトとマウス血清の総合グライコーム解析を行った結果,両者ともに約90種類以上の複合糖質糖鎖を定量解析することに成功している31).図3に総合グライコームを示すが,各円グラフの大きさがサブグライコームの総量,各カラーが糖鎖組成を示している.ヒトとマウスの血清を比較しても,円グラフの大きさから各サブグライコームにおける発現量自体には大きな違いは認められなかった.一方で各サブグライコームを構成する糖鎖のプロファイルは,O型糖鎖のようにシアル酸の種類こそN-アセチルノイラミン酸とN-グリコリルノイラミン酸で異なるが糖鎖プロファイルが酷似しているものもあれば,GSL糖鎖のようにプロファイルがまったく異なるものもあり,総合グライコーム解析から得られた五角形のグラフによって,種によるサブグライコームの違いを直感的に捉えることができる.本解析法を血清や生検組織などの臨床検体に適用すれば,サブグライコーム横断的な疾患関連マーカー探索にも応用できる.
6. シアル酸の結合様式が異なる構造異性体の解析要素
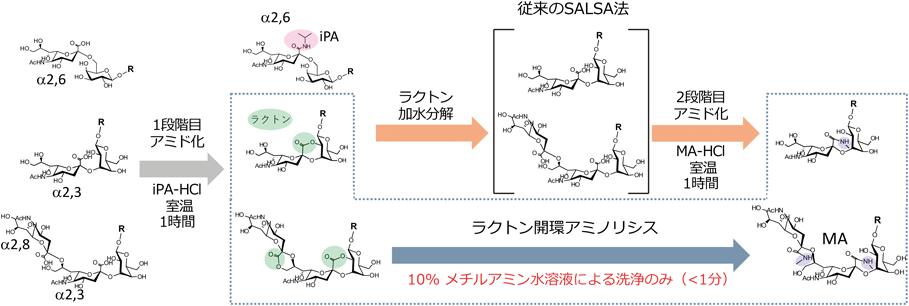
最後に,国内外において競争が激化している質量分析によるシアル酸の構造異性体の識別法を紹介したい.シアル酸は複合糖質糖鎖の非還元末端にα2,3, α2,6, α2,8などの結合様式で存在している.これまでのシアル酸の結合様式の特定には,結合様式特異的なシアリダーゼによる消化の有無,もしくはレクチンによるシアル酸の結合様式の識別法が汎用されてきた.最近では,α2,6結合を持つシアル酸だけを特異的に修飾し,α2,3結合は別の修飾基を導入して結合様式特異的に化学修飾する方法が数多く開発されている.2014年にReidingらは,エタノール存在下の脱水縮合によりα2,6結合のシアル酸はエチルエステル化,そしてα2,3結合のシアル酸は分子内ラクトンを形成することを見いだし,質量分析による構造異性体の識別を可能としている32).Yangらは,Reidingらと同様の条件で1段階目にα2,6結合のエチルエステル化,α2,3結合のシアル酸のラクトン化を行った後,2段階目にラクトンをエチレンジアミンで開裂しアミド化を行っている33).わが国においては,西風らがシアル酸の2段階アミド化によるSALSA法(sialic acid linkage-specific alkylamidation)を開発しており,その概要を下記に述べる27).1段階目のアミド化反応では,水溶性のカルボジイミド[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride:EDC-HCl]や1-ヒドロキシベンゾトリアゾール(1-hydroxybenzotriazole:HOBt)を用いた脱水縮合条件下で,イソプロピルアミン-塩酸塩(iPA-HCl)を用いてα2,6シアル酸を選択的にイソプロピルアミド化する.次に塩基によりα2,3シアル酸のラクトンを開裂後,2段階目のアミド化反応を脱水縮合剤であるPyBOPを用いてα2,3シアル酸をメチルアミン-塩酸塩(MA-HCl)でメチルアミド化する.これらの修飾により,α2,3シアル酸とα2,6シアル酸との間には28 Daの質量の差が生まれ,シアル酸結合様式による構造異性体の違いを“質量の差”として質量分析装置で検出することができる.
このようにほとんどの手法は,1段階目の縮合反応によりα2,3結合のシアル酸が隣接するガラクトース残基の水酸基と分子内脱水を起こしラクトンを形成する性質を利用したものである.我々は,このラクトン環の開裂反応を利用したシアル酸結合様式特異的なアミド化法(Aminolysis-SALSA法)について研究を進めてきたので紹介したい34).Aminolysis-SALSA法は,α2,6シアル酸のiPAによる1段階目の縮合反応は従来のSALSA法とまったく変わらないが,糖鎖が捕捉されている固相担体をメチルアミン溶液で洗浄するだけでα2,3結合シアル酸のラクトン環をアミノリシス反応により開裂するのと同時にメチルアミド化を行う方法である(図4).アミノリシス反応によるα2,3シアル酸のアミド化は洗浄操作だけの数秒で行うことができ,従来のSALSA法の2段階目のアミド化の反応時間(1時間)を大幅に短縮できる.Aminolysis-SALSA法のもう一つの特徴は,直鎖状の一級アミンであればα2,3シアル酸のラクトン環からアミド化できる点である.エチルアミンのような異なるアミンを使うだけで,メチルアミドもしくはエチルアミド化された二つのサンプルをMALDI-TOF MSで比較解析できる.しかしながら,構造の異なるアミンで修飾するため,一般的に用いられているLC-MS解析には適用できない.そこで構造が同じ安定同位体試薬の利用について検討した.一般的にアミン試薬の安定同位体は塩酸塩として販売されており,これまでの研究で,アミン塩酸塩はAminolysis-SALSA法では反応が進行しないことが明らかとなっていた.そこで,アミン塩酸塩の中和剤として非反応性のアミンであるtert-ブチルアミンを用いたところ,塩酸塩でもラクトン環開裂アミノリシス反応が良好に進行したので,安定同位体アミン塩酸塩を用いたα2,3シアリル化糖鎖の定量解析法(iSALSA法)として報告している35).
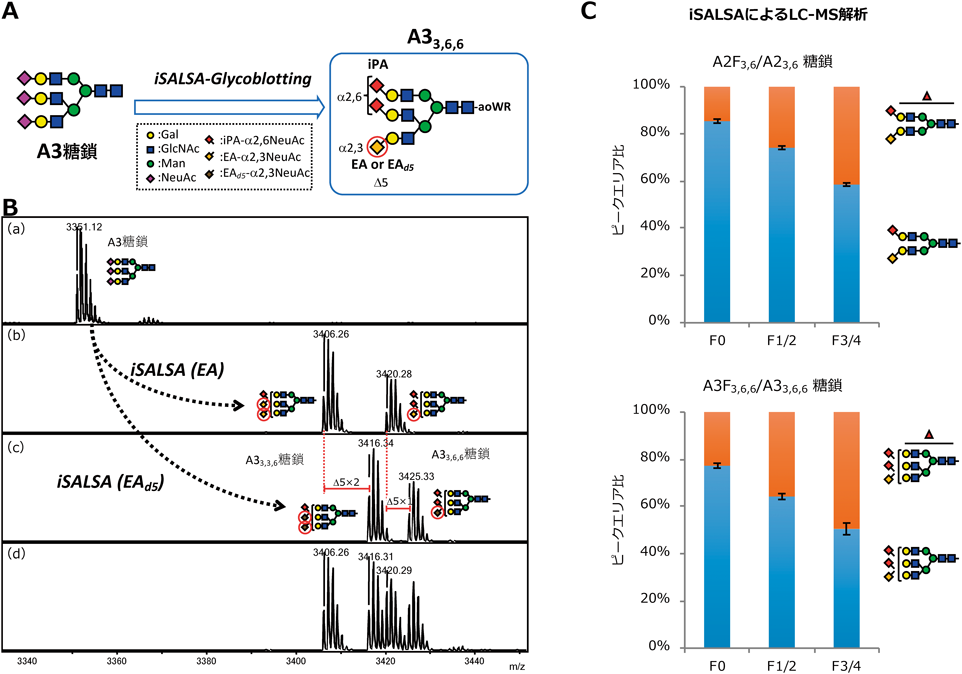
実際にAminolysis-SALSA法を用いたウシ由来の血清タンパク質であるフェツインのN型糖鎖解析を図5に示した.図5B上段に示したのは,シアル酸をメチルエステル化したMALDI-TOF MSスペクトルであり,シアル酸の結合様式は識別できずA3糖鎖は一つのピークとして検出される.一方,Aminolysis-SALSA法でα2,3シアル酸が選択的にエチルアミド化された場合には,A3は二つのピークとして検出され,シアル酸結合様式の違いが異性体のシグナルとして検出されている.軽水素および重水素エチルアミド化サンプルを等量混合したスペクトルを図5B下段に示しているが,α2,3シアル酸一つにつき5 Da分の質量のシフトが生じており,シアル酸の結合様式にフォーカスした比較解析に適用できる.最後に本手法を利用した非アルコール性脂肪肝炎(nonalcoholic steatohepatitis:NASH)患者血清のN型糖鎖の解析を簡単に紹介する.NASHは肝臓の線維化に伴い肝硬変・肝がんへと進展することが知られているが,線維化を評価するゴールドスタンダードは肝生検による病理診断であり,有効な血清診断マーカーが求められている.今回の解析では,F0(線維化なし),F1/2(軽度もしくは中度)そしてF3/4(高度もしくは肝硬変)に分類された検体を用いてN型糖鎖をLC-MS解析したところ,図5Cに示すようにA2とA2FおよびA3とA3Fのシアリル化糖鎖の構造異性体の割合が肝線維化の進展に伴い変化していることが明らかとなった35).このようなシアル酸結合様式を識別する糖鎖解析技術により,これまでわからなかったシアル酸の構造異性体に起因する線維化進展マーカーを見いだすことに成功した.今回はシアル酸の結合様式識別法について紹介したが,このような新しい糖鎖解析技術の発展が,新たな疾患バイオマーカーの発見を加速させることを期待している.
本稿ではタンパク質結合性であるN型糖鎖およびO型糖鎖,GSL糖鎖における解析要素とその課題を中心に紹介してきた.これまでにサブグライコームごとに多くの高スループットな解析法や高感度解析技術が開発され,さらに近年のHPLCや質量分析装置の高性能化に伴い,グライコーム解析からは膨大な情報が得られるようになってきている.さらにシアル酸の結合様式に起因する構造異性体の情報は,非常に有用な情報が含まれている一方でデータマイニングが追いついておらず,検体数の増加に比例してデータ処理および解析には非常に多くの時間を要する.今後,糖鎖解析法の技術開発により得られる貴重なデータを余すところなくHuman Glycome Projectをはじめとするさまざまな場面で有効に活用するために,糖鎖解析技術とバイオインフォマティクスが密に連携し新しいプラットフォームを作り出す必要があるだろう.
引用文献References
1) Murakami, M., Kiuchi, T., Nishihara, M., Tezuka, K., Okamoto, R., Izumi, M., & Kajihara, Y. (2016) Chemical synthesis of erythropoietin glycoforms for insights into the relationship between glycosylation pattern and bioactivity. Sci. Adv., 2, e1500678.
2) Liu, X.E., Desmyter, L., Gao, C.F., Laroy, W., Dewaele, S., Vanhooren, V., Wang, L., Zhuang, H., Callewaert, N., Libert, C., et al. (2007) N-glycomic changes in hepatocellular carcinoma patients with liver cirrhosis induced by hepatitis B virus. Hepatology, 46, 1426–1435.
3) Okuyama, N., Ide, Y., Nakano, M., Nakagawa, T., Yamanaka, K., Moriwaki, K., Murata, K., Ohigashi, H., Yokoyama, S., Eguchi, H., et al. (2006) Fucosylated haptoglobin is a novel marker for pancreatic cancer: A detailed analysis of the oligosaccharide structure and a possible mechanism for fucosylation. Int. J. Cancer, 118, 2803–2808.
4) Hase, S., Ikenaka, K., Mikoshiba, K., & Ikenaka, T. (1988) Analysis of tissue glycoprotein sugar chains by two-dimensional high-performance liquid chromatographic mapping. J. Chromatogr. A, 434, 51–60.
5) Natsuka, S., Masuda, M., Sumiyoshi, W., & Nakakita, S. (2014) Improved method for drawing of a glycan map, and the first page of glycan atlas, which is a compilation of glycan maps for a whole organism. PLoS One, 9, e102219.
6) 木下充弘,掛樋一晃(2008)糖鎖解析におけるキャピラリー電気泳動が果たす役割.生物物理化学,52, 111–116.
7) Kita, Y., Miura, Y., Furukawa, J., Nakano, M., Shinohara, Y., Ohno, M., Takimoto, A., & Nishimura, S. (2007) Quantitative glycomics of human whole serum glycoproteins based on the standardized protocol for liberating N-glycans. Mol. Cell. Proteomics, 6, 1437–1445.
8) Sekiya, S., Wada, Y., & Tanaka, K. (2005) Derivatization for stabilizing sialic acids in MALDI-MS. Anal. Chem., 77, 4962–4968.
9) Miura, Y., Shinohara, Y., Furukawa, J., Nagahori, N., & Nishimura, S. (2007) Rapid and simple solid-phase esterification of sialic acid residues for quantitative glycomics by mass spectrometry. Chemistry, 13, 4797–4804.
10) Furukawa, J., Shinohara, Y., Kuramoto, H., Miura, Y., Shimaoka, H., Kurogochi, M., Nakano, M., & Nishimura, S. (2008) Comprehensive approach to structural and functional glycomics based on chemoselective glycoblotting and sequential tag conversion. Anal. Chem., 80, 1094–1101.
11) Shinohara, Y., Furukawa, J., Niikura, K., Miura, N., & Nishimura, S. (2004) Direct N-glycan profiling in the presence of tryptic peptides on MALDI-TOF by controlled ion enhancement and suppression upon glycan-selective derivatization. Anal. Chem., 76, 6989–6997.
12) Uematsu, R., Furukawa, J., Nakagawa, H., Shinohara, Y., Deguchi, K., Monde, K., & Nishimura, S. (2005) High throughput quantitative glycomics and glycoform-focused proteomics of murine dermis and epidermis. Mol. Cell. Proteomics, 4, 1977–1989.
13) Stöckmann, H., Adamczyk, B., Hayes, J., & Rudd, P.M. (2013) Automated, high-throughput IgG-antibody glycoprofiling platform. Anal. Chem., 85, 8841–8849.
14) Bladergroen, M.R., Reiding, K.R., Hipgrave Ederveen, A.L., Vreeker, G.C., Clerc, F., Holst, S., Bondt, A., Wuhrer, M., & van der Burgt, Y.E. (2015) Automation of high-throughput mass spectrometry-based plasma N-glycome analysis with linkage-specific sialic acid esterification. J. Proteome Res., 14, 4080–4086.
15) 古川潤一,西村紳一郎(2010)グライコブロッティング法と糖鎖自動抽出装置(SweetBlot)による一滴の血清からの糖鎖バイオマーカー探索.未来材料,10, 48–54.
16) Merril, A.H. Jr. (2005) SphinGOMAP—A web-based biosynthetic pathway map of sphingolipids and glycosphingolipids. Glycobiology, 15, 15G.
17) Ito, M. & Yamagata, T. (1989) Purification and characterization of glycosphingolipid-specific endoglycosidases (endoglycoceramidases) from a mutant strain of Rhodococcus sp. Evidence for three molecular species of endoglycoceramidase with different specificities. J. Biol. Chem., 264, 9510–9519.
18) Furukawa, J., Sakai, S., Yokota, I., Okada, K., Hanamatsu, H., Kobayashi, T., Yoshida, Y., Higashino, K., Tamura, T., Igarashi, Y., et al. (2015) Quantitative GSL-glycome analysis of human whole serum based on an EGCase digestion and glycoblotting method. J. Lipid Res., 56, 2399–2407.
19) Tagami, S., Inokuchi Ji, J., Kabayama, K., Yoshimura, H., Kitamura, F., Uemura, S., Ogawa, C., Ishii, A., Saito, M., Ohtsuka, Y., et al. (2002) Ganglioside GM3 participates in the pathological conditions of insulin resistance. J. Biol. Chem., 277, 3085–3092.
20) Sato, T., Nihei, Y., Nagafuku, M., Tagami, S., Chin, R., Kawamura, M., Miyazaki, S., Suzuki, M., Sugahara, S., Takahashi, Y., et al. (2008) Circulating levels of ganglioside GM3 in metabolic syndrome: A pilot study. Obes. Res. Clin. Pract., 2, I–II.
21) Huang, Y., Mechref, Y., & Novotny, M.V. (2001) Microscale nonreductive release of O-linked glycans for subsequent analysis through MALDI mass spectrometry and capillary electrophoresis. Anal. Chem., 73, 6063–6069.
22) Kozak, R.P., Royle, L., Gardner, R.A., Fernandes, D.L., & Wuhrer, M. (2012) Suppression of peeling during the release of O-glycans by hydrazinolysis. Anal. Biochem., 423, 119–128.
23) Carlson, D.M. (1968) Structures and immunochemical properties of oligosaccharides isolated from pig submaxillary mucins. J. Biol. Chem., 243, 616–626.
24) Kameyama, A., Thet Tin, W.W., Toyoda, M., & Sakaguchi, M. (2019) A practical method of liberating O-linked glycans from glycoproteins using hydroxylamine and an organic superbase. Biochem. Biophys. Res. Commun., 513, 186–192.
25) Honda, S., Akao, E., Suzuki, S., Okuda, M., Kakehi, K., & Nakamura, J. (1989) High-performance liquid chromatography of reducing carbohydrates as strongly ultraviolet-absorbing and electrochemically sensitive 1-phenyl-3-methyl-5-pyrazolone derivatives. Anal. Biochem., 180, 351–357.
26) Furukawa, J., Piao, J., Yoshida, Y., Okada, K., Yokota, I., Higashino, K., Sakairi, N., & Shinohara, Y. (2015) Quantitative O-glycomics by microwave-assisted β-elimination in the presence of pyrazolone analogues. Anal. Chem., 87, 7524–7528.
27) Nishikaze, T., Tsumoto, H., Sekiya, S., Iwamoto, S., Miura, Y., & Tanaka, K. (2017) Differentiation of sialyl linkage isomers by one-pot sialic acid derivatization for mass spectrometry-based glycan profiling. Anal. Chem., 89, 2353–2360.
28) Hashii, N., Suzuki, J., Hanamatsu, H., Furukawa, J.I., & Ishii-Watabe, A. (2019) In-depth site-specific O-glycosylation analysis of therapeutic Fc-fusion protein by electron-transfer/higher-energy collisional dissociation mass spectrometry. Biologicals, 58, 35–43.
29) Fujitani, N., Furukawa, J., Araki, K., Fujioka, T., Takegawa, Y., Piao, J., Nishioka, T., Tamura, T., Nikaido, T., Ito, M., et al. (2013) Total cellular glycomics allows characterizing cells and streamlining the discovery process for cellular biomarkers. Proc. Natl. Acad. Sci. USA, 110, 2105–2110.
30) Furukawa, J., Tsuda, M., Okada, K., Kimura, T., Piao, J., Tanaka, S., & Shinohara, Y. (2015) Comprehensive glycomics of a multistep human brain tumor model reveals specific glycosylation patterns related to malignancy. PLoS One, 10, e0128300.
31) Yoshida, Y., Furukawa, J.I., Naito, S., Higashino, K., Numata, Y., & Shinohara, Y. (2016) Quantitative analysis of total serum glycome in human and mouse. Proteomics, 16, 2747–2758.
32) Reiding, K.R., Blank, D., Kuijper, D.M., Deelder, A.M., & Wuhrer, M. (2014) High-throughput profiling of protein N-glycosylation by MALDI-TOF-MS employing linkage-specific sialic acid esterification. Anal. Chem., 86, 5784–5793.
33) Yang, S., Wu, W.W., Shen, R.F., Bern, M., & Cipollo, J. (2018) Identification of sialic acid linkages on intact glycopeptides via differential chemical modification using IntactGIG-HILIC. J. Am. Soc. Mass Spectrom., 29, 1273–1283.
34) Hanamatsu, H., Nishikaze, T., Miura, N., Piao, J., Okada, K., Sekiya, S., Iwamoto, S., Sakamoto, N., Tanaka, K., & Furukawa, J.I. (2018) Sialic acid linkage specific derivatization of glycosphingolipid glycans by ring-opening aminolysis of lactones. Anal. Chem., 90, 13193–13199.
35) Hanamatsu, H., Nishikaze, T., Tsumoto, H., Ogawa, K., Kobayashi, T., Yokota, I., Morikawa, K., Suda, G., Sho, T., Nakai, M., et al. (2019) Comparative glycomic analysis of sialyl linkage isomers by sialic acid linkage-specific alkylamidation in combination with stable isotope labeling of α2,3-linked sialic acid residues. Anal. Chem., 91, 13343–13348.