糖鎖の構成成分はグルコース,マンノース,ガラクトースなどの異性体とその誘導体(N-アセチルグルコサミン,N-アセチルガラクトサミン,N-アセチルイラミン酸,L-フコース,グルクロン酸,キシロースなど)であることから,質量分析による同定が困難な解析対象である.糖鎖はさまざまな形態(糖タンパク質,糖脂質,プロテオグリカン,遊離糖鎖,多糖)で存在しその生物機能は多岐に及ぶ.さらに,糖鎖の織りなす構造は多様でその不均一性もおびただしい.生体内で糖鎖を認識する分子は一般にレクチンと呼ばれるが,レクチンドメインの分子骨格は50を超え,さまざまな生命現象で暗躍する実態が明らかになってきた.そのようなレクチン分子群を,糖鎖構造を読み取る「認識素子」(decoder)としてアレイ上に配置すれば糖鎖プロファイリングシステムになる.しかし,糖鎖-レクチン間の相互作用は一般に弱く(解離定数Kd>10−6 M),本アイデアの実現には克服すべき技術課題が存在した.本論ではエバネッセント波励起蛍光検出原理に基づくレクチンマイクロアレイによる糖タンパク質糖鎖の迅速ハイスループット解析法の原理と応用を主に述べたい.
1)バイオシミラーの登場と糖鎖課題
生体内にもともと存在する抗体や核酸を医薬品として開発,承認されたものは一般にバイオ医薬品と呼ばれる.このうち,抗体などのバイオ医薬品はCHO細胞などの哺乳類細胞で生産する必要があるため,高コストとなることが多い.バイオ医薬品開発に付随する課題点は多々あるが,中でも糖鎖修飾による構造的多様性と,糖鎖構造の違いによる薬効と安全性への影響は大きな問題である.事実,これまで開発されてきたタンパク質性バイオ医薬品のほぼすべてが分泌タンパク質である.分泌タンパク質であれば小胞体内腔を通過する過程で否応なしに糖鎖修飾を受けてしまう.中には,糖鎖は特段必要なく大腸菌で発現しても医薬品としての効能に問題ないものもある.一方,抗体やエリスロポイエチンなど多くのバイオ医薬品では糖鎖構造が効能や安定性に大きく影響する.バイオ医薬品開発において糖鎖構造の発現制御は重要な課題の一つである.医薬品開発のトレンドが従来の低分子医薬品からバイオ医薬品へとシフトしていることは間違いない.そして,それに拍車をかけているのが,先行するバイオ医薬品の特許切れに伴うバイオシミラーの台頭である.バイオシミラーとは先行品(innovator)の特許が切れたのちに開発,上市された,先行品と同等性・同質性の認可された後発品医薬品を指す.しかし,化学構造の明確な低分子医薬品と異なり,動物細胞等で生産されるバイオ医薬品はそもそも不均一な分子集団であり,先行品と同一の糖鎖構造を持った製品を再現性高く製造することは困難である.現在も,同等性・同質性をどのように証明すべきかについては規制当局等によって議論が繰り広げられているところである.中でも糖鎖構造の不均一性と,各糖鎖構造(グライコフォーム)の生物機能に関する影響を調べることはバイオ医薬品開発の中心課題といっても過言ではない1).
2)迅速簡便解析法への期待
表1に米国食品医薬品局(FDA)が示したバイオ医薬品糖鎖解析技術の一覧を示す2).糖タンパク質性バイオ医薬品の糖鎖解析は大きく三つのレベルに分けられる.第一に,糖タンパク質をそのまま解析する方法(糖タンパク質レベル),第二に,糖タンパク質をプロテアーゼ消化により糖ペプチドとして解析する方法で,糖鎖付加位置の決定が含まれる(糖ペプチドレベル).第三に,糖鎖を糖タンパク質や糖ペプチドから切り離し,遊離した糖鎖の構造を解析する方法である(オリゴ糖レベル).この他,糖タンパク質レベル,糖ペプチドレベルでは糖組成分析が求められる.表1からわかるようにこれらの方法は総じて質量分析や各種クロマトグラフィーなど,従来から用いられてきた分析技術の組合わせからなる.また,これらは構造に関する確実な情報を定量的に提供する半面,一般に解析に労力を要し,迅速性,スループットに欠けるという側面を持つ.しかし,ことバイオ医薬品に関してはマスターセルバンクの構築から最適な発現条件の検討など,開発初期段階に多くの検体を迅速簡便に解析する必要が生じる.残念ながら,旧来より用いられる物理化学的原理に基づく糖鎖分析法の多くはその要件を満たしていない.FDAは2013年にエバネッセント波励起蛍光法に基づくレクチンマイクロアレイ用スキャナー(GPバイオサイエンス社製,当時)を導入し,各種バイオ医薬品の糖鎖構造について既存の方法による分析結果と比較した.その結果,レクチンマイクロアレイは各バイオ医薬品が有する糖鎖構造の特徴を十分抽出する能力があることを認め,そのことを学術論文に発表した3).ただし,あくまで本技術は糖鎖構造の特徴を抽出するプロファイリング技術であって,LCマッピングや質量分析法で可能な構造同定や定量を行うことはできない.あくまでも従来の分析法と対極をなす補完技術の位置づけと考えるべきである.
表1 糖タンパク質医薬品の糖鎖分析に用いられる手法| 解析手法 | 解析目的 |
|---|
| 1. 糖タンパク質丸ごとの解析(インタクト分析) | |
| ・レクチンマイクロアレイ | →糖鎖プロファイリング |
| ・RP†1/IEX†2-HPLC†3 | →糖鎖不均一性解析 |
| ・質量分析(MALDI-MS†4,またはESI-MS†5) | →グライコフォーム解析 |
| ・CE†6 | →シアル酸不均一性解析 |
| ・PAGE†7/IEF†8 | →シアル酸不均一性解析 |
| 2. プロテアーゼ消化後の解析(糖ペプチド分析) | |
| ・LC-ESI, MALDI-MS | →ペプチドマッピング,糖鎖付加位置 |
| ・CE-MS | →ペプチドマッピング,糖鎖付加位置 |
| 3. 糖鎖切り出し後の解析(オリゴ糖分析) | |
| [非標識] | |
| ・HPAEC-PAD†9 | →標準糖鎖との比較による構造同定 |
| ・MALDI-MS(メチル化分析など) | →糖鎖プロファイリング |
| [蛍光標識] | |
| ・MALDI-MS | →糖鎖プロファイリング |
| ・多次元HPLC(HILIC†10,RP, AE†11など) | →標準糖鎖との比較による構造同定 |
| ・LC-ESI-MS | →全体の構造同定 |
| ・ESI-MS/MS | →糖鎖配列,および結合様式 |
| ・CE | →グライコフォーム分析(シアル酸等) |
| 4. 酸加水解分解後の構成糖の解析(糖組成分析) | |
| ・HPAEC-PAD(非誘導体化) | →定量単糖分析 |
| ・RP-HPLC(誘導体化) | →定量単糖分析 |
| Zhangら2) を参考に作成した.†1 RP:reversed-phase(逆相).†2 IEX:ion-exchange(イオン交換).†3 HPLC:high-performance liquid chromatography(高速液体クロマトグラフィー).†4 MALDI-MS:matrix assisted laser desorption/ionization-mass spectrometry(マトリックス支援レーザ脱離イオン化質量分析).†5 ESI-MS:electrospray ionization-mass spectrometry(エレクトロスプレーイオン化質量分析).†6 CE:capillary electrophoresis(キャピラリー電気泳動).†7 PAGE:polyacrylamide gel electrophoresis(ポリアクリルアミドゲル電気泳動).†8 IEF:isoelectric focusing(等電点電気泳動).†9 HPAEC-PAD:high-performance anion-exchange chromatography with pulsed amperometry detection(高速イオン交換クロマトグラフィー-パルスアンペロメトリ検出法).†10 HILIC:hydrophilic interaction chromatography(親水性相互作用液体クロマトグラフィー).†11 AE:anion-exchange(陰イオン交換). |
エバネッセント波励起蛍光法の開発経緯については他稿4)に詳細に記載したのでここでは要約のみを記す.動植物から微生物,ウイルスに至るまでほぼすべての生物が糖結合タンパク質(レクチン)を持つ.レクチンには多様な種類(分子骨格,ファミリー)が存在し,その特異性もきわめて広いことから,多種多様なレクチンをうまく用いれば糖鎖構造の簡易プロファイリングができるはずである.そのような考えは以前からあったが,それが現実のものとなったのは21世紀に入ってからである.くしくも2005年,独立4グループからレクチンマイクロアレイの原理開発に成功したとの報告がなされた5–8).実は,これに先んじてイスラエルのベンチャー企業「プロコグニア」(社名は「予知する」の意)がレクチンマイクロアレイの原型を考案し各種糖タンパク質の糖鎖構造予測ツールを開発していた(会社設立は2000年,論文発表は2007年)9).その後,さらにいくつかのグループからレクチンアレイに関する論文が発表され,また今日ではレクチンアレイ(チップ)を販売する企業もいくつかある.しかし,レクチンマイクロアレイ解析装置にエバネッセント波励起蛍光法を採用し,製品化しているのはわが国だけである(他はDNAチップなどで用いられている共焦点型検出器,これだと液相観察ができない).ちなみに,エバネッセント波とはある特殊な条件下で発生する電磁場のことで,蛍光観察する際に発生する光の射程が,励起波長の約半分の範囲に限定されることから近接場とも呼ばれる.
エバネッセント波の現象は古くから知られ,顕微鏡などにも応用例があるが,マイクロアレイの蛍光検出に利用した例はわが国以外にない.筆者らがエバネッセント波励起法を採用した第一の理由は,平衡条件下で弱い糖鎖-レクチン間の結合を捉える必要があると考えたからである.また,平衡を壊さないため,通常ELISA実験などで行われる洗浄操作が不要となり,再現性の高い相互作用解析が可能になると考えた.さらに,エバネッセント波励起蛍光検出原理に基づくレクチンマイクロアレイの開発と活用が加速した理由がいくつかある.第一に,経済産業省傘下のNEDOプロジェクト(Structural Glycomics;2003~2005年度)としての後押しがあり,製品化が強く求められたこと,第二に,上市に向けて関連企業が積極的に動いてくれたこと,第三に,後続のNEDOプロジェクト(Medical Glycomics;2006~2010年度)の参画研究者(臨床研究者を多く含む)たちによって本技術の有用性が広く認識されたことなどがあげられる.エバネッセント波励起蛍光法によるレクチンマイクロアレイの原理と応用については筆者ら自身の総説10)の他,他者による解説2, 11)もある.
1)レクチンマイクロアレイの解析対象
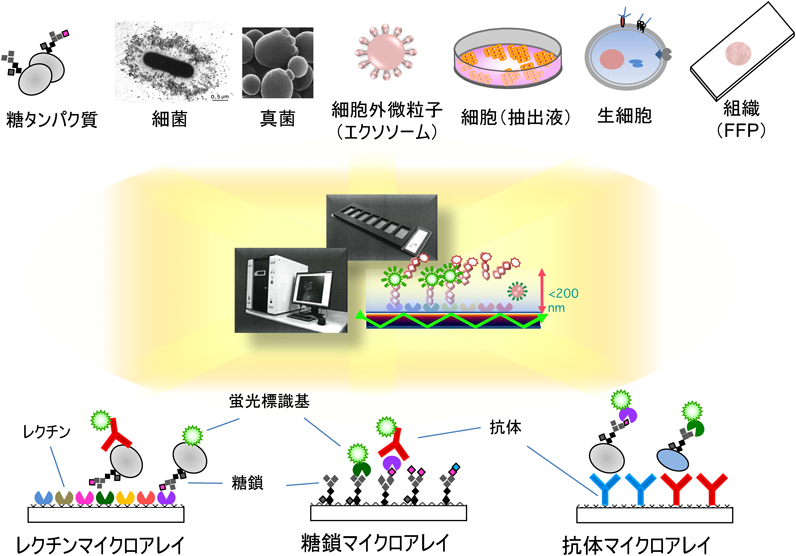
基本的にレクチンマイクロアレイは「糖鎖を有する生体物質」に万能である.N-グリカン,O-グリカンなど糖鎖の種類にもよらない.レクチンと反応するのであれば,天然糖鎖に限らず,糖鎖の誘導体やその類似体(mimetics)であっても構わない.天然由来の糖鎖関連試料は大きく分けて二つある.一つが,オリゴ糖鎖,糖鎖アミノ酸(N-グリカン付加Asnなど),糖ペプチド,糖タンパク質など,化学構造が明確に定義でき,均質な分子のみからなる系で,もう一つが血清や組織抽出物など,さまざまな成分から構成される混合系である.前者に対する解析のほとんどは,構造の明確な精製品について行ったもので,原理検証など,モデル系の位置づけの研究が多い.ただ,オリゴ糖については有用な蛍光標識剤がないため,これまでに解析例がない.糖タンパク質から徹底プロナーゼ消化によって得られるN-グリカンの付加したAsnをテトラメチルローダミン(TMR)で標識した化合物4種について,野口研究所の水野らとの共同研究が1例あるのみである12).これによると,TMR標識各種オリゴ糖Asnとレクチンとの結合は1回の洗浄操作ではがれてしまうことがわかる.また,近年注目されている細胞外微粒子(エクソソーム)表層の糖鎖構造に着目し,京都大学の秋吉を代表とするCREST班が世界に先駆けエバネッセント波励起蛍光検出法によるエクソソーム糖鎖解析を推進している13–15).詳細は秋吉の稿を読んでいただきたいが,エクソソームの径は約100 nmとされることから,エバネッセント波の射程にちょうど収まる.この点はエバネッセント式スキャナーによる細胞外微粒子解析の優位性につながると考えられる.図1にレクチンアレイの解析対象と応用技術をまとめた.
2)MG(Medical Glycomics)コンセプトによる糖鎖関連疾患バイオマーカー開発指針
実際に,疾患バイオマーカーの探索や細胞品質管理としての糖鎖プロファイリングは,多様な糖鎖複合体が混在する混合系試料を対象とする.その代表が細胞や組織抽出液,血清や尿などの体液である.しかし,これらの試料を直接Cy3標識しても検体間での糖鎖プロファイル差は認めにくい.ある疾患判別に最も有効な糖タンパク質等に狙いを定め,これを,抗体カラムなどを使って精製(単一成分にまで精製できない場合が多いので,エンリッチと呼ぶ)後に,比較したい検体間の比較解析を行う.ここで,有意に検体間の糖鎖プロファイル差を示すシグナル(レクチン)が見つかれば,次にこのレクチンを用い,がんの組織標本などを用いて病巣部に対する特異的染色を確認する.病巣特異的なレクチン染色が認められれば,次にそのレクチンと反応する糖鎖を持つ病巣部由来の糖タンパク質の同定に移る.この同定手法としては,プロテオミクス手法によって固相化レクチンに特異的に結合した糖タンパク質の同定を行う方法と,さまざまな文献情報やその標的糖タンパク質の生理機能との関連などを総合して推定する方法がある.後で述べる肝内胆管がん(IhCC)のマーカー分子,シアリルMUC1は後者の決め打ちがうまく成功した例である.MGコンセプトと具体的実験法については成松らによる総説16, 17)を参照されたい.表2に糖鎖関連疾患バイオマーカー開発のポイントをまとめる.
表2 疾患関連糖タンパク質バイオマーカー開発戦略のポイント| ・タンパク質の量的変化ではなく質的変化(糖鎖構造など)を追跡する(MGコンセプト) |
| ・直接血清から糖鎖プロファイル解析を開始しない |
| 病理切片,病巣直下の体液など(例:胆管→胆汁,泌尿器→尿,肝臓→血清など) |
| ・比較糖鎖プロファイリング(レクチンマイクロアレイ解析)で差のあったレクチンを用いた組織染色等を行い,病巣特異的な染色を確認する |
| ・可能な限り非侵襲的な採取法で得られる試料(血清,尿,唾液等)を対象にELISA等の簡易アッセイ系に落とし込み,大規模解析への道筋を作る |
3)レクチンマイクロアレイの実践技術
疾患関連糖タンパク質バイオマーカー探索のためにはいくつかの重要な応用技術がある.ここでは誌面の関係で,パラフィン包埋組織切片から得られる抽出物の糖鎖プロファイリング法と抗体オーバーレイ法についてだけ述べる.松田らはホルマリン固定したパラフィン包埋(FFP)大腸がん病理切片(5 µm)から1.5 mm四方の薄片塊を採取し,バッファー抽出,抗原賦活処理,Cy3標識したのち,その一部をレクチンマイクロアレイに供した.がん部と周辺非がん部の糖鎖プロファイルに有意差が認められ,本手法が疾患関連糖タンパク質バイオマーカーの探索,特に初段階に有効な手法であることが示された18).その後,本手法は各種改良が加えられ,レーザーマイクロダイセクション処理した多領域の薄片塊を一斉解析するプロトコールも開発された19).
久野らはレクチンマイクロアレイのハイスループット化に対応する抗体オーバーレイ法を開発した.これは,標的糖タンパク質を仮定し,真に標的が病的変化等に伴って糖鎖構造の変化を起こしているかを検証するのに有効な手法である.通常,体液や組織抽出物を直接,一様に蛍光標識するが,抗体オーバーレイ法では蛍光標識抗体,ないしそのバリエーションである二抗体法やアビジン・ビオチン系を介した検出によって,被検体試料中の標的糖タンパク質の糖鎖変化を間接的に検出する.ただし,結果は抗体の性能に大きく依存すること,固相化した抗体ビーズなどによって被検体試料中の標的糖タンパク質を事前にある程度エンリッチ(免疫沈降)しておく必要がある点は留意しておかねばならない20).
5. レクチンマイクロアレイのHuman Glycomics,医療への応用
1)がん関連糖鎖マーカー開発の実際
a.肝内胆管がん(IhCC)——WFA-MUC1(MY.1E12)
肝内胆管がん(intrahepatic cholangiocarcinoma:IhCC)は肝臓内胆管に生じる上皮がんで一般に発見が難しく,膵臓がんと並んで予後が最も悪い難治性がんに数えられる.有効な治療法は外科手術のみのため,早期発見が最大の課題であるが,信頼性の高いバイオマーカーはない.松田らは文献18で述べた新技術を活用し,糖鎖関連バイオマーカーの開発に着手した.すなわち,肝内胆管がん患者由来のFFP組織切片(5 µm)がん部・非がん部の微小領域から糖タンパク質を抽出,そのままCy3標識し比較糖鎖プロファイリング解析を行った.その結果,ノダフジ(Wisteria floribunda)由来レクチンWFAががん部特異的に強いシグナルを与えた(感度0.92,特異度0.87, AUC 0.93).蛍光標識WFAは組織染色でがん部に特異的に結合した.WFAと反応する糖鎖を持つタンパク質は,がんとの強い関連性などの状況証拠から第一にMUC1を疑った.シアリルMUC1に対する抗体を開発していた入村(当時東大薬学部)の単クローン抗体,MY.1E12を用い組織染色を行ったところ,がん部において,MY.1E12はWFAと明確に共存した.このことから,IhCCの標的糖タンパク質はWFA陽性のMUC1であると結論づけた.さらに,多検体での評価を行うため,WFA-MY.1E12のレクチン抗体サンドイッチアッセイ系を構築し,肝内胆管がん患者と良性疾患(胆石)患者由来の胆汁を比較したところ,両者は明確な差を示した(p値0.0004,感度0.90,特異度0.76)21).
b.肝線維化マーカー——AOL/MAL-AGP~WFA-M2BP(M2BPgi)
肝線維化は肝炎ウイルスによって引き起こされる肝実質細胞の慢性的な線維化(fibrosis)で,20年に及ぶ線維化の進行を経て,肝硬変となり,最終的に肝細胞がんに至る.線維化の進行に従って発がんのリスクが高まるため,肝炎ウイルスの感染患者は線維化の段階を毎年検診する必要がある.従来診断法としてのゴールデンスタンダードは肝生検であるが,この方法には問題がある.侵襲的方法であり患者への負担が大きい.超音波装置などを用いた非侵襲的検査法も進歩しているが,肥満者で誤判断が生じるなど問題を含む.久野らは上述のMGコンセプトに基づき,肝線維化のF3~F4ステージ間を見分けるのに有効なレクチンを探索した.その結果,麹菌(Aspergillus oryzae)由来レクチンAOL(線維化進行で上昇)とイヌエンジュ(Maackia amurensis)由来レクチンMAL(逆に下降)を同定し,標的糖タンパク質としてα酸性糖タンパク質(AGP)を選択した22).その後,久野らはシスメックス社と共同で社が有するハイスループット自動測定装置HISCLを用い,迅速サンドイッチELISA系(検体あたり18分)を構築した.その結果はレクチンマイクロアレイを用いた抗体オーバーレイ法の結果とよい一致を示し,本計測法をLecT-Hepa Testと名づけた23).
しかし,上記AGPを標的とした診断法には実用的にエンリッチの過程を経る必要があり,病院での実装には問題となった.そこで,久野らは再度標的糖タンパク質のスクリーニングに着手し,肝線維化によって発現上昇するMac2-binding protein(M2BP)をあらたに選択し,本標的の糖鎖変化をWFAで追跡する系を構築した24).2013年における原著論文発表とプレスリリース(https://www.sysmex.co.jp/news/2013/131226.html)を経て,2015年,M2BP glycosylation isomer(M2BPgi)は肝線維化診断マーカーとして保険適用の認可を得るに至った(https://www.sysmex.co.jp/news/2015/150105.html).本検査システムは潜在的肝炎ウイルス患者に悩むアジア諸国に大きな恩恵をもたらしている.
c.その他のがん関連糖鎖マーカー
MGコンセプトに基づく疾患関連糖鎖マーカーの開発は上記肝内胆管がんと肝線維化にとどまらない.誌面の関係で疾患名をあげる程度にとどめる.
松田らは肝内胆管がんの胆汁診断に有効であったWFA-MUC1(MY.1E12)の血清診断に向け検証し有効な結果を得て25),正田らは多施設研究によってこのことを検証した26).WFA-MUC1(MY.1E12)はさらに肝細胞がんの血清診断にも有効であることが玉城らによって示された27).平尾らは肺腺がんの血清マーカーとしてピーナッツレクチン(PNA)陽性フィブロネクチンが有効であることを報告したが28),栂谷内らは同じ肺がんでも性質の異なる小細胞がんでは別のマーカー,ヒイロチャワンタケ(Aleuria aurantia)由来レクチンAAL陽性セクレトグラニン(Secretogranin)IIIが有効であるとした29).曽我部らは卵巣がんのうち明細胞がんに対するマーカー探索を行い患者由来腹水液で検証した結果,WFA陽性セルロプラスミンにがんとの高い関連性を認めた30).
一方,標的タンパク質の同定には及んでいないが,北里大の山下らは進行性胃がんのリンパ節転移との関連に有効なレクチンを同定した31).大分大のグループも同様な解析に着手し,それぞれ直腸がんの再発との関係32),胃がん再発との関係33),膵管内乳頭粘液性腫瘍の悪性転換との関連34)で有意に変動するレクチンを見いだした.
2)その他の疾患関連糖鎖マーカー
がん以外の疾患にもMGコンセプトは有効性が示されている.成松らは単クローン性免疫グロブリン沈着症によるIgA腎症患者において,WFA陽性IgA1分子の存在が,異常な多量体化と沈着に関連していることを示した35).竹下らは関節リウマチではマトリックス金属プロテアーゼ-3(MMP-3)の糖鎖修飾がヤナギマツタケ(Agrocybe cylindracea)由来ガレクチン(ACG),およびジャカリン陽性になることと相関するとした36).福島医大の二川らは特発性正常圧水頭症の判断に髄液由来トランスフェリンのグライコフォーム解析が有効であることを示した37).疾患原因ウイルスについてもレクチンマイクロアレイによる糖鎖プロファイリングが行われている.我妻らはB型肝炎ウイルスの感染に関与するデーン粒子表層糖タンパク質の解析プロトコールを開発し,ジャカリンを用いた分画が有効であることを示した38).
3)再生医療等治療用細胞の品質管理マーカー
レクチンマイクロアレイを用いた糖鎖プロファイリング技術は再生医療などの治療用細胞の品質管理にも有用であることが示されている.舘野らは多分化能を有する胚性幹(ES)細胞や人工多能性幹(iPS)細胞の膜上に発現する糖鎖構造を,分化前の体細胞の糖鎖プロファイルと比較解析した.その結果,未分化細胞群に共通の糖鎖構造の特徴として,Sia α2-6, Fuc α1-2, Galβ1-3Gal/ GlcNAcといったエピトープの存在が示唆された39).その後,質量分析法とグリコシダーゼ消化-HPLCマッピング解析によって,実際上記予想と合致した構造が同定された40).さらに興味深いことに,ES細胞やiPS細胞には迅速に結合するが,体細胞にはほとんど結合しない日和見菌(Burkholderia cenocepaci)由来の組換えレクチンドメインが見つかり,rBC2LCNと名づけられた39).rBC2LCNは大腸菌で容易に生産でき,生きた未分化細胞表層に鋭敏に結合するなど,再生医療分野において多くの活用法が見いだされている41–43).特に,本レクチンを緑膿菌由来毒素と結合したレクチン毒素複合体(lectin-drug conjugate:LDC)は,移植後に残存する可能性のある未分化細胞の除去剤としての可能性が示された44).驚いたことに,最近下村らによってLDCには膵がん幹細胞を標的化するレクチン医薬として高い効果があることが見いだされた45).予想外の展開である(2017年9月22日付,筑波大学プレスリリース;http://www.tsukuba.ac.jp/attention-research/p201709221400.html).LDCには新モダリティー医薬としての発展が期待される.
4)WFA高ヒットの謎
上述したようにがんに限らず疾患特異的な糖鎖変化を検出する最適のレクチンプローブとしてしばしばWFAが選択されるが,この理由は何だろう46).WFAの標的糖鎖は教科書的にはLacdiNAc構造(GalNAcβ1-4GlcNAc)とされるが,この構造は下垂体ホルモンなど特殊な分子にのみ発現が認められており,がん特異的なマーカーとしての記載はない.現時点で,ほとんどの疾患関連糖鎖マーカーの実際の糖鎖構造が同定されていないため,理由は不明だが,がんなどの疾患によって起こる高分岐化やラクトサミン構造の繰り返し,あるいは何らかの高次構造上の理由によってアセチル基を含む特定エピトープ構造の密集(クラスター)化が起こり,それがWFAとの異常な結合を促進するのかもしれない.本事実の原因究明は,生物認識における新たなパラダイムの創出やまだ見つかっていない新原理の発見につながるかもしれない.
レクチンマイクロアレイはイスラエルのグループによるバイオ医薬品糖鎖構造の予測ツールとして開発が始まった.その後筆者らのグループを含む複数の研究グループがそれぞれの解析プラットフォームを立ち上げ,糖鎖バイオマーカー探索や細胞表層糖鎖の迅速プロファイリング手段(研究支援ツール)としてさまざまな応用が図られてきた.技術開発グループの中でエバネッセント波励蛍光検出法を採用しているのは当グループのみであるが,本原理には多くの利点が備わることをあらためて強調しておく.エバネッセント法をベースとして開発された諸技術(糖鎖アレイ,抗体オーバーレイ)に加え,その高い感度,再現性によって取得された多くの生物情報やそこから派生する重要分子(糖タンパク質バイオマーカーなど)の同定は,今後の生命科学の発展や科学技術立国を目指すわが国産業の貴重な礎となるであろう.しかし,技術課題はまだ多く残され,今後取り組むべきテーマもみえてきた.以下,順不同となるが,それらを列挙する.
1)レクチンマイクロアレイ基盤の品質安定化
当該研究者らが中心となって開発したレクチンマイクロアレイシステムは,2003年の原理開発時からその基盤技術の大幅な変更を行っていない.当時進行したプロジェクト内の事情もあり,アレイ基盤に関する技術開発をあえてしなかった経緯がある(基盤が改良されること自体はよいことだが,そのことによって過去のデータとの整合性がどれなくなり,応用研究の進展に待ったがかかる懸念があった).しかし,レクチンマイクロアレイの性能向上のため,しかるべき改善は将来とられるべきである.第一に,製造側の課題として,良質なガラス基板やレクチン供給ラインの確保,レクチン固定化のプロトコールの標準化等が必要である.さらに,エバネッセント装置が複数の企業から複数種類製造される状況においては,各装置の適正な評価や公的機関による認証も必要になるだろう.レクチンマイクロアレイの使用人口が増加すれば,装置の自動化や解析ソフト・データの共有化もおのずと進むだろう.
2)レクチンエンジニアリング
現在アレイに固定化するレクチンは天然素材からの精製品が主体となっているが,将来は組換えレクチンにシフトすることを考慮すべきであろう.ただ,その際問題となるのが,大腸菌で生産が難しいレクチン(マメ科レクチン等)をどうするかである.コンカナバリンAは最も使われている代表的なレクチンであり,類似であっても他のレクチンに置き換えるのは容易ではない.しかし,組換えレクチンの使用に踏み切らなければ,安定化や特異性の改善をはじめ,さらなる改良化の途が拓けない.自然界に存在するレクチンをお手本にすることなく,人工的にde novoでレクチンを創出するアイデアも提示されている47).持続的に再現性の高い良質なデータをとるべきさまざまなレベルでの環境整備が必要である.
グリコサミノグリカンや硫酸化糖鎖に対するレクチンの不備を指摘する声をしばしば聞く.これらの糖鎖は生物機能的に重要なので,それらを標的にできない検出システムであってはならない.ただしこれには異論もある.そもそもそのような貴重な機能糖鎖の標準品が世の中にはないのが現状である.もしあっても安定的な入手が困難である場合が多い.現在,100を超えるレクチンドメイン(分子骨格)の存在が示唆されているので48),そのように多様なレクチン構造中にグリコサミノグリカンや硫酸化糖鎖に対し有意な結合性を示すレクチンが含まれる可能性は高い.事実,ガレクチンの仲間であるヤナギマツタケ(Agrocybe cylindracea)由来レクチンACGには3´硫酸化ラクトースに対し高い結合親和性があり49),逆にリシンB鎖と相同なレクチンの仲間や変異体には6´硫酸化ラクトースに対し強く結合するレクチンが見つかっている50).有用な人工レクチンの創出にはグリコサミノグリカンを含む標準糖鎖ライブラリーの供給体制が不可欠である.逆のケースも考えられる.レクチンの結合は天然糖鎖に限られるわけではないと考えられるので,非天然糖鎖のライブラリーを開発することで,まったく新たにレクチンの用途が見つかるかもしれない.
3)レクチンマイクロアレイに内在する問題:レクチン間競合
レクチンマイクロアレイ解析では,直接,間接的に蛍光標識した微量の糖鎖試料を同一ウエル内に固定化された多種類(20~200種)のレクチンと接触させ結合させる.この際,単純な構造の糖鎖でさえ複数のレクチンと結合する可能性がある.複雑な構造を持つ糖鎖やさまざまな糖タンパク質が含まれる血清などの場合はさらに事情が複雑になる.レクチンとの結合が速く量も多い糖鎖の場合,その結合シグナルは優先的に検出されるだろうが,結合が遅く量的にも少ない糖鎖エピトープであれば,主要な結合の方にレクチンを奪われ,有意なシグナルを検出するのは難しい.たとえば,A, B, Cという三つの糖タンパク質をそれぞれ独立に解析し,それらの結果(シグナル値)を統合した場合と,A, B, C三つの成分をあらかじめ混ぜて解析した結果は必ずしも同じにならないだろう.これはレクチンマイクロアレイという競合系プラットフォームに固有の問題であり,解析の際には留意すべき点である.これに関連して,最近,島崎らはプレシジョン・システム・サイエンス社と共同で“Bead array In a Single Tip”(BIST)という分析系を開発した51).BISTでは解析に用いるレクチン数を10程度と少なくするのが一般だが,より短時間(20分)で定量的な解析ができるという.今後の応用発展に期待したい.