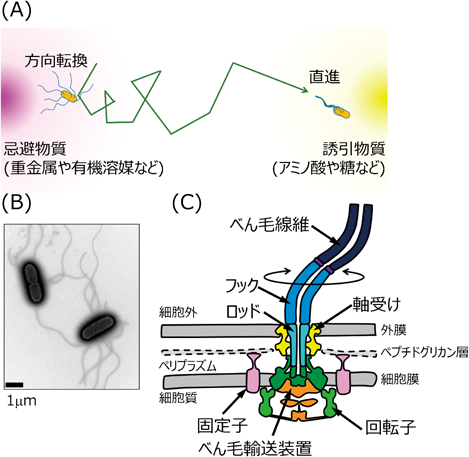
動くことは生物にとって非常に重要な機能である.動物は元より植物も太陽光を求めて枝を伸ばし,細菌もまた自分自身にとってより好ましい環境に向かって移動する(図1A).細菌が持つ特に主要な運動器官として,細菌べん毛があげられる.細菌べん毛は,細胞外に長く伸びたらせん状のタンパク質線維構造であり,これをスクリューのように回転させることで,水中を遊泳したり固体表面をはい回ったりすることが可能である(図1B, C).注意していただきたいのは,真核生物の「鞭毛」が微小管-ダイニン系の鞭打ち運動をするのに対して,細菌「べん毛」は起源がまったく異なる細胞小器官であり,べん毛の根元の細胞表層に埋まった回転モーターを,イオン駆動力を用いて回転させる.筆者は,この細菌べん毛がどのように構築され,そして回転するのか,そこに興味を持ちこれまで研究を続けてきた.しかしながら,細菌べん毛に興味がない方には,そもそも細菌べん毛の何がすごいのかよくわからないと思う.そこで,まずは細菌べん毛の「すごさ」をお伝えしたい.第一に,回転モーターによって駆動することがあげられる.我々人類にとって回転モーターは電気モーターでおなじみであるが,生物界ではとても珍しいシステムである.実質的には,FoF1-ATP合成酵素,VoV1-ATPase,そして細菌べん毛の3種類である.さらに細菌べん毛のすごいところは,大腸菌で秒速300回転,ビブリオ菌においては驚くべきことに秒速1700回転という超高速回転が可能なところである.その上,左右両方向に回転方向を切り替えることができる1, 2).秒速1700回転を分速に換算すると10万回転であるので,皆さんが研究室で使う卓上超遠心機に匹敵する速度である.これだけでも細菌べん毛の驚異的な機能の一端をおわかりいただけると思う.第二に,20数種類のタンパク質が合計数万分子集合して構築される超分子タンパク質複合体であることがあげられる.細菌べん毛の大部分は細胞外に構築されるため,細胞膜を横断して構成タンパク質を細胞外へと分泌する必要がある.その機能を担っているのがべん毛タンパク質特異的輸送装置である3).一般的なタンパク質の膜透過は,原核生物から真核生物までSecトランスロコン系が担っているが,細菌には毒素や病原因子の分泌,細菌べん毛や線毛の構築に働く特異的タンパク質分泌装置が複数存在しており,輸送メカニズムの違いから大きくI型からIX型に分類されている.そのうちの一つであるIII型分泌系には,細菌べん毛とインジェクチソーム(あるいはIII型分泌装置と呼ばれる)が含まれ,腸管出血性大腸菌O-157やサルモネラ属菌において宿主感染に決定的に重要な働きをする4).細菌べん毛とインジェクチソームは,アミノ酸配列,構成タンパク質の構造,複合体構造に至るまで相同性を有し,共通祖先から進化した細胞小器官であると考えられている.III型分泌系はSecトランスロコンと比べるとその複合体構造は非常に複雑で,べん毛輸送装置では,ハウジングとスキャホールド(MSリング,Cリング)を含めると計12種類の構成タンパク質からなる約7 MDaの巨大複合体を形成する.中心部のべん毛輸送装置は,細胞内で翻訳された構成タンパク質を計2万分子以上細胞外へと分泌し,それが集合することで細菌べん毛が構築される.このように,細菌べん毛はまさに生物の持つ分子ナノマシンといっても過言ではなく,私自身この研究が遠い未来にSFで描かれるような「生体ナノマシン」への萌芽になるのではないかと夢見ている.本稿では,私がこれまでに行ってきた研究を中心に,(1)ビブリオ菌のべん毛モーターがなぜ秒速1700回転できるのか,その構造基盤について,(2)べん毛タンパク質輸送装置がタンパク質分泌を駆動する仕組みについて紹介する.
細菌べん毛の構造は種を超えて保存されており,機能的に分けて大きく五つの部分から構成されている(図1C)5).(1)回転する部分である回転子,(2)回転子を回転させるために必要なエネルギー変換を行う固定子,(3)回転子の回転を保持するための軸受け(ただし外膜を持つグラム陰性菌のみ),(4)回転子とつながる軸構造(ロッド,フック,線維),(5)軸構造を構築するためのタンパク質膜透過装置であるべん毛輸送装置である.回転子は,細胞膜上のMSリングと,MSリングの細胞質側に結合したCリングから構成される.MSリングのペリプラズム(グラム陰性菌が持つ細胞膜と外膜の間の細胞外空間)側には,べん毛輸送装置によって分泌された軸構造タンパク質が軸構造として積みあがっていき,べん毛線維構造が構築される.軸受けであるLリング,Pリング(以下LPリングと記述)は,バリア機能を持つ外膜に軸構造が接しないようにするために,軸構造を囲むように形成される.固定子は,Aサブユニット4個,Bサブユニット2個からなるヘテロ六量体の膜タンパク質複合体(大腸菌・サルモネラ菌はMotA/MotB,ビブリオ菌はPomA/PomB)であり,回転子の周りに最大で10数個の複合体が集合する.固定子複合体内を共役イオン(ほとんどの場合H+かNa+)が透過するとき,固定子複合体の構造変化と,それに伴うCリングとの相互作用が誘起され,回転力が発生すると考えられている.
3. 超高速回転するビブリオ菌べん毛に特徴的な新規リング構造の発見
上記のように,べん毛の基本構造は種を超えて共通しているが,回転速度やトルクの大きさは種ごとに大きく異なっている.代表的な例として,ビブリオ菌べん毛は大腸菌べん毛より5倍以上速い秒速1700回転で回転することができる2).しかしながら,他の菌と同じ構造で本当にこの超高速回転は保持できるものだろうか? つまり「普通自動車にF1マシンのエンジンを積んでも大丈夫か?」ということである.実はその答えは「No」であり,ビブリオ菌の軸受け周辺には大腸菌には存在しない付加的な構造が存在している.まずは,筆者が発見した付加的構造であるTリングとHリングについて紹介する.
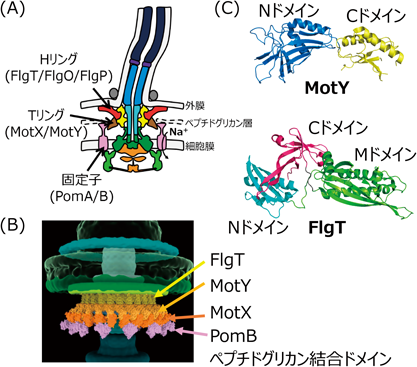
この研究が始まったとき,筆者が所属していた本間研究室では,MotX, MotYという2種類のタンパク質がべん毛の回転機能に必須であることを見いだしていた6, 7).MotX, MotYはビブリオ菌など一部の細菌にしか存在しないタンパク質であり,ペリプラズムに存在する8).しかしながら,べん毛の回転は細胞膜直下の固定子–回転子間相互作用によって生じるため,MotX/MotYが細胞膜外であるペリプラズムからどのようにして回転力発生に関与するのか不明であった.そのような背景において,筆者は,単離したべん毛基部体(回転子,ロッド,フック,軸受けの複合体)画分中にMotX, MotYが含まれていることを見いだした9).また,電子顕微鏡で基部体を観察すると,大腸菌の基部体よりもLPリング周辺が幅広で,突起状の構造が存在していた.これにより,突起状構造がMotX/MotYで形成されている可能性が浮上した.そこで,motX/motYを欠損させ,その変異体から基部体を精製すると,突起状構造が失われることを見いだした.これらの結果から,この構造をTリングと名づけ,MotX/MotYから構成されていることを明らかにした(図2A).
しかしながら,motX/motY欠損変異体から精製した基部体には,まだLPリング周辺の幅広構造が残っていた.この結果は,未知のタンパク質がLPリング周辺に結合している可能性を示唆していた.その候補となるタンパク質として,基部体画分に含まれるタンパク質を同定する過程で,FlgTというペリプラズムタンパク質を見いだした10).FlgTが欠損すると,コレラ菌においてべん毛が抜けやすくなることが報告されており11),筆者はFlgTが幅広構造を形成するのに必要ではないかと考えた.flgT欠損変異体の基部体では,幅広構造と突起構造の両方が失われていたことから,幅広構造をHリングと名づけ,FlgTが両方の構造の形成中心になっていることを明らかにした(図2A)10).FlgT欠損によって,ビブリオ菌のべん毛形成効率は大きく低下することから,Hリング形成はビブリオ菌のべん毛形成に重要な働きがあることが示唆された.またさらに,クライオ電子線トモグラフィー解析によって,FlgO, FlgPという外膜タンパク質がHリングの構造を形成することを報告している(図2A)12–14).これらの結果から,ビブリオ菌ではTリング,Hリングという付加的な構造が存在しており,これらがビブリオ菌のべん毛形成・回転に重要な役割を持つことが示された.また,最近ビブリオ菌べん毛基部のクライオ電子線トモグラフィー解析から,詳細なTリング,Hリングの超分子構造を明らかにすることができた.LPリングの周囲に形成されるTリング,Hリングの密度には,MotY, FlgTの結晶構造とMotXの推定構造モデル各26分子を矛盾なく当てはめることができた.(図2B)14).また,Tリングの先端にはさらに別の密度が存在し,PomBのペプチドグリカン結合ドメインの結晶構造を13分子当てはめることができた.この密度は固定子タンパク質欠損変異体(ΔpomAB)で消失したことから,Tリングに固定子タンパク質が相互作用するようすを示している.
ビブリオ菌のTリング,Hリングが,べん毛形成・回転機能に重要であることが示されたので,次に詳細な分子メカニズムの解明を目指した.そのためにMotYとFlgTのX線結晶構造解析を行った(図2C)15, 16).MotYは,新規フォールドを持つNドメインとペプチドグリカン結合モチーフを持つCドメインから構成されていた15).基部体の電子顕微鏡観察とイムノブロットの結果から,MotYはNドメインを介して基部体およびMotXと結合することが示された.motY欠損変異体では,MotXが基部体に結合しないことから,基部体にMotYが結合し,その先にMotXが結合することが示唆された.さらに,MotX, MotYの欠損によってべん毛が回転しなくなることから,固定子との相互作用が存在することが推測された.そこで,固定子複合体にGFPを融合し,野生型とmotX/motY欠損変異体内での蛍光局在を観察した.その結果,野生型ではべん毛周辺に固定子複合体が集合するのに対して,変異体では集合しなかった9).これは,Tリングが固定子のモーター内への組込みを行っていることを示している.この結果は,MotXとPomBが相互作用するという生化学的なデータとも一致している17).さらに,上記のようにクライオ電子線トモグラフィー法によって,Tリングの先端にPomBのペプチドグリカン結合ドメインと一致する密度が存在し,MotXと相互作用していた14).この結果もMotXとPomBの相互作用によって固定子がモーター内に組み込まれるということを強く示している.
次に,FlgTのX線結晶構造解析の結果から,FlgTはN, M, Cの三つのドメインから構成されていることが明らかになった16).基部体の電子顕微鏡観察とイムノブロットの結果から,FlgTはMドメインによって基部体に結合し,Tリング,Hリング形成のスキャホールドになることが示された.また,Nドメインの欠損でHリングの大部分が失われることから,NドメインがHリングの形成に特に重要であることが示された.クライオ電子線トモグラフィー観察の結果から,Hリングの外膜接触部はFlgOとFlgPによって構築されているため,FlgTを足場としてFlgO/FlgPがHリングへ集合するのかもしれない12–14).
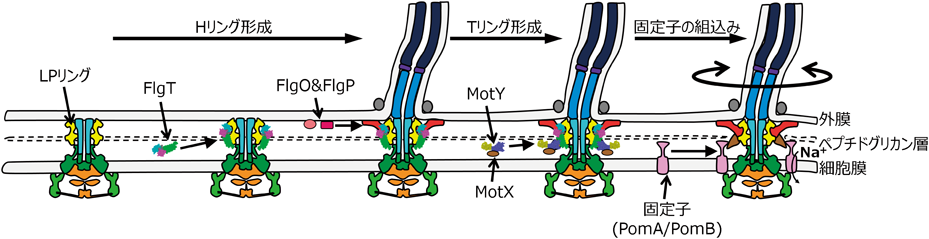
これまでの研究をまとめ,ビブリオ菌べん毛モーターの形成過程を提案した(図3).まず,基部体にFlgTがMドメインを介して結合する.そしてFlgTのNドメインを起点としてFlgO/FlgPが結合しHリングが形成される.次に,FlgTが起点になりMotY/MotXが集合しTリングが形成される.Tリングは,MotXを介して固定子をモーター内に組み込み,安定化する.ビブリオ菌のべん毛モーターでは,Hリングが外膜と相互作用,Tリングが固定子とペプチドグリカン層と相互作用し,強固で安定なモーター構造を形成すると考えられる.Tリング,Hリングは,ビブリオ菌の驚異的な回転速度を作るために固定子をべん毛モーター内で安定化し,かつ回転を保持するための強化フレームのような機能を持つことを明らかにすることができた.
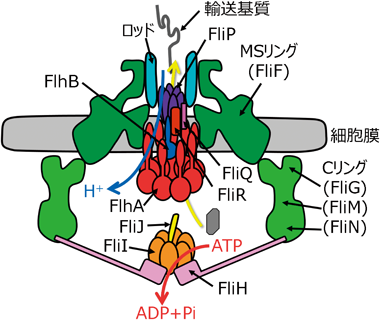
ここまでビブリオ菌べん毛の超高速回転を可能にする構造基盤について紹介してきたが,次にべん毛輸送装置の分泌メカニズムについて,最近筆者らが確立したin vitroタンパク質輸送実験系を使って明らかにした知見を中心に紹介する.細菌べん毛は,細胞外に長く伸びた構造であるため,細胞内から細胞外へとタンパク質を輸送しなければならない.タンパク質の分泌を担っているのは,MSリングとCリングの内側に集合するべん毛輸送装置である(図4).べん毛輸送装置はIII型分泌系に属するタンパク質輸送体で,病原性タンパク質を宿主細胞内に直接注入する「分子注射器」インジェクチソーム(あるいはIII型分泌装置)と同じファミリーに属している3, 4).べん毛輸送装置は,細胞膜上で輸送ゲート複合体を形成する膜タンパク質FlhA, FlhB, FliP, FliQ, FliRと,ATPase複合体である細胞質タンパク質FliH, FliI, FliJから構成される3).まず,細胞質で翻訳されたべん毛軸構造タンパク質は,輸送ゲート複合体へターゲティングされる.べん毛輸送装置は,プロトン駆動力とアデノシン5′-三リン酸(adenosine 5′-triphosphate:ATP)加水分解エネルギーを利用し,基質タンパク質のアンフォールドを行いながら膜透過を行う18–21).ATPaseであるFliIとその結合タンパク質FliHが欠損しても軸構造タンパク質はわずかに分泌されるが,カルボニルシアニド-m-クロロフェニルヒドラゾン(carbonyl cyanide m-chlorophenyl hydrazone:CCCP)でプロトン駆動力を消失させると分泌が止まるため,プロトン駆動力が分泌に必須なエネルギー源であることが示唆されている.また,ATPase複合体が存在すると分泌活性が著しく高まることから,ATP加水分解エネルギーが分泌活性の亢進に使われていることが示唆されている.
細胞外へと分泌された軸構造タンパク質は,べん毛軸構造が形成するチューブ空間内を拡散によって移動し,軸構造の先端で複合体構造内へと取り込まれる22).べん毛軸構造は,MSリングのペリプラズム側に順に集合し構築される5).まず,FliEがMSリングのペリプラズム側に相互作用する.次に,FlgB, FlgC, FlgFからなるプロキシマルロッドが形成され,さらにFlgGからなるディスタルロッドが形成される.ロッドが形成されるとき,ロッドの先端にロッドキャップFlgJが相互作用することが必要である.キャップ構造はロッド,フック,フィラメントに対応してそれぞれ1種類ずつ存在し,各軸構造タンパク質の線維構造内への組込みをアシストしている.ディスタルロッドの周囲にはLPリングが集合し軸受けを形成する.ロッドが外膜を突き抜けた後,ロッドの先端には,FlgJに代わりフックキャップFlgDが相互作用する.フックタンパク質FlgEが,軸構造先端とFlgDキャップの間で軸構造内へと組み込まれ,フックが形成される.フックはユニバーサルジョイントと呼ばれ,べん毛線維の角度を自由に変えることができる自由継手として働く.フックが55 nmの長さまで集合すると,次にFlgK, FlgLからなるフック-フィラメントジャンクションが形成される.ジャンクションの先端にフィラメントキャップFliDが相互作用し,最終的にべん毛線維タンパク質フラジェリンが軸構造内に組み込まれ,フィラメントが形成される.フラジェリンは数万分子集合し,フィラメントの長さは10 µmに達する.
べん毛形成は,遺伝子発現とも密接にリンクしている.べん毛遺伝子群全体の発現は,マスターレギュレーターと呼ばれる転写因子によって制御されている23).大腸菌やサルモネラ菌ではFlhD/FlhC複合体であり,ビブリオ菌や緑膿菌ではFleQ(FlaK)である24, 25).マスターレギュレーターによってクラス2と呼ばれる基部体,べん毛輸送装置,ロッド,フックの構成タンパク質が発現する.一方でロッド/フック構造が構築されている間,フラジェリンや固定子タンパク質の発現は抑制されている.また,そもそもべん毛輸送装置は,初めロッド/フック型タンパク質のみを認識し分泌している.分子物差しタンパク質と呼ばれるFliKは,ロッド/フック構築中に時折分泌されているが,フックの長さが55 nmに達していないとき,細胞外へと放出される.一方で,フックが55 nmに達すると,FliKのC末端ドメインと輸送ゲートFlhBが相互作用し,輸送基質の特異性が切り替わる26, 27).基質特異性が切り替わったべん毛輸送装置は,アンチシグマ因子FlgMを細胞外へと放出し,シグマ因子FliAが活性化する.FliAはクラス3に属するフィラメント型タンパク質の発現を誘導し,べん毛輸送装置を介してフィラメント型タンパク質が認識され分泌される.
ここまで示してきたように,べん毛構築の分子メカニズムやエネルギー変換については多くの知見が得られている.しかしながら,細菌細胞を使ったin vivoでの研究では実験条件の制御に限界があった.たとえば,生物には恒常性があるため,プロトン駆動力や細胞内ATPをゼロにすることは困難である.また,べん毛タンパク質以外の要素がべん毛タンパク質分泌に与える影響について完全には排除できない.こういったことから,さらなる詳細な分子メカニズムの解明のためには,実験条件を厳密に制御することが可能な実験系を必要としていた.そこで筆者らは,べん毛タンパク質の分泌をin vitroで機能的に再現することを目指した.in vitro再構成実験系では,実験系に与えるエネルギー源やタンパク質の種類・濃度を厳密に制御できるというメリットがある.
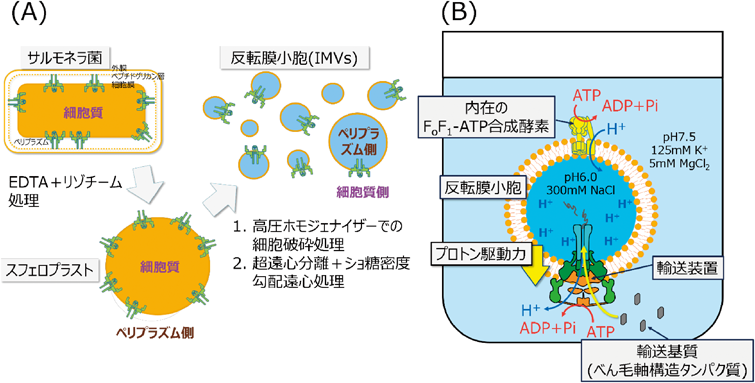
一般的に,in vitro再構成実験系はターゲットタンパク質を精製し,試験管内で機能的に再構成し,活性を計測する.しかしながら,べん毛輸送装置は巨大な膜タンパク質複合体であるため,機能を保った状態で精製することは困難であるし,これまで誰も成功していなかった.そこで筆者らは,別のアプローチとして,反転膜小胞を用いたin vitro輸送再構成実験系の構築を試みた(図5)28–30).反転膜小胞を利用するメリットは,反転膜小胞が細胞膜由来の膜小胞であるため,べん毛輸送装置を精製・脂質再構成する必要がないことである.また,細胞膜の裏表が逆転しているため,細胞質側の条件を任意に制御することが可能である.さらに,反転膜作製時に懸濁する溶液の組成によってペリプラズム側の溶液条件も規定することが可能である.
筆者らは,サルモネラ菌のべん毛輸送装置をターゲットに実験系の構築を行った28).まず,反転膜小胞を作製するための変異体の作製を行った.サルモネラ菌は通常8本程度のべん毛が形成されるが,より分泌活性を検出しやすくするために,べん毛本数を増やすための遺伝子操作を行った.まずはマスターレギュレーターFlhD/FlhCをプラスミドから発現し,またFlhD/FlhCの抑制因子であるfliTを欠損させ,べん毛遺伝子群の発現量を増加させた.次に,ロッドより先の構造を構築させないようにするために,フックキャップタンパク質flgDを欠損させた.さらに,基質タンパク質としてロッド/フック型基質に属するFlgDを利用することを計画したため,ロッド/フック型基質からフィラメント型基質へ基質特異性が変化しないFlhB(N269A)変異体31)を発現させた.このような遺伝的バックグラウンドのサルモネラ菌株を用いて,反転膜小胞の作製を行った(図5A).まず,培養した菌体を,リゾチームとエチレンジアミン四酢酸(ethylenediaminetetraacetic acid:EDTA)で処理し,ペプチドグリカン層と外膜を除去しスフェロプラストを形成させた.スフェロプラストは高圧ホモジェナイザー(いわゆるフレンチプレス)で破砕し,反転膜小胞を形成させた.学会などで頻繁に受ける質問として,なぜ高圧ホモジェナイザーによる細胞破砕で膜が反転するのか聞かれるが,実際のところ詳細な理屈は十分に理解されていない.膜画分を超遠心分離で回収後,ショ糖密度勾配遠心分離法によって,反転膜小胞をDNAや凝集体,残存外膜から分離した.
次に,in vitro輸送再構成実験を行った.この実験系の仕組みを以下に示した(図5B).まずATPを反転膜溶液に加える.反転膜は細胞膜由来の膜小胞であるため,内在性のFoF1-ATP合成酵素の逆反応によって,反転膜小胞内にプロトンが汲み上げられる.これによって,反転膜に膜電位が形成される.また,反転膜形成時に,膜内をpH 6.0, 300 mM NaClで満たしており,外液はpH 7.5, 125 mM KClに置き換えてある.そのため,イオン濃度/pH勾配が反転膜を隔てて内外に与えられている.これらによって反転膜小胞にプロトン駆動力を形成させた.べん毛輸送装置は,プロトン駆動力を使い,基質タンパク質を反転膜小胞内へと輸送する.実験条件は,ある程度任意に変更することが可能である.たとえばFoF1-ATP合成酵素による膜電位の形成がない条件を調べたいときは,FoF1-ATP合成酵素欠失変異体(呼吸鎖が止まっても解糖系で生育できる)から反転膜を調製することが可能である.また,反転膜溶液中にATPase複合体を形成するFliH2/FliIを加えることによって,ATPase複合体によるATP加水分解エネルギーの効果を検証することが可能である.このように,エネルギー状態,輸送基質の種類と濃度,ATPase複合体コンポーネントの種類と濃度を自由に制御することができるin vitro再構成実験系が構築できた.
10. in vitro輸送再構成実験系によるべん毛軸構造の構築過程の再構成
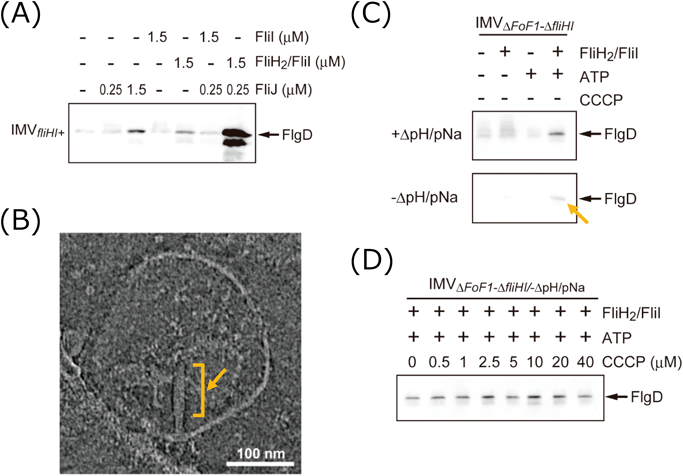
まず,反転膜小胞溶液に,輸送基質タンパク質FlgD, ATPase複合体のコンポーネントの一つFliJ,そしてATPを加えてin vitro輸送再構成実験を行った.ATPを加えると,上記のようにプロトン駆動力が発生し,FlgDの反転膜内への輸送がイムノブロットによって検出できた.一方で,プロトンイオノフォアCCCPを加えると,プロトン駆動力が壊れ輸送は検出されなかった.このことから,プロトン駆動力に依存したタンパク質分泌を試験管内で再現できたと結論した.次に,ATPase複合体のコンポーネントであるFliH2/FliIを加えて同様に実験を行った.それにより,輸送活性を劇的に上昇させることに成功した(図6A).この結果は,in vivoで観察されているATPase複合体による輸送活性の促進を再現したものである.
さらに,反転膜内へのタンパク質の輸送が,べん毛軸構造形成を正常に起こすかどうか確かめた.輸送基質にFlgDに加えフックタンパク質FlgEを追加し,同様にin vitro輸送再構成実験を行った.輸送反応後にクライオ電子線トモグラフィーで反転膜を観察すると,反転膜内部にフック構造が構築されていることを観察することができた(図6B).これらの一連の実験から,筆者らは細胞内でみられるべん毛タンパク質の分泌と構造構築をin vitroで機能的に再現することに成功したと結論づけた.フックの構築には成功したが,この実験条件では基質特異性の切り替わらないFlhB(N269A)変異体の反転膜を使い,また,溶液中に分子物差しタンパク質FliKを加えていないため,ひたすらフック構造が伸びるポリフックを形成していた.そこで,in vitro輸送再構成実験系でも正常なフック長55 nmに制御できるかどうか,野生型FlhBを発現させた反転膜溶液にさらにFliKを追加してin vitro輸送再構成実験を行った.FliKを加えないときに形成されるフックの長さはまちまちだが,FliKを加えたときにはおおよそ55 nmに制御することができた.この結果は,FliKによって基質特異性が切り替わり,ロッド/フック型タンパク質の分泌が停止したことを示している.また,FliKを加えるだけでフック長が制御されたことは,フックの長さ制御はFliKによって必要十分に決定されていることを示している.
ここまでで,フックの長さ制御と基質特異性の切り替えまで再現することに成功した.そこで次に,筆者らはその先を目指した.すなわちフィラメント構築の再現である30).フックまで形成させた反転膜を超遠心分離によって回収し,フィラメント型タンパク質,ATPase複合体,ATPを含む溶液で懸濁し,in vitro輸送再構成実験を行った.フィラメント型タンパク質には,フィラメントタンパク質FliC,フィラメントキャップタンパク質FliD,フック-フィラメントジャンクションタンパク質FlgK, FlgLを,ペアとなる特異的分子シャペロンタンパク質(それぞれFliS, FliT, FlgN)との複合体として与えた.その結果,正常な長さのフックの先にフィラメント構造を構築することに成功した.次に,フック構築,フィラメント構築が,べん毛輸送装置と軸構造タンパク質に依存したプロセスかどうか調べた.そこで,フック形成に必要なタンパク質(FlgD, FlgE, FliK)とフィラメント形成に必要なタンパク質(FliC/FliS, FliD/FliT, FlgK/FlgN, FlgL/FlgN)すべてを同時に反応溶液に加え,in vitro輸送再構成実験を行った.その結果,先ほどの実験同様に正常なフックの先にフィラメントが形成された.これら一連の結果は,フィラメントまでのすべてのべん毛軸構造構築をin vitroで再現することに成功したことを示している.この結果から示唆されることは,べん毛軸構造構築は,べん毛輸送装置,軸構造タンパク質,分子物差しタンパク質FliKによって達成されるプロセスであるということである.そして,べん毛構築における遺伝子発現との共役は,べん毛形成の効率化・最適化のための機能であることを示唆している.
11. 新たに見いだしたべん毛輸送装置のエネルギー変換メカニズム
筆者らは,構築したin vitro輸送再構成系を使い,べん毛輸送装置のタンパク質分泌におけるエネルギー変換を解析することにした28).これまでのin vivoの研究から,プロトン駆動力が輸送のエネルギー源であり,ATP加水分解エネルギーがそれを促進していると考えられていた18–20).しかしながら,細胞内でプロトン駆動力を壊すと,呼吸鎖によるATP合成が止まるので細胞内ATPは速やかに枯渇するように思われる.すなわち,in vivoでの実験では,プロトン駆動力が存在しないがATPが存在するという条件を検討することが困難である.そのため,分子メカニズムの点からは,べん毛輸送装置がATP加水分解エネルギーでタンパク質分泌を駆動できるのかどうかは不明である.筆者らのin vitroの実験系は,そのようなエネルギー条件の厳密な制御が可能である.これまでの実験から,プロトン駆動力依存的なタンパク質輸送とATP加水分解エネルギーによる輸送促進は再現することができた.そこで次に,プロトン駆動力が完全に失われたがATPが存在する条件で輸送が起きるかどうか検証した.プロトン駆動力は,反転膜内外のpH/イオン濃度差と,内在性FoF1-ATP合成酵素の逆反応によるプロトン汲み上げによって形成される.そのため,サルモネラ菌株からFoF1-ATP合成酵素の遺伝子を欠損させ,反転膜内外のpH/イオン濃度条件を同一にし,反転膜にプロトン駆動力が生じないようにした.このようにして作製した反転膜に対して,輸送基質タンパク質,ATPase複合体,ATPを加えてin vitro輸送再構成実験を行ったところ,わずかではあるが輸送活性を保持していることを見いだした(図6C).さらに,この条件にCCCPを加えることによって完全にプロトン駆動力を破壊したが,なお輸送を検出することができた(図6D).この結果は,べん毛輸送装置にとってプロトン駆動力が必須ではないことを示している.次に,ATPaseであるFliIの活性中心残基E211をQに置換し不活性化した変異体を加えたとき,輸送が起きるかどうか確かめた.しかしながら,FliI(E211Q)を加えた条件では輸送は起こらなかったことから,FliIによるATP加水分解が,べん毛輸送装置のタンパク質分泌に必要であることが示された.これら一連の実験を通して,これまでプロトン駆動力が分泌に必須であり,ATP加水分解エネルギーがそれを促進しているというモデルに対して,筆者らは,べん毛輸送装置はプロトン駆動力でもATP加水分解エネルギーでもどちらのエネルギー源を使っても分泌を駆動できる「ハイブリッドエンジン」型分泌装置であることを提案した.また,両方のエネルギーが存在したとき,輸送活性は相乗的に高まることから両者は協調的に働いていることが示唆された.では,べん毛輸送装置はなぜこのようなロバストなシステムになったのだろうか? 細菌は栄養条件が乏しい環境下でべん毛を形成し運動能を発揮する.べん毛の構築には,細胞分裂と同じ程度の時間がかかる上に,数万分子のタンパク質を翻訳,分泌しなければならない.これにかかるエネルギーコストは非常に大きい.それにもかかわらず低栄養条件でべん毛を形成,運動するのは,生存のためにはべん毛形成と運動という多大なエネルギーコストを支払ってでもその環境から逃れることが重要であることを示唆している.そういった細菌の生存戦略において,プロトン駆動力の一時的な消失やATPの一時的な枯渇によってべん毛形成が滞ることは,生死を分ける事態であると思われる.そのため,どんな環境でもべん毛形成を継続できるよう2種類のエネルギー源をハイブリッドに利用できるロバストなシステムを進化させたのではないだろうか?
これまでに紹介したように,細菌べん毛は興味深い機能を持つ細胞小器官である.しかしながら,いまだ分子レベルでの作動メカニズムという点において十分な研究がなされていない.その大きな原因は,in vitroで精密に条件を制御した状態での機能計測系が確立できていないからである.筆者らが確立したin vitro輸送再構成計測系は,タンパク質分泌の分子レベルでの作動メカニズムを明らかにするための第一歩である.今後,よりピュアな実験系,すなわちべん毛輸送装置の精製・脂質膜再構成を行う完全in vitro再構成を構築できれば飛躍的に研究が発展するだろう.また,べん毛輸送装置はIII型分泌系に属することから,感染症との関わりが深い.in vitro輸送再構成計測系は,タンパク質分泌阻害剤をスクリーニングするための格好なアッセイ系であると考えている.さらに,べん毛の回転メカニズムについても,in vitro再構成系の構築を目指すことは重要な課題である.FoF1-ATP合成酵素やミオシン・キネシン等のモーター分子の作動メカニズムの解明にはin vitroでの一分子計測の発展が大きく貢献した.細菌べん毛でも同様に,生化学的な再構成系の確立が決定的な貢献をすることが期待されている.
謝辞Acknowledgments
本研究は,名古屋大学大学院理学研究科本間道夫教授の研究室,および大阪大学大学院理学研究科今田勝巳教授の研究室において行いました.本間道夫教授,今田勝巳教授,小嶋誠司准教授,佐久間麻由子講師,薬師寿治博士(現山口大学大学院創成科学研究科教授),福岡創博士(現大阪大学大学院生命機能研究科准教授),また,大阪大学大学院生命機能研究科難波啓一特任教授(名誉教授・栄誉教授),南野徹准教授,川本晃大博士(現大阪大学蛋白質研究所助教),米国Yale大学Jun Liu博士,Shiwei Zhu博士ら多数の共同研究者の助けを借りて行いました.この場を借りて厚く御礼申し上げます.
引用文献References
1) Lowe, G., Meister, M., & Berg, H.C. (1987) Rapid rotation of flagellar bundles in swimming bacteria. Nature, 325, 637–640.
2) Magariyama, Y., Sugiyama, S., Muramoto, K., Maekawa, Y., Kawagishi, I., Imae, Y., & Kudo, S. (1994) Very fast flagellar rotation. Nature, 371, 752.
3) Minamino, T. (2018) Hierarchical protein export mechanism of the bacterial flagellar type III protein export apparatus. FEMS Microbiol. Lett., 365.
4) Cornelis, G.R. (2006) The type III secretion injectisome. Nat. Rev. Microbiol., 4, 811–825.
5) Terashima, H., Kojima, S., & Homma, M. (2008) Flagellar motility in bacteria: structure and function of flagellar motor. Int. Rev. Cell Mol. Biol., 270, 39–85.
6) Okunishi, I., Kawagishi, I., & Homma, M. (1996) Cloning and characterization of motY, a gene coding for a component of the sodium-driven flagellar motor in Vibrio alginolyticus. J. Bacteriol., 178, 2409–2415.
7) Okabe, M., Yakushi, T., Asai, Y., & Homma, M. (2001) Cloning and characterization of motX, a Vibrio alginolyticus sodium-driven flagellar motor gene. J. Biochem., 130, 879–884.
8) Okabe, M., Yakushi, T., Kojima, M., & Homma, M. (2002) MotX and MotY, specific components of the sodium-driven flagellar motor, colocalize to the outer membrane in Vibrio alginolyticus. Mol. Microbiol., 46, 125–134.
9) Terashima, H., Fukuoka, H., Yakushi, T., Kojima, S., & Homma, M. (2006) The Vibrio motor proteins, MotX and MotY, are associated with the basal body of Na+-driven flagella and required for stator formation. Mol. Microbiol., 62, 1170–1180.
10) Terashima, H., Koike, M., Kojima, S., & Homma, M. (2010) The flagellar basal-body associated protein, FlgT, essential for a novel ring structure in sodium-driven Vibrio motor. J. Bacteriol., 192, 5609–5615.
11) Martinez, R.M., Jude, B.A., Kirn, T.J., Skorupski, K., & Taylor, R.K. (2010) Role of FlgT in anchoring the flagellum of Vibrio cholerae. J. Bacteriol., 192, 2085–2092.
12) Beeby, M., Ribardo, D.A., Brennan, C.A., Ruby, E.G., Jensen, G.J., & Hendrixson, D.R. (2016) Diverse high-torque bacterial flagellar motors assemble wider stator rings using a conserved protein scaffold. Proc. Natl. Acad. Sci. USA, 113, E1917–E1926.
13) Zhu, S., Nishikino, T., Kojima, S., Homma, M., & Liu, J. (2018) The Vibrio H-ring facilitates the outer membrane penetration of the polar sheathed flagellum. J. Bacteriol., 200, e00387–e18.
14) Zhu, S., Nishikino, T., Takekawa, N., Terashima, H., Kojima, S., Imada, K., Homma, M., & Liu, J. (2020) In situ structure of the Vibrio polar flagellum reveals distinct outer membrane complex and its specific interaction with the stator. J. Bacteriol., 202, e00592–e19.
15) Kojima, S., Shinohara, A., Terashima, H., Yakushi, T., Sakuma, M., Homma, M., Namba, K., & Imada, K. (2008) Insights into the stator assembly of the Vibrio flagellar motor from the crystal structure of MotY. Proc. Natl. Acad. Sci. USA, 105, 7696–7701.
16) Terashima, H., Li, N., Sakuma, M., Koike, M., Kojima, S., Homma, M., & Imada, K. (2013) Insight into the assembly mechanism in the supramolecular rings of the sodium-driven Vibrio flagellar motor from the structure of FlgT. Proc. Natl. Acad. Sci. USA, 110, 6133–6138.
17) Okabe, M., Yakushi, T., & Homma, M. (2005) Interactions of MotX with MotY and with the PomA/PomB sodium ion channel complex of the Vibrio alginolyticus polar flagellum. J. Biol. Chem., 280, 25659–25664.
18) Minamino, T. & Namba, K. (2008) Distinct roles of the FliI ATPase and proton motive force in bacterial flagellar protein export. Nature, 451, 485–488.
19) Paul, K., Erhardt, M., Hirano, T., Blair, D.F., & Hughes, K.T. (2008) Energy source of flagellar type III secretion. Nature, 451, 489–492.
20) Minamino, T., Morimoto, Y.V., Hara, N., & Namba, K. (2011) An energy transduction mechanism used in bacterial flagellar type III protein export. Nat. Commun., 2, 475.
21) Minamino, T., Kinoshita, M., Inoue, Y., Morimoto, Y.V., Ihara, K., Koya, S., Hara, N., Nishioka, N., Kojima, S., Homma, M., et al. (2016) FliH and FliI ensure efficient energy coupling of flagellar type III protein export in Salmonella. MicrobiologyOpen, 5, 424–435.
22) Iino, T. (1974) Assembly of Salmonella flagellin in vitro and in vivo. J. Supramol. Struct., 2, 372–384.
23) Chilcott, G.S. & Hughes, K.T. (2000) Coupling of flagellar gene expression to flagellar assembly in Salmonella enterica serovar typhimurium and Escherichia coli. Microbiol. Mol. Biol. Rev., 64, 694–708.
24) Dasgupta, N., Wolfgang, M.C., Goodman, A.L., Arora, S.K., Jyot, J., Lory, S., & Ramphal, R. (2003) A four-tiered transcriptional regulatory circuit controls flagellar biogenesis in Pseudomonas aeruginosa. Mol. Microbiol., 50, 809–824.
25) Kim, Y.K. & McCarter, L.L. (2004) Cross-regulation in Vibrio parahaemolyticus: compensatory activation of polar flagellar genes by the lateral flagellar regulator LafK. J. Bacteriol., 186, 4014–4018.
26) Hirano, T., Shibata, S., Ohnishi, K., Tani, T., & Aizawa, S. (2005) N-terminal signal region of FliK is dispensable for length control of the flagellar hook. Mol. Microbiol., 56, 346–360.
27) Minamino, T., Ferris, H.U., Moriya, N., Kihara, M., & Namba, K. (2006) Two parts of the T3S4 domain of the hook-length control protein FliK are essential for the substrate specificity switching of the flagellar type III export apparatus. J. Mol. Biol., 362, 1148–1158.
28) Terashima, H., Kawamoto, A., Tatsumi, C., Namba, K., Minamino, T., & Imada, K. (2018) In vitro reconstitution of functional type III protein export and insights into flagellar assembly. MBio, 9, e00988–e18.
29) Terashima, H. & Imada, K. (2018) Novel insight into an energy transduction mechanism of the bacterial flagellar type III protein export. Biophys. Physicobiol., 15, 173–178.
30) Terashima, H., Tatsumi, C., Kawamoto, A., Namba, K., Minamino, T., & Imada, K. (2020) In Vitro Autonomous Construction of the Flagellar Axial Structure in Inverted Membrane Vesicles. Biomolecules, 10, E126.
31) Fraser, G.M., Hirano, T., Ferris, H.U., Devgan, L.L., Kihara, M., & Macnab, R.M. (2003) Substrate specificity of type III flagellar protein export in Salmonella is controlled by subdomain interactions in FlhB. Mol. Microbiol., 48, 1043–1057.
著者紹介Author Profile
 寺島 浩行(てらしま ひろゆき)
寺島 浩行(てらしま ひろゆき)名古屋大学大学院理学研究科生命理学専攻助教.博士(理学).
略歴1981年愛知県に生る.2004年名古屋大学理学部卒業.09年博士(理学).米国ウェイルコーネル医学校博士研究員,大阪大学大学院理学研究科博士研究員,特任助教を経て,17年より現職.
研究テーマと抱負III型分泌系に属する細菌べん毛輸送装置の作動機序の解明,及び細菌べん毛の回転力発生機序の解明.in vitro再構成実験によって細菌べん毛の構築・機能を解明することを目指している.
ウェブサイトhttp://bunshi4.bio.nagoya-u.ac.jp/~bunshi4/profile/terashima.html
趣味コーヒーとお酒,読書.