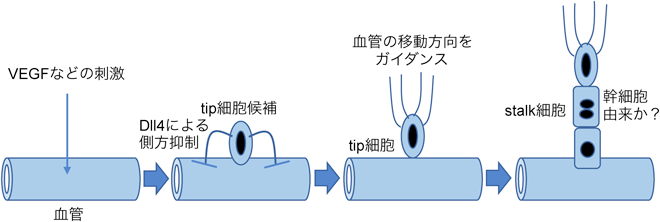
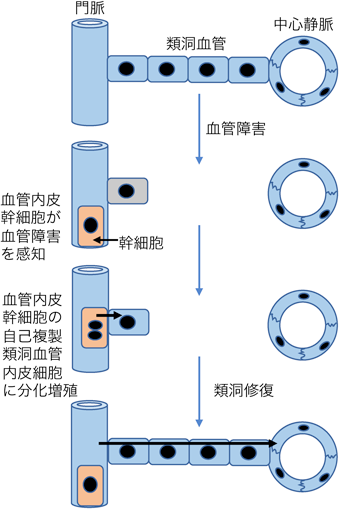
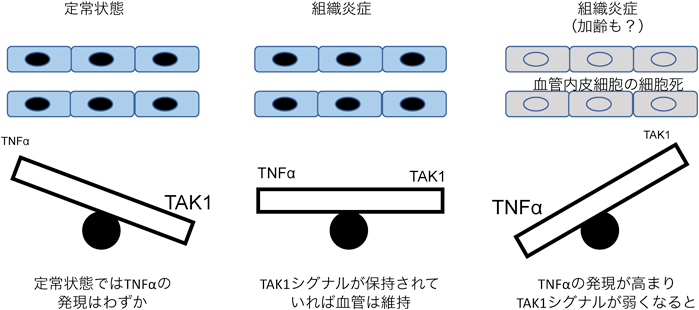
血管内皮幹細胞の同定と血管新生・リモデリングのメカニズムIdentification of endothelial stem cell population and mechanism of vascular remodeling and angiogenesis
大阪大学微生物病研究所情報伝達分野Department of Signal Transduction, Research Institute for Microbial Diseases, Osaka University ◇ 〒560–0871 大阪府吹田市山田丘3–1 ◇ 3–1 Yamada-oka, Suita-shi, Osaka 565–0871, Japan