あれは確か1997年の夏のある日の早朝のことだった.学会出張のために宿泊していた米国のホテルに研究室の大学院生から国際電話がかかってきた.我々が解析していた新規タンパク質のcDNAがNIH GenBankでヒットし,Fusedと呼ばれる自然発症型の変異マウスの原因遺伝子と一致したという連絡だった.Fusedに関する論文はCell誌に掲載されるということで,留学時代のカリフォルニア大学サンフランシスコ校(UCSF)の知人に電話をして,その論文について尋ねた.しかし,この当時は米国でも東海岸から西海岸に情報が伝わるのは時間差があり(出版物の輸送の問題),その場では手に入らなかったので,帰国後FAX(インターネット環境が十分に整備されていない時代の重要な文書転送手段)で論文を送ってもらった.我々がGSK3(glycogen synthase kinase-3)の結合タンパク質として酵母ツーハイブリッド法を用いて単離していた2種類のGIP(GSK3 interacting protein)1と2のうち,GIP1がその論文で示されたAxinと同一であった1, 2).Axinの名前は,このタンパク質のmRNAをアフリカツメガエルの初期胚に発現させると背側軸の形成が阻害される(axis inhibition)ことに由来した.
私は,1995年に広島大学医学部生化学教室で独立するまでは,神戸大学(高井義美教授)とUCSF(Lewis T. Wiiliams教授)にて,Rab, Rho, Ras, Ral等の低分子量Gタンパク質の解析を行っていた.独立してからは,これまでとは異なるプロジェクトを展開したいと考えて,興味を持っていたリン酸化酵素GSK3に結合するタンパク質の探索を開始していた.それが,今回「Wnt」をテーマにして総説を執筆する出発点であった.もちろん,当時の私にはWntに関する知識も,実験経験も,発表論文も何もなかった.本稿では,Wntシグナル研究の流れの中で我々の研究がどういう位置づけにあったかを交えながら,いくつかのトピックスを解説する.
2. Wntシグナル研究の源流(1970年代~1990年半ば)~異なる研究領域の交差~
1)ショウジョウバエの遺伝学研究
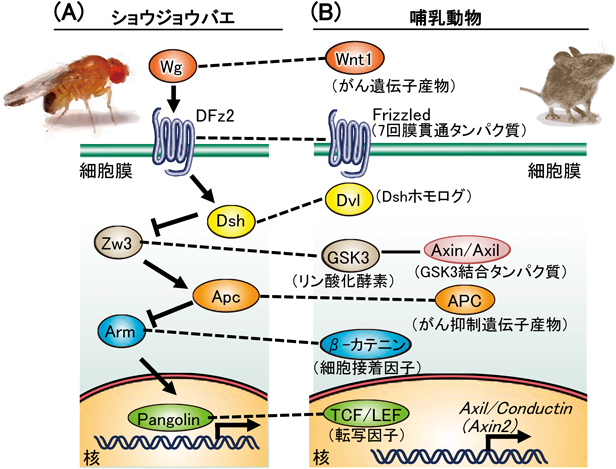
学問が大きく進展するときに,まったく異なる研究領域の交差が契機となることがある.Wntシグナル研究においては,ショウジョウバエの遺伝学研究とマウス発がん研究で独立して解析されていた遺伝子の相同性の発見が大きな貢献をした.ショウジョウバエの幼虫および成体は,頭部節,三つの胸節,八つの腹節からなる体節を有する.ショウジョウバエの胚に放射線を照射することにより,分節の数や前後極性に変化が生じた変異体(ミュータント)を作製することができるが,1973年に報告されたある変異体は,成虫において翅(はね)や平均棍(翅の後部に一対ある棒状の器官でバランサーとして機能する)の異常が認められた3, 4).この変異体は,成虫における翅のない表現型をもとにwinglessと命名された.一方,野生型ハエ幼虫の体節の前部の表皮にはdenticle beltと呼ばれる歯状突起列構造が存在するが,後部にはそれが存在しない.ところが,winglessの幼虫は,体節数は正常であるが,体節の後方部の構造が欠失し,前方部の構造が鏡像的に認められる(すなわち,歯状突起列が前後部両方に生じる)ことが判明し,wingless(wg)はセグメントポラリティー遺伝子として捉えられるようになった(この時代は,winglessの塩基配列が決定されていたわけではない)5).この表現型の類似性や,winglessの発現と関連した別種のセグメントポラリティー遺伝子であるengrailedの体節における発現等を指標に,遺伝学的に関連する複数の変異体が同定された.詳細は後述するが,それらはDrosophila frizzled 2(Dfz2)6),dishevelled(dsh)7),zeste-white 3(zw3)8),armadillo(arm)9)と呼ばれる変異体である.これらの変異体の表現型の原因遺伝子の塩基配列が後に決定され,他の生物種の遺伝子と比較することにより,これらのセグメントポラリティー遺伝子が種を超えて保存されていることが明らかになった.
2)マウス発がん研究
発がん研究では,1936年に母乳を介して乳がんが自然発症しやすいある種のマウスが報告された10).この発がん活性を有する因子(「ミルク因子」)がマウス乳汁から精製され,その形態からレトロウイルスであるMMTV(mouse mammary tumor virus)であると考えられた11).1950~1960年代にかけて,種々の動物から発がん活性を有するレトロウイルスが単離されていたが,その多くは血球系腫瘍や肉腫を誘導するが,乳がんのような上皮性の腫瘍を引き起こすことはまれであった.また,多くの発がん性レトロウイルスはがん遺伝子を内在していたが,MMTVゲノムにはそのような配列は存在しなかった.さらに,MMTVによる乳がん発症には数か月以上かかることから,ウイルス感染だけでは発がんに不十分と考えられた.一方,1981年にトリ白血病ウイルス(avian leukemia virus:ALV)のプロウイルスがc-Myc遺伝子の近傍に挿入し,c-Mycが過剰発現して,B細胞リンパ腫を誘導することが明らかになった12).その結果を参考に,マウス乳がんにおいてMMTVプロウイルスの挿入により転写が亢進するマウスのゲノム領域が探索され,~30 kbからなるMMTV Int1と名づけられた遺伝子座が同定された13).本成果は1982年にCell誌に発表され,Wnt研究が発展する出発点となった論文とされているが,同年にがん研究領域ではRas遺伝子の一塩基変異によりヒト細胞がトランスフォーメーションするという画期的な成果が発表されたこともあり14–16),大きな反響を呼ばなかった.余談だが,私は1982年に大学を卒業し研修医として大学病院に勤務していた.その同じ年に自分が将来研究対象とするRasやWntに関わる重要な成果が発表されたことなど,知る由もなかった.
その後Int1の塩基配列が決定され,Int1はシグナル配列を有する分泌タンパク質である可能性が示唆された17).また,Int1のトランスジェニックマウスが生後6か月で乳がんを発症することも示され18),Int1は原がん遺伝子であると位置づけられるようになった.さらに,1987年にInt1はショウジョウバエのDNAにも存在することが判明し,その塩基配列が決定され,Drosophila int1(Dint-1)は,同年に塩基配列が報告されたショウジョウバエのwinglessと同一であることが決定した19, 20).ここで初めて,無脊椎動物の発生に関わる遺伝子と,哺乳動物のがんに関わる遺伝子が高い相同性(アミノ酸レベルで53%同一)を有することが明らかになった.
がんは,細胞の増殖と運動が過度に起こる状態で,発生の過程と類似している点があると考えられていた.1989年にInt1をアフリカツメガエル胚に発現させると,二次体軸(背側軸)が形成されることが報告された21).すなわち,Int1はオーガナイザー(初期発生段階で周囲の胚域を特定の器官に誘導する)の役割を果たすことが示唆され,脊椎動物の発生における重要性が注目されるようになる.アフリカツメガエルの卵,受精卵,胚はその実験の簡便さ,スピード,表現型のわかりやすさ等から,Int1をはじめ発生に関わるシグナル分子の解析に欠かせない実験系であり,2000年ごろまでのWnt研究領域のin vivo実験の主役であった.1980年代後半に,相同組換え技術により遺伝子を人為的に欠損(ノックアウト)させるマウス変異体の作製が可能となった.その最も初期に作製された変異マウスがInt1欠損マウスである22).Int1欠損マウスは中脳と小脳の発生に異常が認められた.また,1967年に報告された小脳の形態と機能異常を有するSwayingという変異マウスでは,Int1にフレームシフトが生じていたことも示された23).ここで,1930年代のミルク因子によるマウス乳がん,1960年代の小脳失調マウス,1970年代の翅に異常を持つショウジョウバエの変異体は,いずれもInt1遺伝子の異常にもとづくことが明らかになった.
3)新分子名“Wnt”の誕生
Int1遺伝子の重要性が明らかになるにつれ,MMTVプロウイルスを挿入することにより,活性化される遺伝子が見いだされ,Int224),Int325),Int426)と名づけられた.Int4は塩基配列上,Int1に類似していたが,Int3とInt4は類似していなかった.事実,Int3とInt4は後にそれぞれFGF3とNotch4であることが判明した.さらに,PCR技術を用いて,低いstringencyでInt1類似遺伝子が多く単離され,ファミリーを形成していることが明らかになった27).したがって,“Int”という単語だけでこれらのすべての遺伝子を表現することが困難となり,Int1に類似している遺伝子群だけをWnt(Wingless-related integration site)と呼ぶようになった28).
分子の“Nomenclature(命名)”は重要であり,仮に自分たちが最初に見つけた遺伝子やタンパク質であったとしても,後で名前が変わると,その論文が引用されなくなってしまうことがある.プロローグでも述べたが,私は独立して研究室を持つまでは低分子量Gタンパク質に関する研究を行っていた.1980年代にはウシ大脳膜画分から複数の低分子量Gタンパク質を精製していたが,タンパク質の精製は最後にSDS-PAGEでバンドが1本になることを示すのが作法であり,それにより大まかな分子量を決定できる.そこで,精製したタンパク質をSmg p20(small molecular weight G proteinで分子量が20 Kという意味),Smg p21, Smg p24等と名づけていた29, 30).しかし,PCRクローニング法等を用いて低分子量Gタンパク質のcDNAが次々と単離されると,低分子量Gタンパク質には数十種類のホモログが存在することが明らかになり31),とてもSmgと分子量だけの命名では対応できなくなってしまった.1991年のFASEB会議(低分子量Gタンパク質をテーマにした第1回の会議)では,低分子量Gタンパク質のNomenclatureに関するセッションがあり,RapやRab, Rac等の名前でRasに関連した分子群としてまとめられるようになった.ちなみに,私が最初に精製したSmg p2432, 33)は現在Rab3Aとなっている.命名には,3文字で表現するものであれば発音しやすいように母音が間に入るよう工夫するとともに,その分子群の広がりをイメージできるセンスが必要なように思う.一方,GDI(GDP dissociation inhibitor)はRabやRhoとその脂質修飾を介して結合し,低分子量Gタンパク質からのGDPの解離を抑制するとともに,細胞内局在を制御するタンパク質として同定した34, 35).GDIの分子名は単なる略称であるが,概念としてまったく新しい知見であったので,そのままRab GDIならびにRho GDIとして名前が残っている.やはり,オリジナリティが最も重要であると感じた例である.これまでに自分たちが独自に見つけた分子の命名に関しては,欧米の研究者に主導権を握られ悔しい思いをしたこともあるが,それでも80年代,90年代の生化学者には自分が見つけた遺伝子やタンパク質があり,その機能を明らかにしていくことがこの上もなく楽しみであったように思う.2003年にヒトゲノムプロジェクトが完了すると,新規の遺伝子を見いだすということが概念的にはなくなった.もちろん,機能が明らかにされていない分子はまだまだたくさんあるので,別のセンスで新しい“もの”を見つけることが必要とされる時代になったと感じている.
さて,Int1はWnt1と名づけられ,ヒトとマウスには19種類のWntファミリー遺伝子が存在することが明らかになった.これらのWnt遺伝子は発生過程において,時期特異的,組織特異的な発現を示し,固有の機能を有した27).各Wnt遺伝子のノックアウトマウスが作製され,いくつかのものは特徴的な組織異常を示し,胎生致死となった36).さらに,刺胞動物のNematostellaやHydraのような動物界の先祖でもWnt遺伝子を複数持っていた37).Wnt遺伝子は前口動物(Protostomes)と後口動物(Deuterostomes)に分岐する6億年以前に存在して,動物の体軸の決定に重要な役割を有すると考えられる38)が,単細胞生物と植物には存在しない.このように,Wnt遺伝子の動物発生と腫瘍形成における重要性は1990年代半ばまでに確定した.そして,次の10~15年の間に,種を超えたWntシグナル伝達経路の構成分子の共通性とその精緻な機能制御機構が明らかになる.
3. 遺伝学研究から生化学研究へ~タンパク質,シグナル研究へ~
1)種を超えて保存されたWntシグナル
上述したように,winglessはショウジョウバエの初期発生に関与するセグメントポラリティー遺伝子群の一つであり,体節の前後極性を決定する.このセグメントポラリティー遺伝子群の体節極性決定の相互作用に関する研究が,種を超えて保存されたWntシグナル経路のフレームワークを形成した.前述したように,wingless変異体幼虫の体節の前後部の構造を反映する表皮パターンは,後部の構造が消失し,前部の構造が鏡像的に認められる.dishevelledとarmadillo変異体はwingless変異体と同様の表皮パターンを示した.zeste-white3変異体の表現型は,wingless変異体と逆であった.そこで,wingless, dishevelled, zeste-white3, armadilloの変異体間での二重変異体が作製され,エピスタシス解析(表現型に影響を与える変異体を用いた解析)により,これらの遺伝子間の上下関係が決定された39)(図1).1990年代になり,いよいよ生化学的研究がWnt研究領域に登場する.この時代,EGF(epidermal growth factor)シグナルにおいて,その受容体EGFRのチロシンキナーゼを介してRas–Raf–MEK–ERK–ETS–標的遺伝子発現という細胞外から核までの美しいシグナル経路が完成していた40–42).それに比して,Wntシグナルの生化学的研究が遅れたのは,Wntタンパク質の精製の困難さや,これまでにないユニークな細胞応答システムを使っていたためと考えられる.
winglessを発現させたハエの細胞株から可溶性のWINGLESS(Wg)タンパク質画分(精製タンパク質ではない)が調製され,本Wgを別種のハエ細胞に作用させると,低リン酸化型のARMADILLO(Arm)が蓄積した43).またこの際,DISHEVELLED(Dsh)もリン酸化され,dishevelledを過剰発現させるとArmが蓄積した44).ZESTE-WHITE3(Zw3)は,Armを機能抑制的に作用することも示された45).興味深いことに,Zw3タンパク質とArmタンパク質は,脊椎動物でも保存されており,それぞれGSK3とβ-カテニンとして独立して研究が進められていた46, 47).GSK3はグリコーゲン合成酵素をリン酸化して,その活性を抑制するリン酸化酵素として同定されていたが,多種の基質をリン酸化することが明らかになりつつあった48, 49).一方,β-カテニンはカドヘリン結合タンパク質の一つとして単離され(他の二つはαとγ-カテニン),細胞接着分子として解析されていた50, 51).アフリカツメガエル胚を用いた実験では,GSK3がWnt8依存性の背腹軸形成を阻害すること52)や,GSK3がβ-カテニンをin vitroでわずかにリン酸化することが示された53).また,哺乳動物細胞を用いた実験では,β-カテニンはユビキチン化を受けてプロテアソームで分解され,この分解にはβ-カテニンのGSK3によりリン酸化されるアミノ酸配列の存在が必要であった54).すなわち,Dvl(Dishevelledのヒトオルソログ),GSK3, β-カテニンには何らかの関係があり,β-カテニンの安定性を制御すると考えられていた.
1990年代になると,ポジショナルクローニングという手法で遺伝性疾患の原因遺伝子が単離されるようになった.家族性大腸腺腫症という遺伝的に大腸ポリープを発症する疾患は,若年性大腸がんを発症する頻度が高い.本症に関連する遺伝子としてadenomatous polyposis coli(Apc)遺伝子が単離され,変異によりC末端側の半分が欠失したタンパク質が発現することが明らかになった55).Min(multiple intestinal neoplasia)と呼ばれるマウスは小腸にポリープが多発するが,本マウスでApcが変異していた56).また,APCはβ-カテニンと複合体を形成し,Apc変異体の発現はβ-カテニンを安定化した57, 58).β-カテニンは細胞接着を制御するタンパク質と考えられていたが,核にも存在することが示された59).TCF/LEF1(T-cell factor/Lymphoid enhancer binding factor 1)は,T細胞の遺伝子発現を制御する転写因子として同定され,Wntシグナルとは関係なく解析されていたが,β-カテニンがTCF/LEF1と結合することが判明した60, 61).また,ショウジョウバエにおいて,pangolinがTcf/Lef1のホモログとして見いだされ,winglessとarmadilloの下流で機能することが明らかになった62).すなわち,ショウジョウバエのデータと合わせれば,分泌タンパク質のWntが,細胞質内のAPCを介してβ-カテニンを安定化させて,核内移行したβ-カテニンが転写調節するというシグナル伝達経路が存在する可能性が高くなった.しかし,Dvl, GSK3, β-カテニン,APCの分子間の関係は不明なままであった.GSK3がβ-カテニンをリン酸化して分解を誘導するという仮説は魅力的であったが,生化学的にGSK3がβ-カテニンを直接リン酸化するデータに信憑性はなく,GSK3以外のリン酸化酵素がβ-カテニンをリン酸化する可能性も提唱された63).また,ショウジョウバエで見いだされたエピスタティックな遺伝子の上下関係が,哺乳動物のタンパク質の制御の上下関係に関連する必然性はないとも考えられていた(図1).
2)Axinを介するβ-カテニン分解複合体の同定
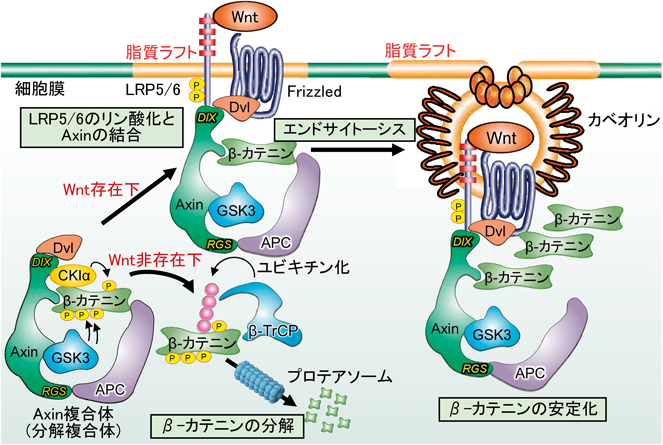
ここに,Wnt研究領域でこのような議論がされていたことなどまったく知らずに,GSK3の結合タンパク質として単離された我々の分子が登場する.プロローグで紹介したAxinである.我々は1997年3月ごろにGSK3の新規結合タンパク質として類似性の高い二つの分子を単離していた.1997年のCell誌の論文で,一方がAxinと同一であることが判明したので1, 2),他方をAxil(Axin-like)と名づけた64).その論文では,Axinがアフリカツメガエル胚の背側軸形成を阻害することが示されていたので,Wntシグナルとの関連を考え,GSK3によるβ-カテニンのリン酸化をin vitroの実験で試みたが,リン酸化はほとんど認められなかった.ところが,この実験系にAxinを加えると,AxinはGSK3とβ-カテニンに直接結合することにより,GSK3によるβ-カテニンのリン酸化を著しく亢進させた.すなわち,GSK3とβ-カテニンの酵素学的な親和性は低いが,Axinと結合することにより,両タンパク質が空間的に近い位置に配置され,GSK3によるβ-カテニンのリン酸化反応が可能になる.また,AxinはDvl(機能は後述)とAPCとも結合して,APCはAxin複合体中でのGSK3によるβ-カテニンのリン酸化を促進した65–67).さらに,カゼインキナーゼIα(CKIα)によるβ-カテニンのリン酸化が,GSK3によるβ-カテニンのリン酸化を増強することも判明した68).このようなリン酸化β-カテニンをE3ユビキチンリガーゼの構成分子であるβ-TrCPが認識して,β-カテニンのユビキチン化を促進してプロテアソームで分解を誘導した69).我々が1998~2000年にかけて発表した論文は,すべて精製タンパク質を用いた生化学的な再構成実験によるもので,Axinを中心とするβ-カテニン分解複合体の全貌がほぼ明らかになった(図2).まさに生化学者の面目躍如である.これらの論文の総引用回数は3000回に達しており,同時期に発表された他のグループのデータ70, 71)も我々のデータを支持したために,Wntシグナル領域における問題の一つが瞬く間に解明された.
Nomenclatureに関する話をもう一つしておきたい.我々が単離したAxinホモログはラット由来でAxilと名づけた64)が,マウスAxinホモログをクローニングしたドイツのグループはConductinと命名した72).私はそのグループと相談して両方の分子名を引用し,Axil/Conductinと記載することを約束した.Axil/Conductinは生化学的にはAxinと同様の機能があり,さらにプロモーターにはTCF/LEF1の結合部位が存在して,Wntシグナルにより発現する標的遺伝子であることも明らかになり73),重要な分子であると考えていた.ところが,我々の発表の翌年にヒトcDNAライブラリーからAxil/ConductinがクローニングされAxin2と命名されると74),それ以降世界中でAxin2という名前で呼ばれるようになった.Axin2は現在Wntシグナルの重要な標的分子であり,これも少し悲しい思い出である(図1).
4. 細胞膜上でのWnt受容機構のユニークさ~精緻な制御機構の美しさ~
1)Wnt受容体の同定
細胞内シグナル伝達機構の解明に平行して,Wnt受容体の探索が行われた.frizzledは平面細胞極性[planar cell polarity(PCP);翅の毛の方向性や複眼の眼の方向性等を意味する]に異常のある変異体として見いだされ,アミノ酸配列上7回膜貫通タンパク質であり,遺伝学的にdishevelledの上流にあると考えられたために75, 76),Wgの受容体の可能性が示唆された.しかし,frizzledはwinglessと同様の表現型を示さなかったので,winglessと類似の表現型を示す2番目の変異体frizzled 2(Dfz2)が見いだされた6).Wgタンパク質がDFz2に結合するとArmが蓄積することが示され,DFz2がWgの受容体であると考えられるようになった.現在ヒトとマウスのFrizzledはそれぞれ10種類のファミリーが存在するが,19種類のWntとどのような関係で結合するかは,明らかになっていない.
この過程で,Dfz–Dshを介する平面細胞極性の制御機構があることも判明し,新たなシグナル経路の存在が確認された.本経路は,これまで説明してきたβ-カテニンを介するWntシグナル経路とは異なり,β-カテニン非依存性経路(PCP経路あるいは非古典的経路)と呼ばれ,細胞の極性や運動,接着等を制御する.我々はβ-カテニン非依存性経路の代表的リガンドであるWnt5aを用いて,その活性化機構や細胞機能制御,がんや炎症との関連を明らかにした77–86).本稿ではβ-カテニン非依存性経路にはふれないので,他の総説を参考にしていただきたい87–89).
Wntシグナル伝達の特徴の一つは,受容体機構が他の多くのシグナル経路とは異なり,共役受容体が存在することである.セグメントポラリティー遺伝子の一つとして単離されたarrowは,LRP(low density lipoprotein receptor-related protein)のファミリーメンバーであり(哺乳動物細胞のLRP5/6に相当),winglessと遺伝学的に類似の表現型を示した90).この論文に加えて,Nature誌の同じ号に,LRP5/6ノックアウトマウスの表現型と生化学的シグナル解析に関する論文が“back to back”で掲載され91, 92),LRP5/6は細胞膜上でFrizzledとともにWntの受容体になることが決定した.この当時のモデルは,WntがFrizzledとLRP5/6に結合すると,細胞質内でFrizzledがDvlと結合し,GSK3とカゼインキナーゼによってリン酸化されたLRP5/6がAxinと結合することにより,Axin複合体が細胞膜にリクルートされ,Axinの機能を抑制する結果,β-カテニンが安定化するというものであった93–95)(図2).これだけでも,Wntシグナルは他のシグナル伝達経路よりも複雑に感じるが,さらにこれを調整するシステムが現れる.
2)新たなWntシグナル活性化システムの発見
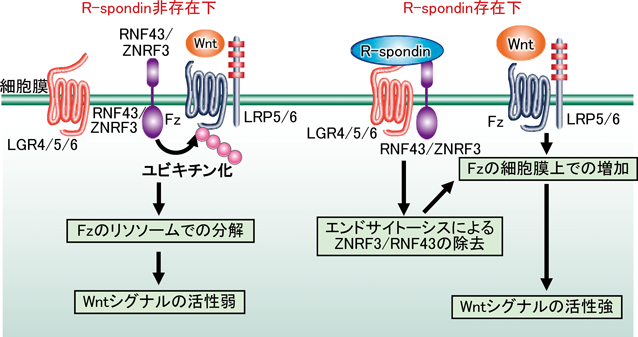
LGR5(leucine-rich repeat-containing G-protein-coupled receptor 5)は,Apcに変異のある大腸がん細胞株においてDNAマクロアレイを用いてβ-カテニン/TCF4により直接発現誘導される80個の遺伝子(Wntシグナル標的分子)の一つとして見いだされた96).LGR5は7回膜貫通型のオーファン受容体(リガンド不明の受容体)であり,この時点では研究者の興味を引かなかったが,その後大きく展開した.小腸上皮は分化細胞が存在する絨毛と増殖細胞の存在する陰窩に分けられる(図4A参照).腸管上皮細胞でのLgr5のノックアウトマウスは,顕著な表現型が認められなかったが,Lgr4とともにノックアウトすると腸管陰窩が破壊され,絨毛における細胞分化も障害された97).この際,腸管においてWntシグナル標的遺伝子の発現が減少していた.まったく独立した研究において,分泌タンパク質R-spondin1が胎生期の神経管の蓋板と神経上皮に一過性に発現する遺伝子として同定されていた98).ノックアウトマウスの解析とイタリアの2家系の解析から,R-spondin1は卵巣発生と性の決定に重要であり,Wnt4ノックアウトマウスの表現型と類似していた99, 100).一方で,免疫グロブリンκのプロモーター下でR-spondin1を発現させるノックインマウスでは,腸管の太さと長さの増加や陰窩領域の拡大,陰窩細胞におけるβ-カテニンの蓄積が認められた101).ここで,R-spondin1とオーファン受容体LGR4/5の結合が判明して,R-spondin1がWnt依存性のLRP6のリン酸化やβ-カテニンの安定化を促進することが示された97, 102).R-spondinには2, 3, 4のファミリーが存在し,いずれもLGR4/5/6のリガンドとして作用し,Wntシグナルを増強した103, 104)が,LGRsとFrizzled/LRP6からなるWnt受容体の活性化の仕組みは不明であった.
細胞膜上の受容体がリガンドに結合すると細胞質内に取り込まれるエンドサイトーシスは,細胞膜上の受容体を減少させることから,シグナルを停止するイベントと考えられている.エンドサイトーシスには受容体のユビキチン化が関与していることもあり,Frizzled4がユビキチン化され,リソソームに輸送され分解されることが示された105).一方,Wntシグナル標的分子を探索する過程で,Axin2やLGR5の発現と正の関係にあるZNRF3(zinc and ring finger 3)とそのホモログのRNF43(ring finger protein 43)が同定された106, 107).ZNRF3/RNF43は細胞膜に局在するRING型ユビキチンリガーゼであり,Frizzledと結合しユビキチン化して,Frizzledのエンドサイトーシスとリソソームでの分解を促進した.これはWnt依存性のユビキチン化ではないので,ある種の細胞では恒常的にFrizzled4/6/8のユビキチン化が起こり,細胞膜上のタンパク質量を調整していると考えられた.そこに,上述したR-spondinがLGR4/5/6ならびにZNRF3/RNF43と結合し,ZNRF3/RNF43をエンドサイトーシスする結果,Frizzledのユビキチン化が減少して,Wntシグナルが増強することが示された(図3).この魅力的なモデルも2~3年で確立し,そのスピードに圧倒されたことを覚えている.
一方,エンドサイトーシスにより細胞質内に取り込まれた小胞がシグナルの活性化を促進する例もある108).我々は,FrizzledとLRP5/6が細胞膜の脂質ラフトに局在してWnt依存性にカベオリン経路を介してエンドサイトーシスされることが,Wntシグナルの活性化に重要であるというモデルを提唱している109–113)(図2).本モデルに対しては,他研究室から追試確認があり114–117),現時点においてWnt受容体のエンドサイトーシスとシグナル活性化についての一致した結論はなく,“Cell Context”により異なると考えられている.このように,Wntシグナルはリガンドと受容体のレベルで巧妙に制御されている.さらに,sFRP(soluble Frizzled-related protein)やDKK(Dickkopf)等の分泌タンパク質がWntや受容体に作用することによりWntシグナルを負に制御する118).
3)Wntタンパク質の精製と構造決定
シグナル伝達機構の解析では,リガンドの精製やリガンドと受容体の結合親和性の決定が必須であるが,Wntタンパク質の精製が難航した.その理由は,Wntが分泌タンパク質でありながら脂質修飾を受けていたためにきわめて不溶性で凝集しやすく,界面活性剤の存在下で初めて精製が可能になったからである119).この脂質修飾はパルミトレイン酸という1価不飽和脂肪酸によるものであり,Wntの分泌に必須であった120).我々は,Wnt3a, Wnt5a, Wnt5b, Wnt11を精製し,脂質修飾に加えてこれらのWntは異なるN型糖鎖の修飾を受けており,糖鎖修飾の違いが極性化した上皮細胞におけるWnt分泌方向を決定することを明らかにした121–124).活性型のWntタンパク質が精製できるようになり,コンディションドメディウムや細胞へのWnt遺伝子の過剰発現によらない生化学的解析が可能となった78, 125, 126).
Wntの構造生物学的解析結果は衝撃的であった127).Wnt8とFrizzled8の細胞外領域をカイコ細胞に共発現させて結晶化し,その構造決定がなされた.Wnt8を修飾している長い直線状の電子密度(脂肪酸)がFrizzled8に存在する溝状の構造に挿入され,Wnt8のC末端の配列がFrizzled8の外側に沿うように添えられていることが示された.つまり,親指(脂肪酸)と人差し指(C末端配列)がFrizzled8をつまむように結合するユニークな構造であった.このようなリガンド–受容体結合の例はなく,Wntとその受容体の結合をこれまでの概念に従って考えているのでは十分な理解に至らないということかもしれない.なお,Wntの高次構造上のどの部分がLRP5/6と結合するかはいまだに不明である.
界面活性剤を含んだ精製Wntタンパク質を用いた実験にはいろいろな制限が生じるために,可溶性でかつ活性を保ったWntを精製する試みがなされている.ウシ血清由来のAfaminはWntと複合体を形成し,容易に精製された可溶性の本複合体は培養細胞ならびに腸管オルガノイドに対して生物学的活性を有した128).さらに,FrizzledとLRP5/6を二量体化させればWntシグナルを活性化できるという視点で,Frizzledと結合するモノクローナル抗体Vantictumabの単鎖可変領域フラグメント(またはFrizzledに結合できる好アルカリ性細菌Bacillus halodurans由来タンパク質)とLRP5/6に結合するDKKを融合させた人工Wntアゴニストが作製され,Wntと同様の生物学的活性を有することが示された129).Wntは次に述べるように幹細胞の重要な制御因子であることから,今後もさまざまなWntアゴニストが開発されるであろう.
5. 発生生物学研究から幹細胞生物学研究へ~Wntシグナル研究の広がり~
1)幹細胞の機能維持とWntシグナル
2000年代になると幹細胞生物学が急速に発展し,幹細胞の再生医療への応用の期待が高まってきた.Wntシグナルが動物の発生に重要であるので,胚性幹細胞(ES細胞)の機能制御(自己複製能と多分化能)へのWntシグナルの重要性を示す成果が多数報告された.たとえば,未分化状態のマウスES細胞ではWntシグナル活性が高く,かつGSK3の阻害薬(BIO)とMEK阻害剤を併用することにより,フィーダー細胞非存在下で培養可能となり,未分化能のマーカー遺伝子であるRex-1の発現が増加した130).本ES細胞をマウスの皮下に注射すると,神経上皮や軟骨,毛髪を有する上皮を含む三胚葉からなる奇形腫が形成された.また,APCノックアウトマウスから作製したES細胞由来の奇形腫では,神経や骨,軟骨,毛髪を有した上皮への分化が抑制された131).したがって,WntシグナルはマウスES細胞の未分化能維持を可能にすると考えられる.しかし,ヒトES細胞では,Wntシグナルは内胚葉,中胚葉への分化を促進することが示され132),ES細胞を用いた実験の解釈については,マウスとヒトの多能性幹細胞の性状の違いや,Wntシグナルの強度や期間により異なることを考慮する必要がある.一方,胎生期における臓器の形態形成や分化では,WntやFGF, Hedgehog, TGFβ等により制御されるシグナル経路が重要であるが,その活性化のタイミングも重要である.マウス心筋細胞の分化誘導において,マウスES細胞から中胚葉細胞や心筋前駆細胞への分化の初期段階では,Wnt3aは促進的に働き,DKK1は抑制的に作用したが,心筋前駆細胞が成熟心筋細胞へ分化する後期段階では,DKK1が促進的に働いた133).すなわち,時期特異的にWntシグナルを制御することで心筋細胞を効率よく分化させることが可能である.
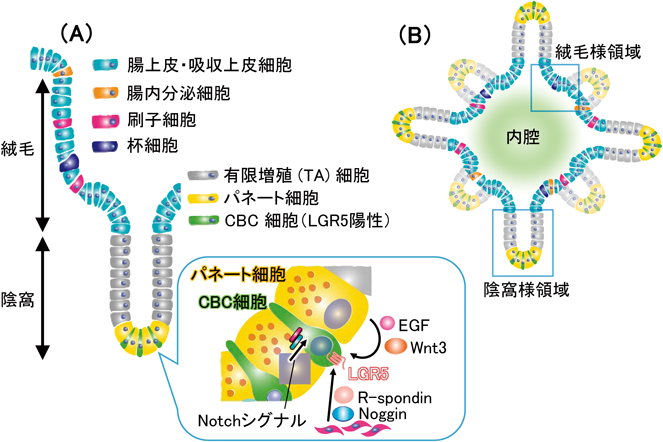
LGR5の発見は成体組織幹細胞におけるWntシグナルの重要性を決定的にした.上述したとおり,LGR5はWntシグナルの標的分子であり,R-spondinを介したWntシグナルの促進分子でもある.LGR5は小腸陰窩部のパネート細胞に挟まれた細胞に発現しており,幹細胞生物学研究のゴールデンスタンダードとなっているリニエージトレーシング法により,LGR5陽性細胞が長期間の自己複製能とすべての小腸腸管上皮分化細胞への分化能を有する腸管上皮幹細胞であることが判明した134)(図4A).このLGR5陽性細胞をマトリゲル内でEGF, Noggin, R-spondinとともに培養すると,長期間の腸管上皮幹細胞の維持が可能となる135).すなわち,EGFで細胞の増殖を,NogginによりBMPシグナルの阻害を,R-spondinでWntシグナルの促進を行うと,幹細胞性が維持できる.さらに,単一LGR5陽性細胞の培養を続けると,腸管の陰窩絨毛構造を模したオルガノイド(3次元組織構造体)を形成したことから,上皮細胞が自立的に組織構築を行うことが証明された(図4B).本オルガノイド技術によって,マウス腸管ばかりでなく,ヒト大腸から採取された生検組織からもオルガノイドが作製された136).ヒト大腸では,Wntシグナルの標的遺伝子であるEphB2が腸管幹細胞マーカーとして用いられ,EphB2発現単一細胞からヒト腸管オルガノイドが作製できる.
腸管上皮幹細胞の維持にはWnt, R-spondin, EGF, Notchリガンド(Dll1/4, delta-like 1/4),Nogginが必要であるが,幹細胞に隣接するパネート細胞にWnt3とEGF, Dll1/4が発現しており,パネート細胞がニッチとして機能することが示された(図4A)137).R-spondinとNogginは上皮細胞には発現しておらず,非上皮細胞ニッチの存在が考えられた.一方,大腸陰窩にはLGR5陽性細胞が存在するが,パネート細胞は存在せず,代わりにDCS細胞(deep crypt secretory cell)がEGFとDll1/4を発現し,ニッチとして機能する138).腸管上皮で開発されたオルガノイド培養法は胃や肝臓,肺,眼,大脳皮質にも応用可能で,特定の細胞が幹細胞として機能することを証明できる重要な実験手法となっている139, 140).また,組織幹細胞を再生医療に応用するという視点から,潰瘍性大腸炎モデルマウスに,大腸オルガノイドを移植すると,障害を受けた腸管上皮において定着,増殖し,大腸粘膜を修復した141).
2)幹細胞の可塑性とWntシグナル
LGR5陽性幹細胞は,小腸や大腸,胃幽門部,毛包,乳腺,卵巣では,その恒常性を保つために,常在する(homeostatic stem cells/reserve stem cells)140).腸管では,LGR5陽性幹細胞が障害されると,分化した細胞が脱分化をしてLGR5陽性幹細胞となり,本細胞が分化細胞を再び誘導する結果,障害組織を修復する.胃幽門部では,LGR5陽性細胞が障害されると胃小窩峡部下部に存在するAxin2陽性LGR5陰性細胞がLGR5陽性細胞となる142).毛包では,CD34陽性細胞やLGR5陽性細胞がバルジ領域(毛包幹細胞が存在する毛包の恒常部下端領域で,立毛筋が付着する)とサブバルジ領域で幹細胞として機能していると考えられているが,サブバルジ領域におけるLGR5陽性幹細胞が障害されると,バルジ領域におけるCD34陽性LGR5陰性細胞がLGR5陽性幹細胞に変換され,毛髪の再生を促す143).これらは,分化細胞と組織幹細胞との間あるいは幹細胞間での可塑性の可能性を示すもので大変興味深い.その分子機構は不明であるが,エピジェネティックな変化に基づくクロマチン制御が関与している可能性がある144).
一方,胃体部や肝臓,膵臓,前立腺では,恒常性の維持にはLGR5陰性幹細胞が機能しているが,組織の障害によりLGR5陽性幹細胞が誘導され(facultative stem cells),種々の細胞に分化し,組織が修復される140).胃体部ではLGR5陽性細胞は分化した胃底腺に通常は存在し,LGR5陰性幹細胞が障害されると,LGR5陽性細胞が活性化され幹細胞として働き,分化細胞を誘導する145).肝臓においては,胆管に隣接して存在するLGR5陽性細胞が,肝障害時の肝細胞と胆管細胞に分化する146).一方,恒常性の維持には,中心静脈周辺のLGR5陽性細胞が幹細胞として機能する147)という報告や,中心静脈周囲に存在するAxin2陽性細胞が幹細胞として,かつWnt2とWnt9bを発現する中心静脈内皮細胞がニッチ細胞として機能する148)という報告があり,混沌としている.ここではLGR5陽性細胞が幹細胞として機能する例をあげたが,各組織には種々の幹細胞マーカーが知られており,WntシグナルとLGR5陽性細胞だけで発生,再生を説明できるわけではない.幹細胞生物学の進展は目覚ましく,現在未知の問題が明らかとなり,再生医療が現実のものとなる時代が到来することを期待している.
高い可塑性と長い寿命を有する組織特異的幹細胞が,がん性変異を受けるとがん幹細胞として,がん発症の基点となり,腫瘍細胞の増殖と転移を促進するという仮説は魅力的である149).確かに,実験的にマウスLGR5陽性幹細胞にがん性遺伝子変異を加えると,腸管腺腫,大腸がん,胃がんが生じることが確かめられた145, 150).マウスLGR5陽性腸管幹細胞からApcをノックアウトすると,腺腫が形成され151),胃幽門部のLGR5陽性細胞からPTENとSmad4をノックアウトすると,浸潤型胃がんが形成される152).Apc変異マウスにおいては,LGR5陽性細胞がクローン性増殖を示し,全腺腫のうち5~10%がLGR5陽性であった153).これらの結果は,マウス発がんモデルにおいては,LGR5陽性細胞ががん幹細胞になるという仮説を支持するが,ヒトがん組織においては免疫組織学的染色に有効な抗LGR5抗体がないために,その存在は必ずしも肯定されていなかった.しかし,患者由来大腸がんオルガノイドを用いて,ヒトLGR5陽性細胞ががん幹細胞の性状を有していることが示された154).LGR5を介してWntシグナルの活性化に関わるRNF43の異常が膵がん等に認められることと合わせて,LGR5陽性幹細胞が一群のヒトがんの発症と悪性化に関わっているかもしれない.
3)代謝とWntシグナル
私はこれまで医学部の生化学教室の教授を25年間務めて,毎年医学科学生に生化学(代謝学)の講義をしている.講義の前に生化学の教科書を読みなおすのであるが,そのたびに20世紀前半の生化学者の精緻かつ揺らぎない研究成果に感心をする.それは,現在の教科書に記載されている代謝マップの重要経路の大部分は20世紀半ばまでに完成しているからである.事実,1922年O.F. Meyerhofに対して「筋肉における乳酸生成と酸素消費の関係の発見」で,1931年O.H. Warburgに対して「呼吸酵素の特性および作用機構の発見」で,1953年H.A. Krebsに対して「TCA回路の発見」で,同年F.A. Lipmannに対して「高エネルギー結合の意義とコエンザイムAの発見」で,ノーベル生理学・医学賞が授与されている.20世紀の後半は,代謝学にインパクトの高い成果が少なかったようにも感じるが,21世紀になりオミックス技術の格段の進歩により,代謝学研究の新たな展開が始まる.ここでは紹介はしないが,がん領域では「Warburg効果」に関する研究が大流行となっている155).Wntシグナル関連では,幹細胞代謝に興味深い知見が得られた.腸管LGR5陽性幹細胞とパネート細胞では代謝が異なり,幹細胞の方がパネート細胞よりもピルビン酸/乳酸比とミトコンドリア呼吸が亢進していた156).パネート細胞から放出された乳酸を利用して,幹細胞がミトコンドリアでの酸化的リン酸化を亢進して,そこで産生された活性酸素種(reactive oxygen species:ROS)が幹細胞内でp38を活性化して細胞分化と陰窩形成を促進する.しかし,絨毛部の分化した細胞と比較するとLGR5陽性幹細胞の方が酸化的リン酸化は少なく,これはミトコンドリアピルビン酸輸送体(mitochondrial pyruvate carrier:MPC)の発現量に依存することも報告された157).MPC遺伝子をノックアウトして解糖系が優位になると,マウス腸管とオルガノイドで幹細胞が増加し,分化が抑制される.また,ヒト大腸がん細胞では解糖系が亢進していて,Wntシグナルの阻害により減少した解糖系反応はピルビン酸脱水素酵素キナーゼ(PDK1)の発現により回復した158).これらの結果は,幹細胞とその分化細胞あるいはがん細胞では代謝状態が異なり,その制御にWntシグナルが関与することを示しており,今後の展開が期待される.
6. Wntシグナル研究を基盤とした疾患治療研究への応用~Wntシグナルを標的とした疾患治療は可能か?~
1)骨疾患と悪性腫瘍に対する創薬研究
Wntシグナルは種々の臓器の恒常性維持の制御に関与していることから,その破綻によって多くの疾患を発生する159–162).Wntシグナルの異常により,骨疾患とがんが発症することはよく知られており,ここでは治療への応用に関して記載する.
Wntシグナルは骨形成に重要であり,常染色体優性遺伝の高骨密度形質を示す家系でWnt受容体LRP5の細胞外領域のアミノ酸変異が認められる163, 164).マウスを用いた実験的解析から,LRP5の活性型変異が高骨密度の表現型を示した.また,Wntシグナル経路の阻害タンパク質であるsFRP1を欠損させたマウスでは骨形成が増強する165).逆に,常染色体劣性遺伝の骨粗鬆症を伴う偽神経膠腫症候群(osteoporosis-pseudoglioma syndrome:OPPG)において,LRP5の不活性型変異が認められる166).OPPGは骨密度低下と易骨折性に加えて,網膜血管形成不全を伴い,最終的に失明に至ることから,Wntシグナルの活性化が骨形成と血管形成に関与することを示唆している.
このようにWntシグナルは骨形成に重要であるが,その分子機構は次のように考えられる.Wntシグナルは,間葉系幹細胞からの軟骨細胞と脂肪細胞への分化を抑制するとともに,骨芽細胞と骨細胞への分化を促進する167).分化した骨細胞はWntシグナル経路の阻害因子であるDKK1とスクレロスチンを分泌して,骨芽細胞の分化と機能を抑制する.これらの分子基盤をもとに,骨粗鬆症の標的分子としてスクレロスチンが着目された.スクレロスチンはLRP5/6に結合してWntシグナルを阻害する結果,骨形成を抑制する168).老化等で骨形成因子に比してスクレロスチンが過多になることにより,骨粗鬆症が発症することが示され,抗スクレロスチン抗体が開発され,骨粗鬆症の治療薬になっている169, 170).基礎研究が治療開発に応用された好例である.
大腸がんや肝がん等で,β-カテニン分解複合体を構成するAxin, APC, β-カテニン,FBXW7に数%~50%程度の頻度で変異が認められる171, 172).膵がんではRNF43への変異が報告されており173),これらのがんではWntシグナルが異常に活性化している症例が多い.Wntシグナルを標的とした戦略としては,Wntタンパク質の分泌阻害,Wntと受容体の結合阻害,細胞質内複合体形成阻害があげられる.低分子化合物のIWP2とLGK974, ETC-159はWntにパルミトイル酸を付加する酵素Porcupineの阻害剤であり,小胞体でのWntの脂質修飾を抑制することにより,細胞外への分泌を阻害する174, 175).これらの薬剤を用いて,RNF43変異やR-spondin融合タンパク質(Wntシグナルを活性化すると考えられている)を発現する大腸がんでの治験を行っている.デコイ受容体(リガンド結合能のみを有し,シグナルを伝達しない受容体)であるOMP-54F28はFrizzled8に対する抗体とヒトIgG1 Fc領域からなるタンパク質で,Wntと細胞外で結合することによりWntシグナルを阻害する172).OMP-54F28を用いた肝がんと卵巣がんに対する治験がなされている.10種類のFrizzledのうち5種類を認識できる抗体OMP18R5は,非小細胞肺がんと膵がんを対象として治験が進められている176).β-カテニンの核内での作用を抑制するための低分子化合物の開発も長年行われてきた.ICG-001とPRI-724はβ-カテニンと転写共役因子CBP/p300の結合を阻害する低分子化合物177)で,急性,慢性骨髄性白血病と大腸がんに治験が行われている.AxinはタンキラーゼによりポリADPリボシル化され分解される178).その阻害剤XAV939はAxinを安定化させβ-カテニンの分解を誘導するため,抗がん剤として開発されているが,まだ治験には至ってない.
2)上皮管腔組織形成を基盤とした創薬研究
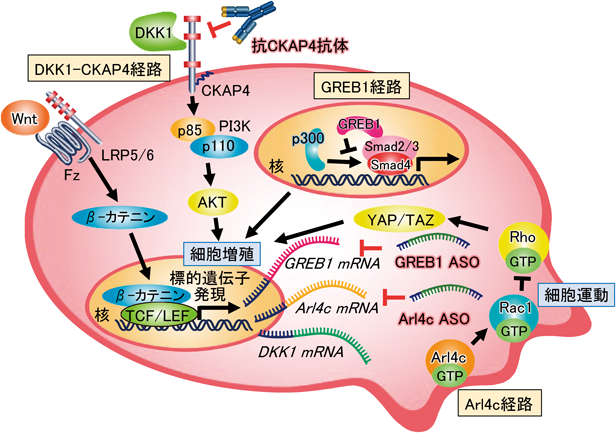
上述した化合物等を用いた治験の第1相または第2相試験が行われており,今後上市されることが期待されるが,新規の標的分子の探索も続けられている.我々は,Wntシグナル経路の構成分子そのものを標的とするのではなく,Wntシグナルの活性化により発現する分子を標的とすることを考え,新たな創薬開発を行っている(図5).上皮が作る管腔組織は唾液腺や肺,膵臓,腎臓,乳腺等の器官形成のための上皮細胞からなる中空の構造である179).上皮管腔組織の形成過程では,上皮細胞は伸長や運動,極性化しながら細胞外基質内でその形態を変化させる180–182).この過程は,がん細胞の間質内での増殖,浸潤の過程と類似しており,さまざまな液性因子のシグナルや細胞外基質との接着によって,細胞機能が制御される.我々は,培養上皮細胞やマウス胎仔組織を用いた実験系で,上皮管腔組織の形成過程において,WntシグナルとEGFシグナルの協調的作用により発現するArl4c(低分子量Gタンパク質)が重要であることを見いだした183, 184).Arl4cはRacとRhoを介して細胞形態を変化させることにより,YAP/TAZ(Yes-associated protein/transcriptional co-activator with PDZ-binding motif)の核内移行を誘導して,細胞増殖を促進させる(図5).Arl4cは,胎生期では上皮細胞の増殖や運動を促進して管状構造を形成するのだが,出生後の正常組織ではほとんど発現しておらず,大腸がんや肺がん,肝がん等で高頻度に発現していた185–187).細胞内の分子を標的とする際には,核酸医薬品は理論的には有効な手法と考えられているが,血中での不安定性や臓器到達性の非効率さの点から臨床応用が進んでいない188).我々は,これらの欠点を克服したArl4cに対する修飾型アンチセンス核酸(ASO)を合成して,肝臓や肺に腫瘍細胞を同所移植したマウスモデルにArl4c ASOを皮下投与したところ,抗腫瘍効果があることを確認した186, 187)(図5).また,膵がんにおいて,Arl4c高発現症例は予後不良であった.さらに,膵がん細胞株におけるArl4cの結合タンパク質として,IQGAP1(IQ motif containing GTPase activating protein 1)を同定し,Arl4cはIQGAP1とともにMMP14(matrix metalloproteinase-14)の細胞膜へのリクルートを誘導し,細胞外基質を分解することにより,浸潤能を高めることを見いだした.すなわち,Arl4cは膵がんの浸潤,転移に関与していることが明らかになり,Arl4c ASOは同所移植マウスモデルでの膵がんのリンパ節への転移を抑制した(投稿中).
3次元培養下でマウス胎仔の尿管芽形成を誘導する実験系において,Wnt依存性にGREB1(growth regulation by estrogen in breast cancer 1)が発現することが必要であることを見いだした(図5).GREB1はエストロゲン受容体(ER)の核内共役因子であり,乳がん細胞のホルモン依存的増殖を促進する189).Wntシグナルに異常のあるがんとGREB1の関連をデータベースで解析したところ,ホルモン感受性のない肝芽腫にGREB1の発現が高いことが判明した190).肝芽腫は小児の肝臓に発症するまれな悪性腫瘍で,その80%近くの症例にβ-カテニンの活性型変異を認めるが,その下流シグナルは明確ではなく,分子標的治療薬の開発も進んでいない191).肝芽腫細胞においてGREB1はWntシグナルの直接の標的遺伝子であり,肝芽腫の90%の症例でGREB1は腫瘍特異的に高発現していた190).GREB1はSmad2/3と結合することにより,転写共役因子p300と競合してTGFβシグナルを抑制する結果,肝芽腫細胞の増殖を促進した(図5).ハイドロダイナミック尾静脈注入法を用いたβ-カテニンとYAP, c-Metの3遺伝子の導入による肝芽腫マウスモデルを作製したところ,本モデルでGREB1は高発現した.さらに,GREB1 ASOが肝芽腫の同所移植マウスモデルにおける腫瘍形成を阻害した.本結果は,ホルモン非感受性の腫瘍でもGREB1が発現することが明らかになり,小児腫瘍形成の新規の分子機構を示した.
我々は極性化した上皮細胞におけるWntの分泌方向性とその機構にも興味を持ち,研究を行っている121–123).その過程で,DKK1はアピカル側から分泌され,しかもDKK1をアピカル側から作用させたときにのみ細胞増殖が促進することを見いだした192).上述したとおり,DKK1はWntシグナルの阻害因子であるが,同時に腫瘍増殖促進作用があることも知られていた193, 194).しかし,その作用機構は長年にわたって不明であった.そこで,上皮細胞に存在するDKK1の新規受容体として,II型膜タンパク質であるCKAP4(cytoskeleton associated protein 4)を同定した192).DKK1がCKAP4に作用すると,PI3キナーゼ–AKT経路を活性化してがん細胞増殖を促進した192)(図5).DKK1とCKAP4は膵がんと肺がん,食道がんで高頻度に発現して,両者が発現する症例の予後は不良であった195, 196).CKAP4がエクソソームとともに細胞外へ放出されることから,CKAP4は腫瘍マーカーになる可能性があり,事実,膵がん患者血清中のCKAP4値は健常者よりも高値であり,腫瘍切除により低下した113, 197).さらに,抗CKAP4抗体は,膵がん細胞同所移植マウスモデルで抗腫瘍効果を示した(図5).このように,Wntシグナルによる上皮組織の形態形成機構を基盤にして見いだした分子が,創薬の新規標的となる可能性が出てきた.
7. Wntシグナル研究の発展とWntミーティング~Wnt研究者の輪~
Wntシグナル研究の歴史を含めて,いくつかのトピックスについて記載してきたが,Wnt研究者をつなぐWntミーティングについてふれておかねばならない.Wntミーティングは,本研究領域の牽引者の1人であるスタンフォード大学のRoel Nusse教授が中心となって,1991年にごく少人数で開始された.ラボミーティングの延長であるので,Nusse研究室が運営するホームページ(https://web.stanford.edu/group/nusselab/cgi-bin/wnt/ )に開催日時がアナウンスされるだけである.宿泊先も自分で見つけなくてはならない.1998年にAxinに関する発表をして,私が初めてWntミーティングに参加したのは,2001年のNew Yorkでの会議であった(September 11よりも前に開催されていたので,貿易センタービルは見ていた)が,外国人研究者からなぜ今まで参加しなかったのかと言われた.Wntミーティングの存在を知らなかったのだから仕方がないのだが,このミーティングは衝撃的であった.すべての参加者がイントロダクションなしで,新しいデータだけを3日間発表し続けるのだ.各領域の優れた研究を展開している専門家が自身の最先端の研究を発表するとともに,他の発表にもそれぞれの立場でコメントを行い,意見交換をする.その内容はきわめて学際的であり,充実しており,本ミーティングに参加することにより,Wnt研究の方向性を理解することができると実感できた.Wntミーティングの情報量の多さとオープンな討論に魅了されて,私はその後毎年参加するようになった.最近は,EMBOワークショップやKeystoneシンポジウム,Gordonカンファレンス主催で開催されるようになり,“公式”な感じになったが,オープンに情報を交換し,友情を培う(open exchange and camaraderie)という精神は守られている(図6).
日本人研究者のWnt研究に対する貢献も大きくなってきたので,世界のWnt研究の進展に貢献したいと考えるようになり,2020年9月にアジアで初めてのWntミーティングを日本で開催することになった(本稿執筆時の6月に,新型コロナウイルス感染の影響を配慮して,開催を2022年に延期することを決定した).他の研究領域のようすを必ずしも承知しているわけではないが,Wntミーティングのように一つのキーワード(Wnt)で,“私”的な研究者の集まりが30年にわたって長く継続しているのは珍しいように思う.それは,Wntシグナルが生命の根源に重要であり,新たな知見が次の領域を生み出すために,常にWntシグナル研究に新たな研究者が参入するためであろう.Wntミーティングの存在が研究の発展に貢献しており,3年前から日本でも若手研究者が中心となって,自主的に日本版Wntミーティングを開催するようになったのは嬉しい限りである.
研究室を主宰するようになってから,酵母ツーハイブリッド法を用いて偶然に単離したAxinとAxilを手に,Wntシグナル研究の世界に入り,20数年が経った.この間に生物学,生命科学,医学に関する研究手法の技術革新が爆発的に進んだことに平行して,遺伝子,タンパク質,翻訳後修飾等の分子や単一細胞機能に着目する時代から,組織・器官・個体を,網羅的に大規模で可視的に,疾患や創薬と関連づけながら,より生命を俯瞰的にみる時代となった.私が若手研究者のときに教えられていた「生物学はSmall Scienceである」から「生物学はBig Scienceにもなりえる」時代へと変わってきた.Wnt研究領域においても,“Wnt”をキーワードにしながらも,研究者が興味を抱く視点も変化してきたように感じている.したがって,Wnt研究領域が拡大し続けている現状において,本稿はWnt研究の全体像が描かれているわけではないので,他のWntに関する総説を参考にしていただきたい.また,我々の研究成果にご興味をお持ちの方は研究室のホームページ(http://www.med.osaka-u.ac.jp/pub/molbiobc/)をご覧いただきたい.
新たな知見が増加する一方で,共通のシグナル経路が活性化されるにもかかわらずなぜ我々には19種類のWnt(リガンド)と10種類のFrizzled(受容体)が存在するのかという根源的な問題は解決されていない.この多様性の意義を理解するための地道な研究が今後もなされていくだろう.また,この20~30年間同一テーマで,たとえば一つの分子を解析し続けている研究者たちがいる.ヨーロッパの研究者に多いのであるが,彼らは「物事を突き詰めてこそ,真実と未来がある」という確固たる信念があるようで,その姿勢にいつも感心させられる.このような研究者への支援を継続できるヨーロッパの研究社会の懐の深さ,長い歴史,数多くの成功体験に見習うべき点が多数あるように思う.1細胞シーケンス,クライオ電顕,バイオインフォマティクス等次々と登場する新たな技術を駆使しながら,Wntシグナルが遺伝子型と表現型をつなぐ重要な生命システムの一つとして機能していることを示す新たな知見が,今後も多数見いだされることを願っている.
謝辞Acknowledgments
本稿で述べたWntシグナルに関する研究は,広島大学医学部生化学第一教室ならびに大阪大学医学系研究科分子病態生化学の多くの教員と大学院生とともに行ったものです.特に,広島大学で研究室を立ち上げる際に尽力していただいた岸田昭世博士(現鹿児島大学医学部教授),小山眞也博士(現就実大学薬学部教授),檜井孝夫博士(現広島大学病院特任教授)および長きにわたって教室を支えていただいている山本英樹准教授,松本真司助教に心から感謝の意を表します.
引用文献References
1) Zeng, L., Fagotto, F., Zhang, T., Hsu, W., Vasicek, T.J., Perry, W.L. 3rd, Lee, J.J., Tilghman, S.M., Gumbiner, B.M., & Costantini, F. (1997) The mouse Fused locus encodes Axin, an inhibitor of the Wnt signaling pathway that regulates embryonic axis formation. Cell, 90, 181–192.
2) Ikeda, S., Kishida, S., Yamamoto, H., Murai, H., Koyama, S., & Kikuchi, A. (1998) Axin, a negative regulator of the Wnt signaling pathway, forms a complex with GSK-3β and β-catenin and promotes GSK-3β-dependent phosphorylation of β-catenin. EMBO J., 17, 1371–1384.
3) Sharma, R.P. (1973) Wingless-A new mutant in Drosophila melanogaster. Drosoph. Inf. Serv., 50, 134.
4) Sharma, R.P. & Chopra, V.L. (1976) Effect of the Wingless (wg1) mutation on wing and haltere development in Drosophila melanogaster. Dev. Biol., 48, 461–465.
5) Nüsslein-Volhard, C. & Wieschaus, E. (1980) Mutations affecting segment number and polarity in Drosophila. Nature, 287, 795–801.
6) Bhanot, P., Brink, M., Samos, C.H., Hsieh, J.C., Wang, Y., Macke, J.P., Andrew, D., Nathans, J., & Nusse, R. (1996) A new member of the frizzled family from Drosophila functions as a Wingless receptor. Nature, 382, 225–230.
7) Klingensmith, J., Nusse, R., & Perrimon, N. (1994) The Drosophila segment polarity gene dishevelled encodes a novel protein required for response to the wingless signal. Genes Dev., 8, 118–130.
8) Siegfried, E., Chou, T.B., & Perrimon, N. (1992) Wingless signaling acts through zeste-white 3, the Drosophila homolog of glycogen synthase kinase-3, to regulate engrailed and establish cell fate. Cell, 71, 1167–1179.
9) Peifer, M., McCrea, P.D., Green, K.J., Wieschaus, E., & Gumbiner, B.M. (1992) The vertebrate adhesive junction proteins β-catenin and plakoglobin and the Drosophila segment polarity gene armadillo form a multigene family with similar properties. J. Cell Biol., 118, 681–691.
10) Bittner, J.J. (1936) Some possible effects of nursing on the mammary gland tumor incidence in mice. Science, 84, 162.
11) Lyons, M.J. & Moore, D.H. (1962) Purification of the mouse mammary tumour virus. Nature, 194, 1141–1142.
12) Hayward, W.S., Neel, B.G., & Astrin, S.M. (1981) Activation of a cellular onc gene by promoter insertion in ALV-induced lymphoid leukosis. Nature, 290, 475–480.
13) Nusse, R. & Varmus, H.E. (1982) Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome. Cell, 31, 99–109.
14) Santos, E., Tronick, S.R., Aaronson, S.A., Pulciani, S., & Barbacid, M. (1982) T24 human bladder carcinoma oncogene is an activated form of the normal human homologue of BALB- and Harvey-MSV transforming genes. Nature, 298, 343–347.
15) Parada, L.F., Tabin, C.J., Shih, C., & Weinberg, R.A. (1982) Human EJ bladder carcinoma oncogene is homologue of Harvey sarcoma virus ras gene. Nature, 297, 474–478.
16) Der, C.J., Krontiris, T.G., & Cooper, G.M. (1982) Transforming genes of human bladder and lung carcinoma cell lines are homologous to the ras genes of Harvey and Kirsten sarcoma viruses. Proc. Natl. Acad. Sci. USA, 79, 3637–3640.
17) van Ooyen, A. & Nusse, R. (1984) Structure and nucleotide sequence of the putative mammary oncogene int-1; proviral insertions leave the protein-encoding domain intact. Cell, 39, 233–240.
18) Tsukamoto, A.S., Grosschedl, R., Guzman, R.C., Parslow, T., & Varmus, H.E. (1988) Expression of the int-1 gene in transgenic mice is associated with mammary gland hyperplasia and adenocarcinomas in male and female mice. Cell, 55, 619–625.
19) Rijsewijk, F., Schuermann, M., Wagenaar, E., Parren, P., Weigel, D., & Nusse, R. (1987) The Drosophila homolog of the mouse mammary oncogene int-1 is identical to the segment polarity gene wingless. Cell, 50, 649–657.
20) Baker, N.E. (1987) Molecular cloning of sequences from wingless, a segment polarity gene in Drosophila: the spatial distribution of a transcript in embryos. EMBO J., 6, 1765–1773.
21) McMahon, A.P. & Moon, R.T. (1989) Ectopic expression of the proto-oncogene int-1 in Xenopus embryos leads to duplication of the embryonic axis. Cell, 58, 1075–1084.
22) Thomas, K.R. & Capecchi, M.R. (1990) Targeted disruption of the murine int-1 proto-oncogene resulting in severe abnormalities in midbrain and cerebellar development. Nature, 346, 847–850.
23) Thomas, K.R., Musci, T.S., Neumann, P.E., & Capecchi, M.R. (1991) Swaying is a mutant allele of the proto-oncogene Wnt-1. Cell, 67, 969–976.
24) Dickson, C., Smith, R., Brookes, S., & Peters, G. (1984) Tumorigenesis by mouse mammary tumor virus: proviral activation of a cellular gene in the common integration region int-2. Cell, 37, 529–536.
25) Gallahan, D. & Callahan, R. (1987) Mammary tumorigenesis in feral mice: identification of a new int locus in mouse mammary tumor virus (Czech II)-induced mammary tumors. J. Virol., 61, 66–74.
26) Roelink, H., Wagenaar, E., Lopes da Silva, S., & Nusse, R. (1990) Wnt-3, a gene activated by proviral insertion in mouse mammary tumors, is homologous to int-1/Wnt-1 and is normally expressed in mouse embryos and adult brain. Proc. Natl. Acad. Sci. USA, 87, 4519–4523.
27) Gavin, B.J., McMahon, J.A., & McMahon, A.P. (1990) Expression of multiple novel Wnt-1/int-1-related genes during fetal and adult mouse development. Genes Dev., 4(12B), 2319–2332.
28) Nusse, R., Brown, A., Papkoff, J., Scambler, P., Shackleford, G., McMahon, A., Moon, R., & Varmus, H. (1991) A new nomenclature for int-1 and related genes: the Wnt gene family. Cell, 64, 231.
29) 菊池章(1992)低分子量GTP結合タンパク質—その活性制御機構と機能.生化学,64, 1079–1102.
30) Takai, Y., Kaibuchi, K., Kikuchi, A., & Kawata, M. (1992) Small GTP-binding proteins. Int. Rev. Cytol., 133, 187–230.
31) Olofsson, B., Chardin, P., Touchot, N., Zahraoui, A., & Tavitian, A. (1988) Expression of the ras-related ralA, rho12 and rab genes in adult mouse tissues. Oncogene, 3, 231–234.
32) Kikuchi, A., Yamashita, T., Kawata, M., Yamamoto, K., Ikeda, K., Tanimoto, T., & Takai, Y. (1988) Purification and characterization of a novel GTP-binding protein with a molecular weight of 24,000 from bovine brain membranes. J. Biol. Chem., 263, 2897–2904.
33) Matsui, Y., Kikuchi, A., Kondo, J., Hishida, T., Teranishi, Y., & Takai, Y. (1988) Nucleotide and deduced amino acid sequences of a GTP-binding protein family with molecular weights of 25,000 from bovine brain. J. Biol. Chem., 263, 11071–11074.
34) Sasaki, T., Kikuchi, A., Araki, S., Hata, Y., Isomura, M., Kuroda, S., & Takai, Y. (1990) Purification and characterization from bovine brain cytosol of a protein that inhibits the dissociation of GDP from and the subsequent binding of GTP to smg p25A, a ras p21-like GTP-binding protein. J. Biol. Chem., 265, 2333–2337.
35) Ueda, T., Kikuchi, A., Ohga, N., Yamamoto, J., & Takai, Y. (1990) Purification and characterization from bovine brain cytosol of a novel regulatory protein inhibiting the dissociation of GDP from and the subsequent binding of GTP to rhoB p20, a ras p21-like GTP-binding protein. J. Biol. Chem., 265, 9373–9380.
36) van Amerongen, R. & Berns, A. (2006) Knockout mouse models to study Wnt signal transduction. Trends Genet., 22, 678–689.
37) Kusserow, A., Pang, K., Sturm, C., Hrouda, M., Lentfer, J., Schmidt, H.A., Technau, U., von Haeseler, A., Hobmayer, B., Martindale, M.Q., et al. (2005) Unexpected complexity of the Wnt gene family in a sea anemone. Nature, 433, 156–160.
38) Holstein, T.W. (2012) The evolution of the Wnt pathway. Cold Spring Harb. Perspect. Biol., 4, a007922.
39) Noordermeer, J., Klingensmith, J., Perrimon, N., & Nusse, R. (1994) dishevelled and armadillo act in the wingless signalling pathway in Drosophila. Nature, 367, 80–83.
40) Dickson, B., Sprenger, F., Morrison, D., & Hafen, E. (1992) Raf functions downstream of Ras1 in the Sevenless signal transduction pathway. Nature, 360, 600–603.
41) Wood, K.W., Sarnecki, C., Roberts, T.M., & Blenis, J. (1992) ras mediates nerve growth factor receptor modulation of three signal-transducing protein kinases: MAP kinase, Raf-1, and RSK. Cell, 68, 1041–1050.
42) Moodie, S.A., Willumsen, B.M., Weber, M.J., & Wolfman, A. (1993) Complexes of Ras.GTP with Raf-1 and mitogen-activated protein kinase kinase. Science, 260, 1658–1661.
43) van Leeuwen, F., Samos, C.H., & Nusse, R. (1994) Biological activity of soluble wingless protein in cultured Drosophila imaginal disc cells. Nature, 368, 342–344.
44) Yanagawa, S.-I., van Leeuwen, F., Wodarz, A., Klingensmith, J., & Nusse, R. (1995) The Dishevelled protein is modified by Wingless signaling in Drosophila. Genes Dev., 9, 1087–1097.
45) Siegfried, E., Wilder, E.L., & Perrimon, N. (1994) Components of wingless signalling in Drosophila. Nature, 367, 76–80.
46) Ruel, L., Bourouis, M., Heitzler, P., Pantesco, V., & Simpson, P. (1993) Drosophila shaggy kinase and rat glycogen synthase kinase-3 have conserved activities and act downstream of Notch. Nature, 362, 557–560.
47) McCrea, P.D., Turck, C.W., & Gumbiner, B. (1991) A homolog of the armadillo protein in Drosophila (plakoglobin) associated with E-cadherin. Science, 254, 1359–1361.
48) Woodgett, J.R. (2001) Judging a protein by more than its name: GSK-3. Sci. STKE, 2001, re12.
49) Cohen, P. & Frame, S. (2001) The renaissance of GSK3. Nat. Rev. Mol. Cell Biol., 2, 769–776.
50) Takeichi, M. (2014) Dynamic contacts: rearranging adherens junctions to drive epithelial remodelling. Nat. Rev. Mol. Cell Biol., 15, 397–410.
51) 竹市雅俊(2019)細胞間接着装置の仕組みを探る.生化学,91, 500–513.
52) He, X., Saint-Jeannet, J.P., Woodgett, J.R., Varmus, H.E., & Dawid, I.B. (1995) Glycogen synthase kinase-3 and dorsoventral patterning in Xenopus embryos. Nature, 374, 617–622.
53) Yost, C., Torres, M., Miller, J.R., Huang, E., Kimelman, D., & Moon, R.T. (1996) The axis-inducing activity, stability, and subcellular distribution of β-catenin is regulated in Xenopus embryos by glycogen synthase kinase 3. Genes Dev., 10, 1443–1454.
54) Aberle, H., Bauer, A., Stappert, J., Kispert, A., & Kemler, R. (1997) β-catenin is a target for the ubiquitin-proteasome pathway. EMBO J., 16, 3797–3804.
55) Kinzler, K.W., Nilbert, M.C., Su, L.K., Vogelstein, B., Bryan, T.M., Levy, D.B., Smith, K.J., Preisinger, A.C., Hedge, P., McKechnie, D., et al. (1991) Identification of FAP locus genes from chromosome 5q21. Science, 253, 661–665.
56) Su, L.K., Kinzler, K.W., Vogelstein, B., Preisinger, A.C., Moser, A.R., Luongo, C., Gould, K.A., & Dove, W.F. (1992) Multiple intestinal neoplasia caused by a mutation in the murine homolog of the APC gene. Science, 256, 668–670.
57) Su, L.K., Vogelstein, B., & Kinzler, K.W. (1993) Association of the APC tumor suppressor protein with catenins. Science, 262, 1734–1737.
58) Rubinfeld, B., Souza, B., Albert, I., Muller, O., Chamberlain, S.H., Masiarz, F.R., Munemitsu, S., & Polakis, P. (1993) Association of the APC gene product with β-catenin. Science, 262, 1731–1734.
59) Funayama, N., Fagotto, F., McCrea, P., & Gumbiner, B.M. (1995) Embryonic axis induction by the armadillo repeat domain of β-catenin: evidence for intracellular signaling. J. Cell Biol., 128, 959–968.
60) Behrens, J., von Kries, J.P., Kuhl, M., Bruhn, L., Wedlich, D., Grosschedl, R., & Birchmeier, W. (1996) Functional interaction of β-catenin with the transcription factor LEF-1. Nature, 382, 638–642.
61) Molenaar, M., van de Wetering, M., Oosterwegel, M., Peterson-Maduro, J., Godsave, S., Korinek, V., Roose, J., Destree, O., & Clevers, H. (1996) XTcf-3 transcription factor mediates beta-catenin-induced axis formation in Xenopus embryos. Cell, 86, 391–399.
62) Brunner, E., Peter, O., Schweizer, L., & Basler, K. (1997) pangolin encodes a Lef-1 homologue that acts downstream of Armadillo to transduce the Wingless signal in Drosophila. Nature, 385, 829–833.
63) Rubinfeld, B., Albert, I., Porfiri, E., Fiol, C., Munemitsu, S., & Polakis, P. (1996) Binding of GSK3β to the APC-β-catenin complex and regulation of complex assembly. Science, 272, 1023–1026.
64) Yamamoto, H., Kishida, S., Uochi, T., Ikeda, S., Koyama, S., Asashima, M., & Kikuchi, A. (1998) Axil, a member of the Axin family, interacts with both glycogen synthase kinase 3β and β-catenin and inhibits axis formation of Xenopus embryos. Mol. Cell. Biol., 18, 2867–2875.
65) Kishida, S., Yamamoto, H., Ikeda, S., Kishida, M., Sakamoto, I., Koyama, S., & Kikuchi, A. (1998) Axin, a negative regulator of the wnt signaling pathway, directly interacts with adenomatous polyposis coli and regulates the stabilization of β-catenin. J. Biol. Chem., 273, 10823–10826.
66) Kishida, S., Yamamoto, H., Hino, S., Ikeda, S., Kishida, M., & Kikuchi, A. (1999) DIX domains of Dvl and axin are necessary for protein interactions and their ability to regulate β-catenin stability. Mol. Cell. Biol., 19, 4414–4422.
67) Hinoi, T., Yamamoto, H., Kishida, M., Takada, S., Kishida, S., & Kikuchi, A. (2000) Complex formation of adenomatous polyposis coli gene product and axin facilitates glycogen synthase kinase-3β-dependent phosphorylation of β-catenin and down-regulates β-catenin. J. Biol. Chem., 275, 34399–34406.
68) Liu, C., Li, Y., Semenov, M., Han, C., Baeg, G.H., Tan, Y., Zhang, Z., Lin, X., & He, X. (2002) Control of β-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell, 108, 837–847.
69) Kitagawa, M., Hatakeyama, S., Shirane, M., Matsumoto, M., Ishida, N., Hattori, K., Nakamichi, I., Kikuchi, A., Nakayama, K., & Nakayama, K. (1999) An F-box protein, FWD1, mediates ubiquitin-dependent proteolysis of β-catenin. EMBO J., 18, 2401–2410.
70) Hart, M.J., de los Santos, R., Albert, I.N., Rubinfeld, B., & Polakis, P. (1998) Downregulation of β-catenin by human Axin and its association with the APC tumor suppressor, β-catenin and GSK3β. Curr. Biol., 8, 573–581.
71) Sakanaka, C., Weiss, J.B., & Williams, L.T. (1998) Bridging of β-catenin and glycogen synthase kinase-3β by axin and inhibition of β-catenin-mediated transcription. Proc. Natl. Acad. Sci. USA, 95, 3020–3023.
72) Behrens, J., Jerchow, B.A., Wurtele, M., Grimm, J., Asbrand, C., Wirtz, R., Kuhl, M., Wedlich, D., & Birchmeier, W. (1998) Functional interaction of an axin homolog, conductin, with β-catenin, APC, and GSK3β. Science, 280, 596–599.
73) Jho, E.H., Zhang, T., Domon, C., Joo, C.K., Freund, J.N., & Costantini, F. (2002) Wnt/β-catenin/Tcf signaling induces the transcription of Axin2, a negative regulator of the signaling pathway. Mol. Cell. Biol., 22, 1172–1183.
74) Mai, M., Qian, C., Yokomizo, A., Smith, D.I., & Liu, W. (1999) Cloning of the human homolog of conductin (AXIN2), a gene mapping to chromosome 17q23-q24. Genomics, 55, 341–344.
75) Vinson, C.R., Conover, S., & Adler, P.N. (1989) A Drosophila tissue polarity locus encodes a protein containing seven potential transmembrane domains. Nature, 338, 263–264.
76) Perrimon, N. & Mahowald, A.P. (1987) Multiple functions of segment polarity genes in Drosophila. Dev. Biol., 119, 587–600.
77) Kurayoshi, M., Oue, N., Yamamoto, H., Kishida, M., Inoue, A., Asahara, T., Yasui, W., & Kikuchi, A. (2006) Expression of Wnt-5a is correlated with aggressiveness of gastric cancer by stimulating cell migration and invasion. Cancer Res., 66, 10439–10448.
78) Kurayoshi, M., Yamamoto, H., Izumi, S., & Kikuchi, A. (2007) Post-translational palmitoylation and glycosylation of Wnt-5a are necessary for its signalling. Biochem. J., 402, 515–523.
79) Yamamoto, H., Kitadai, Y., Yamamoto, H., Oue, N., Ohdan, H., Yasui, W., & Kikuchi, A. (2009) Laminin γ2 mediates Wnt5a-induced invasion of gastric cancer cells. Gastroenterology, 137, 242–252.e6.
80) Matsumoto, S., Fumoto, K., Okamoto, T., Kaibuchi, K., & Kikuchi, A. (2010) Binding of APC and dishevelled mediates Wnt5a-regulated focal adhesion dynamics in migrating cells. EMBO J., 29, 1192–1204.
81) Sato, A., Yamamoto, H., Sakane, H., Koyama, H., & Kikuchi, A. (2010) Wnt5a regulates distinct signalling pathways by binding to Frizzled2. EMBO J., 29, 41–54.
82) Yamamoto, H., Oue, N., Sato, A., Hasegawa, Y., Matsubara, A., Yamamoto, H., Yasui, W., & Kikuchi, A. (2010) Wnt5a signaling is involved in the aggressiveness of prostate cancer and expression of metalloproteinase. Oncogene, 29, 2036–2046.
83) Fumoto, K., Kikuchi, K., Gon, H., & Kikuchi, A. (2012) Wnt5a signaling controls cytokinesis by correctly positioning ESCRT-III at the midbody. J. Cell Sci., 125, 4822–4832.
84) Hanaki, H., Yamamoto, H., Sakane, H., Matsumoto, S., Ohdan, H., Sato, A., & Kikuchi, A. (2012) An anti-Wnt5a antibody suppresses metastasis of gastric cancer cells in vivo by inhibiting receptor-mediated endocytosis. Mol. Cancer Ther., 11, 298–307.
85) Sato, A., Kayama, H., Shojima, K., Matsumoto, S., Koyama, H., Minami, Y., Nojima, S., Morii, E., Honda, H., Takeda, K., et al. (2015) The Wnt5a-Ror2 axis promotes the signaling circuit between interleukin-12 and interferon-gamma in colitis. Sci. Rep., 5, 10536.
86) Shojima, K., Sato, A., Hanaki, H., Tsujimoto, I., Nakamura, M., Hattori, K., Sato, Y., Dohi, K., Hirata, M., Yamamoto, H., et al. (2015) Wnt5a promotes cancer cell invasion and proliferation by receptor-mediated endocytosis-dependent and -independent mechanisms, respectively. Sci. Rep., 5, 8042.
87) Veeman, M.T., Axelrod, J.D., & Moon, R.T. (2003) A second canon. Functions and mechanisms of β-catenin-independent Wnt signaling. Dev. Cell, 5, 367–377.
88) Kikuchi, A., Yamamoto, H., Sato, A., & Matsumoto, S. (2012) Wnt5a: its signalling, functions and implication in diseases. Acta Physiol. (Oxf.), 204, 17–33.
89) Humphries, A.C. & Mlodzik, M. (2018) From instruction to output: Wnt/PCP signaling in development and cancer. Curr. Opin. Cell Biol., 51, 110–116.
90) Wehrli, M., Dougan, S.T., Caldwell, K., O’Keefe, L., Schwartz, S., Vaizel-Ohayon, D., Schejter, E., Tomlinson, A., & DiNardo, S. (2000) arrow encodes an LDL-receptor-related protein essential for Wingless signalling. Nature, 407, 527–530.
91) Tamai, K., Semenov, M., Kato, Y., Spokony, R., Liu, C., Katsuyama, Y., Hess, F., Saint-Jeannet, J.P., & He, X. (2000) LDL-receptor-related proteins in Wnt signal transduction. Nature, 407, 530–535.
92) Pinson, K.I., Brennan, J., Monkley, S., Avery, B.J., & Skarnes, W.C. (2000) An LDL-receptor-related protein mediates Wnt signalling in mice. Nature, 407, 535–538.
93) Mao, J., Wang, J., Liu, B., Pan, W., Farr, G.H. 3rd, Flynn, C., Yuan, H., Takada, S., Kimelman, D., Li, L., et al. (2001) Low-density lipoprotein receptor-related protein-5 binds to Axin and regulates the canonical Wnt signaling pathway. Mol. Cell, 7, 801–809.
94) Davidson, G., Wu, W., Shen, J., Bilic, J., Fenger, U., Stannek, P., Glinka, A., & Niehrs, C. (2005) Casein kinase 1 gamma couples Wnt receptor activation to cytoplasmic signal transduction. Nature, 438, 867–872.
95) Zeng, X., Tamai, K., Doble, B., Li, S., Huang, H., Habas, R., Okamura, H., Woodgett, J., & He, X. (2005) A dual-kinase mechanism for Wnt co-receptor phosphorylation and activation. Nature, 438, 873–877.
96) Van der Flier, L.G., Sabates-Bellver, J., Oving, I., Haegebarth, A., De Palo, M., Anti, M., Van Gijn, M.E., Suijkerbuijk, S., Van de Wetering, M., Marra, G., et al. (2007) The Intestinal Wnt/TCF Signature. Gastroenterology, 132, 628–632.
97) de Lau, W., Barker, N., Low, T.Y., Koo, B.K., Li, V.S., Teunissen, H., Kujala, P., Haegebarth, A., Peters, P.J., van de Wetering, M., et al. (2011) Lgr5 homologues associate with Wnt receptors and mediate R-spondin signalling. Nature, 476, 293–297.
98) Kamata, T., Katsube, K., Michikawa, M., Yamada, M., Takada, S., & Mizusawa, H. (2004) R-spondin, a novel gene with thrombospondin type 1 domain, was expressed in the dorsal neural tube and affected in Wnts mutants. Biochim. Biophys. Acta, 1676, 51–62.
99) Parma, P., Radi, O., Vidal, V., Chaboissier, M.C., Dellambra, E., Valentini, S., Guerra, L., Schedl, A., & Camerino, G. (2006) R-spondin1 is essential in sex determination, skin differentiation and malignancy. Nat. Genet., 38, 1304–1309.
100) Tomizuka, K., Horikoshi, K., Kitada, R., Sugawara, Y., Iba, Y., Kojima, A., Yoshitome, A., Yamawaki, K., Amagai, M., Inoue, A., et al. (2008) R-spondin1 plays an essential role in ovarian development through positively regulating Wnt-4 signaling. Hum. Mol. Genet., 17, 1278–1291.
101) Kim, K.A., Kakitani, M., Zhao, J., Oshima, T., Tang, T., Binnerts, M., Liu, Y., Boyle, B., Park, E., Emtage, P., et al. (2005) Mitogenic influence of human R-spondin1 on the intestinal epithelium. Science, 309, 1256–1259.
102) Carmon, K.S., Gong, X., Lin, Q., Thomas, A., & Liu, Q. (2011) R-spondins function as ligands of the orphan receptors LGR4 and LGR5 to regulate Wnt/β-catenin signaling. Proc. Natl. Acad. Sci. USA, 108, 11452–11457.
103) Glinka, A., Dolde, C., Kirsch, N., Huang, Y.L., Kazanskaya, O., Ingelfinger, D., Boutros, M., Cruciat, C.M., & Niehrs, C. (2011) LGR4 and LGR5 are R-spondin receptors mediating Wnt/β-catenin and Wnt/PCP signalling. EMBO Rep., 12, 1055–1061.
104) Ruffner, H., Sprunger, J., Charlat, O., Leighton-Davies, J., Grosshans, B., Salathe, A., Zietzling, S., Beck, V., Therier, M., Isken, A. et al. (2012) R-Spondin potentiates Wnt/β-catenin signaling through orphan receptors LGR4 and LGR5. PLoS One, 7, e40976.
105) Mukai, A., Yamamoto-Hino, M., Awano, W., Watanabe, W., Komada, M., & Goto, S. (2010) Balanced ubiquitylation and deubiquitylation of Frizzled regulate cellular responsiveness to Wg/Wnt. EMBO J., 29, 2114–2125.
106) Hao, H.X., Xie, Y., Zhang, Y., Charlat, O., Oster, E., Avello, M., Lei, H., Mickanin, C., Liu, D., Ruffner, H., et al. (2012) ZNRF3 promotes Wnt receptor turnover in an R-spondin-sensitive manner. Nature, 485, 195–200.
107) Koo, B.K., Spit, M., Jordens, I., Low, T.Y., Stange, D.E., van de Wetering, M., van Es, J.H., Mohammed, S., Heck, A.J., Maurice, M.M., et al. (2012) Tumour suppressor RNF43 is a stem-cell E3 ligase that induces endocytosis of Wnt receptors. Nature, 488, 665–669.
108) Sorkin, A. & von Zastrow, M. (2009) Endocytosis and signalling: intertwining molecular networks. Nat. Rev. Mol. Cell Biol., 10, 609–622.
109) Yamamoto, H., Komekado, H., & Kikuchi, A. (2006) Caveolin is necessary for Wnt-3a-dependent internalization of LRP6 and accumulation of β-catenin. Dev. Cell, 11, 213–223.
110) Yamamoto, H., Sakane, H., Yamamoto, H., Michiue, T., & Kikuchi, A. (2008) Wnt3a and Dkk1 regulate distinct internalization pathways of LRP6 to tune the activation of β-catenin signaling. Dev. Cell, 15, 37–48.
111) Sakane, H., Yamamoto, H., & Kikuchi, A. (2010) LRP6 is internalized by Dkk1 to suppress its phosphorylation in the lipid raft and is recycled for reuse. J. Cell Sci., 123, 360–368.
112) Kikuchi, A., Yamamoto, H., & Sato, A. (2009) Selective activation mechanisms of Wnt signaling pathways. Trends Cell Biol., 19, 119–129.
113) Sada, R., Kimura, H., Fukata, Y., Fukata, M., Yamamoto, H., & Kikuchi, A. (2019) Dynamic palmitoylation controls the microdomain localization of the DKK1 receptors CKAP4 and LRP6. Sci. Signal., 12, 12.
114) Jiang, Y., He, X., & Howe, P.H. (2012) Disabled-2 (Dab2) inhibits Wnt/β-catenin signalling by binding LRP6 and promoting its internalization through clathrin. EMBO J., 31, 2336–2349.
115) Gagliardi, M., Hernandez, A., McGough, I.J., & Vincent, J.P. (2014) Inhibitors of endocytosis prevent Wnt/Wingless signalling by reducing the level of basal β-catenin/Armadillo. J. Cell Sci., 127, 4918–4926.
116) Demir, K., Kirsch, N., Beretta, C.A., Erdmann, G., Ingelfinger, D., Moro, E., Argenton, F., Carl, M., Niehrs, C., & Boutros, M. (2013) RAB8B is required for activity and caveolar endocytosis of LRP6. Cell Rep., 4, 1224–1234.
117) Niehrs, C. (2012) The complex world of WNT receptor signalling. Nat. Rev. Mol. Cell Biol., 13, 767–779.
118) Kikuchi, A., Yamamoto, H., Sato, A., & Matsumoto, S. (2011) New insights into the mechanism of wnt signaling pathway activation. Int. Rev. Cell Mol. Biol., 291, 21–71.
119) Willert, K., Brown, J.D., Danenberg, E., Duncan, A.W., Weissman, I.L., Reya, T., Yates, J.R. 3rd, & Nusse, R. (2003) Wnt proteins are lipid-modified and can act as stem cell growth factors. Nature, 423, 448–452.
120) Takada, R., Satomi, Y., Kurata, T., Ueno, N., Norioka, S., Kondoh, H., Takao, T., & Takada, S. (2006) Monounsaturated fatty acid modification of Wnt protein: its role in Wnt secretion. Dev. Cell, 11, 791–801.
121) Yamamoto, H., Awada, C., Hanaki, H., Sakane, H., Tsujimoto, I., Takahashi, Y., Takao, T., & Kikuchi, A. (2013) The apical and basolateral secretion of Wnt11 and Wnt3a in polarized epithelial cells is regulated by different mechanisms. J. Cell Sci., 126, 2931–2943.
122) Yamamoto, H., Awada, C., Matsumoto, S., Kaneiwa, T., Sugimoto, T., Takao, T., & Kikuchi, A. (2015) Basolateral secretion of Wnt5a in polarized epithelial cells is required for apical lumen formation. J. Cell Sci., 128, 1051–1063.
123) Yamamoto, H., Sato, A., & Kikuchi, A. (2017) Apical secretion of Wnt1 in polarized epithelial cells is regulated by exocyst-mediated trafficking. J. Biochem., 162, 317–326.
124) Harada, T., Yamamoto, H., Kishida, S., Kishida, M., Awada, C., Takao, T., & Kikuchi, A. (2017) Wnt5b-associated exosomes promote cancer cell migration and proliferation. Cancer Sci., 108, 42–52.
125) Kishida, S., Yamamoto, H., & Kikuchi, A. (2004) Wnt-3a and Dvl induce neurite retraction by activating Rho-associated kinase. Mol. Cell. Biol., 24, 4487–4501.
126) Komekado, H., Yamamoto, H., Chiba, T., & Kikuchi, A. (2007) Glycosylation and palmitoylation of Wnt-3a are coupled to produce an active form of Wnt-3a. Genes Cells, 12, 521–534.
127) Janda, C.Y., Waghray, D., Levin, A.M., Thomas, C., & Garcia, K.C. (2012) Structural basis of Wnt recognition by Frizzled. Science, 337, 59–64.
128) Mihara, E., Hirai, H., Yamamoto, H., Tamura-Kawakami, K., Matano, M., Kikuchi, A., Sato, T., & Takagi, J. (2016) Active and water-soluble form of lipidated Wnt protein is maintained by a serum glycoprotein afamin/alpha-albumin. eLife, 5, 5.
129) Janda, C.Y., Dang, L.T., You, C., Chang, J., de Lau, W., Zhong, Z.A., Yan, K.S., Marecic, O., Siepe, D., Li, X., et al. (2017) Surrogate Wnt agonists that phenocopy canonical Wnt and β-catenin signalling. Nature, 545, 234–237.
130) Sato, N., Meijer, L., Skaltsounis, L., Greengard, P., & Brivanlou, A.H. (2004) Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nat. Med., 10, 55–63.
131) Kielman, M.F., Rindapaa, M., Gaspar, C., van Poppel, N., Breukel, C., van Leeuwen, S., Taketo, M.M., Roberts, S., Smits, R., & Fodde, R. (2002) Apc modulates embryonic stem-cell differentiation by controlling the dosage of β-catenin signaling. Nat. Genet., 32, 594–605.
132) Tesar, P.J., Chenoweth, J.G., Brook, F.A., Davies, T.J., Evans, E.P., Mack, D.L., Gardner, R.L., & McKay, R.D. (2007) New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature, 448, 196–199.
133) Naito, A.T., Shiojima, I., Akazawa, H., Hidaka, K., Morisaki, T., Kikuchi, A., & Komuro, I. (2006) Developmental stage-specific biphasic roles of Wnt/β-catenin signaling in cardiomyogenesis and hematopoiesis. Proc. Natl. Acad. Sci. USA, 103, 19812–19817.
134) Barker, N., van Es, J.H., Kuipers, J., Kujala, P., van den Born, M., Cozijnsen, M., Haegebarth, A., Korving, J., Begthel, H., Peters, P.J., et al. (2007) Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003–1007.
135) Sato, T., Vries, R.G., Snippert, H.J., van de Wetering, M., Barker, N., Stange, D.E., van Es, J.H., Abo, A., Kujala, P., Peters, P.J., et al. (2009) Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 262–265.
136) Jung, P., Sato, T., Merlos-Suarez, A., Barriga, F.M., Iglesias, M., Rossell, D., Auer, H., Gallardo, M., Blasco, M.A., Sancho, E., et al. (2011) Isolation and in vitro expansion of human colonic stem cells. Nat. Med., 17, 1225–1227.
137) Sato, T., van Es, J.H., Snippert, H.J., Stange, D.E., Vries, R.G., van den Born, M., Barker, N., Shroyer, N.F., van de Wetering, M., & Clevers, H. (2011) Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature, 469, 415–418.
138) Rothenberg, M.E., Nusse, Y., Kalisky, T., Lee, J.J., Dalerba, P., Scheeren, F., Lobo, N., Kulkarni, S., Sim, S., Qian, D., et al. (2012) Identification of a cKit(+) colonic crypt base secretory cell that supports Lgr5(+) stem cells in mice. Gastroenterology, 142, 1195–1205.e1196.
139) Date, S. & Sato, T. (2015) Mini-gut organoids: reconstitution of the stem cell niche. Annu. Rev. Cell Dev. Biol., 31, 269–289.
140) Leung, C., Tan, S.H., & Barker, N. (2018) Recent Advances in Lgr5(+) Stem Cell Research. Trends Cell Biol., 28, 380–391.
141) Yui, S., Nakamura, T., Sato, T., Nemoto, Y., Mizutani, T., Zheng, X., Ichinose, S., Nagaishi, T., Okamoto, R., Tsuchiya, K., et al. (2012) Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5(+) stem cell. Nat. Med., 18, 618–623.
142) Sigal, M., Logan, C.Y., Kapalczynska, M., Mollenkopf, H.J., Berger, H., Wiedenmann, B., Nusse, R., Amieva, M.R., & Meyer, T.F. (2017) Stromal R-spondin orchestrates gastric epithelial stem cells and gland homeostasis. Nature, 548, 451–455.
143) Hoeck, J.D., Biehs, B., Kurtova, A.V., Kljavin, N.M., de Sousa, E.M.F., Alicke, B., Koeppen, H., Modrusan, Z., Piskol, R., & de Sauvage, F.J. (2017) Stem cell plasticity enables hair regeneration following Lgr5(+) cell loss. Nat. Cell Biol., 19, 666–676.
144) Jadhav, U., Saxena, M., O’Neill, N.K., Saadatpour, A., Yuan, G.C., Herbert, Z., Murata, K., & Shivdasani, R.A. (2017) Dynamic Reorganization of Chromatin Accessibility Signatures during Dedifferentiation of Secretory Precursors into Lgr5+ Intestinal Stem Cells. Cell Stem Cell, 21, 65–77.e65.
145) Leushacke, M., Tan, S.H., Wong, A., Swathi, Y., Hajamohideen, A., Tan, L.T., Goh, J., Wong, E., Denil, S., Murakami, K., et al. (2017) Lgr5-expressing chief cells drive epithelial regeneration and cancer in the oxyntic stomach. Nat. Cell Biol., 19, 774–786.
146) Huch, M., Dorrell, C., Boj, S.F., van Es, J.H., Li, V.S., van de Wetering, M., Sato, T., Hamer, K., Sasaki, N., Finegold, M.J., et al. (2013) In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature, 494, 247–250.
147) Planas-Paz, L., Orsini, V., Boulter, L., Calabrese, D., Pikiolek, M., Nigsch, F., Xie, Y., Roma, G., Donovan, A., Marti, P., et al. (2016) The RSPO-LGR4/5-ZNRF3/RNF43 module controls liver zonation and size. Nat. Cell Biol., 18, 467–479.
148) Wang, B., Zhao, L., Fish, M., Logan, C.Y., & Nusse, R. (2015) Self-renewing diploid Axin2(+) cells fuel homeostatic renewal of the liver. Nature, 524, 180–185.
149) Varga, J. & Greten, F.R. (2017) Cell plasticity in epithelial homeostasis and tumorigenesis. Nat. Cell Biol., 19, 1133–1141.
150) de Sousa e Melo, F., Kurtova, A.V., Harnoss, J.M., Kljavin, N., Hoeck, J.D., Hung, J., Anderson, J.E., Storm, E.E., Modrusan, Z., Koeppen, H., et al.; de Sousa e Melo. (2017) A distinct role for Lgr5(+) stem cells in primary and metastatic colon cancer. Nature, 543, 676–680.
151) Barker, N., Ridgway, R.A., van Es, J.H., van de Wetering, M., Begthel, H., van den Born, M., Danenberg, E., Clarke, A.R., Sansom, O.J., & Clevers, H. (2009) Crypt stem cells as the cells-of-origin of intestinal cancer. Nature, 457, 608–611.
152) Li, X.B., Yang, G., Zhu, L., Tang, Y.L., Zhang, C., Ju, Z., Yang, X., & Teng, Y. (2016) Gastric Lgr5(+) stem cells are the cellular origin of invasive intestinal-type gastric cancer in mice. Cell Res., 26, 838–849.
153) Schepers, A.G., Snippert, H.J., Stange, D.E., van den Born, M., van Es, J.H., van de Wetering, M., & Clevers, H. (2012) Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas. Science, 337, 730–735.
154) Shimokawa, M., Ohta, Y., Nishikori, S., Matano, M., Takano, A., Fujii, M., Date, S., Sugimoto, S., Kanai, T., & Sato, T. (2017) Visualization and targeting of LGR5(+) human colon cancer stem cells. Nature, 545, 187–192.
155) Martinez-Outschoorn, U.E., Peiris-Pages, M., Pestell, R.G., Sotgia, F., & Lisanti, M.P. (2017) Cancer metabolism: a therapeutic perspective. Nat. Rev. Clin. Oncol., 14, 11–31.
156) Rodríguez-Colman, M.J., Schewe, M., Meerlo, M., Stigter, E., Gerrits, J., Pras-Raves, M., Sacchetti, A., Hornsveld, M., Oost, K.C., Snippert, H.J., et al. (2017) Interplay between metabolic identities in the intestinal crypt supports stem cell function. Nature, 543, 424–427.
157) Schell, J.C., Wisidagama, D.R., Bensard, C., Zhao, H., Wei, P., Tanner, J., Flores, A., Mohlman, J., Sorensen, L.K., Earl, C.S., et al. (2017) Control of intestinal stem cell function and proliferation by mitochondrial pyruvate metabolism. Nat. Cell Biol., 19, 1027–1036.
158) Pate, K.T., Stringari, C., Sprowl-Tanio, S., Wang, K., TeSlaa, T., Hoverter, N.P., McQuade, M.M., Garner, C., Digman, M.A., Teitell, M.A., et al. (2014) Wnt signaling directs a metabolic program of glycolysis and angiogenesis in colon cancer. EMBO J., 33, 1454–1473.
159) Moon, R.T., Kohn, A.D., De Ferrari, G.V., & Kaykas, A. (2004) WNT and β-catenin signalling: diseases and therapies. Nat. Rev. Genet., 5, 691–701.
160) 菊池章(2009)Wntシグナルネットワークとその異常による病態.生化学,81, 780–792.
161) Polakis, P. (2012) Drugging Wnt signalling in cancer. EMBO J., 31, 2737–2746.
162) Nusse, R. & Clevers, H. (2017) Wnt/β-catenin signaling, disease, and emerging therapeutic modalities. Cell, 169, 985–999.
163) Boyden, L.M., Mao, J., Belsky, J., Mitzner, L., Farhi, A., Mitnick, M.A., Wu, D., Insogna, K., & Lifton, R.P. (2002) High bone density due to a mutation in LDL-receptor-related protein 5. N. Engl. J. Med., 346, 1513–1521.
164) Zhang, Y., Wang, Y., Li, X., Zhang, J., Mao, J., Li, Z., Zheng, J., Li, L., Harris, S., & Wu, D. (2004) The LRP5 high-bone-mass G171V mutation disrupts LRP5 interaction with Mesd. Mol. Cell. Biol., 24, 4677–4684.
165) Bodine, P.V., Zhao, W., Kharode, Y.P., Bex, F.J., Lambert, A.J., Goad, M.B., Gaur, T., Stein, G.S., Lian, J.B., & Komm, B.S. (2004) The Wnt antagonist secreted frizzled-related protein-1 is a negative regulator of trabecular bone formation in adult mice. Mol. Endocrinol., 18, 1222–1237.
166) Gong, Y., Slee, R.B., Fukai, N., Rawadi, G., Roman-Roman, S., Reginato, A.M., Wang, H., Cundy, T., Glorieux, F.H., Lev, D., et al., Osteoporosis-Pseudoglioma Syndrome Collaborative Group. (2001) LDL receptor-related protein 5 (LRP5) affects bone accrual and eye development. Cell, 107, 513–523.
167) Harada, S. & Rodan, G.A. (2003) Control of osteoblast function and regulation of bone mass. Nature, 423, 349–355.
168) Li, X., Zhang, Y., Kang, H., Liu, W., Liu, P., Zhang, J., Harris, S.E., & Wu, D. (2005) Sclerostin binds to LRP5/6 and antagonizes canonical Wnt signaling. J. Biol. Chem., 280, 19883–19887.
169) Li, X., Ominsky, M.S., Warmington, K.S., Morony, S., Gong, J., Cao, J., Gao, Y., Shalhoub, V., Tipton, B., Haldankar, R., et al. (2009) Sclerostin antibody treatment increases bone formation, bone mass, and bone strength in a rat model of postmenopausal osteoporosis. J. Bone Miner. Res., 24, 578–588.
170) Langdahl, B.L., Libanati, C., Crittenden, D.B., Bolognese, M.A., Brown, J.P., Daizadeh, N.S., Dokoupilova, E., Engelke, K., Finkelstein, J.S., Genant, H.K., et al. (2017) Romosozumab (sclerostin monoclonal antibody) versus teriparatide in postmenopausal women with osteoporosis transitioning from oral bisphosphonate therapy: a randomised, open-label, phase 3 trial. Lancet, 390, 1585–1594.
171) Anastas, J.N. & Moon, R.T. (2013) WNT signalling pathways as therapeutic targets in cancer. Nat. Rev. Cancer, 13, 11–26.
172) Zhan, T., Rindtorff, N., & Boutros, M. (2017) Wnt signaling in cancer. Oncogene, 36, 1461–1473.
173) Jiang, X., Hao, H.X., Growney, J.D., Woolfenden, S., Bottiglio, C., Ng, N., Lu, B., Hsieh, M.H., Bagdasarian, L., Meyer, R., et al. (2013) Inactivating mutations of RNF43 confer Wnt dependency in pancreatic ductal adenocarcinoma. Proc. Natl. Acad. Sci. USA, 110, 12649–12654.
174) Dodge, M.E., Moon, J., Tuladhar, R., Lu, J., Jacob, L.S., Zhang, L.S., Shi, H., Wang, X., Moro, E., Mongera, A., et al. (2012) Diverse chemical scaffolds support direct inhibition of the membrane-bound O-acyltransferase porcupine. J. Biol. Chem., 287, 23246–23254.
175) Madan, B., Ke, Z., Harmston, N., Ho, S.Y., Frois, A.O., Alam, J., Jeyaraj, D.A., Pendharkar, V., Ghosh, K., Virshup, I.H., et al. (2016) Wnt addiction of genetically defined cancers reversed by PORCN inhibition. Oncogene, 35, 2197–2207.
176) Gurney, A., Axelrod, F., Bond, C.J., Cain, J., Chartier, C., Donigan, L., Fischer, M., Chaudhari, A., Ji, M., Kapoun, A.M., et al. (2012) Wnt pathway inhibition via the targeting of Frizzled receptors results in decreased growth and tumorigenicity of human tumors. Proc. Natl. Acad. Sci. USA, 109, 11717–11722.
177) Gang, E.J., Hsieh, Y.T., Pham, J., Zhao, Y., Nguyen, C., Huantes, S., Park, E., Naing, K., Klemm, L., Swaminathan, S., et al. (2014) Small-molecule inhibition of CBP/catenin interactions eliminates drug-resistant clones in acute lymphoblastic leukemia. Oncogene, 33, 2169–2178.
178) Huang, S.M., Mishina, Y.M., Liu, S., Cheung, A., Stegmeier, F., Michaud, G.A., Charlat, O., Wiellette, E., Zhang, Y., Wiessner, S., et al. (2009) Tankyrase inhibition stabilizes axin and antagonizes Wnt signalling. Nature, 461, 614–620.
179) Hogan, B.L. & Kolodziej, P.A. (2002) Organogenesis: molecular mechanisms of tubulogenesis. Nat. Rev. Genet., 3, 513–523.
180) Matsumoto, S., Kurimoto, T., Taketo, M.M., Fujii, S., & Kikuchi, A. (2016) The WNT/MYB pathway suppresses KIT expression to control the timing of salivary proacinar differentiation and duct formation. Development, 143, 2311–2324.
181) Fumoto, K., Takigawa-Imamura, H., Sumiyama, K., Kaneiwa, T., & Kikuchi, A. (2017) Modulation of apical constriction by Wnt signaling is required for lung epithelial shape transition. Development, 144, 151–162.
182) Fumoto, K., Takigawa-Imamura, H., Sumiyama, K., Yoshimura, S.H., Maehara, N., & Kikuchi, A. (2019) Mark1 regulates distal airspace expansion through type I pneumocyte flattening in lung development. J. Cell Sci., 132, 132.
183) Matsumoto, S., Fujii, S., Sato, A., Ibuka, S., Kagawa, Y., Ishii, M., & Kikuchi, A. (2014) A combination of Wnt and growth factor signaling induces Arl4c expression to form epithelial tubular structures. EMBO J., 33, 702–718.
184) Matsumoto, S., Fujii, S., & Kikuchi, A. (2017) Arl4c is a key regulator of tubulogenesis and tumourigenesis as a target gene of Wnt-β-catenin and growth factor-Ras signalling. J. Biochem., 161, 27–35.
185) Fujii, S., Matsumoto, S., Nojima, S., Morii, E., & Kikuchi, A. (2015) Arl4c expression in colorectal and lung cancers promotes tumorigenesis and may represent a novel therapeutic target. Oncogene, 34, 4834–4844.
186) Harada, T., Matsumoto, S., Hirota, S., Kimura, H., Fujii, S., Kasahara, Y., Gon, H., Yoshida, T., Itoh, T., Haraguchi, N., et al. (2019) Chemically modified antisense oligonucleotide against ARL4C inhibits primary and metastatic liver tumor growth. Mol. Cancer Ther., 18, 602–612.
187) Kimura, K., Matsumoto, S., Harada, T., Morii, E., Nagatomo, I., Shintani, Y., & Kikuchi, A. (2020) ARL4C is associated with initiation and progression of lung adenocarcinoma and represents a therapeutic target. Cancer Sci., 111, 951–961.
188) Yahara, A., Shrestha, A.R., Yamamoto, T., Hari, Y., Osawa, T., Yamaguchi, M., Nishida, M., Kodama, T., & Obika, S. (2012) Amido-bridged nucleic acids (AmNAs): synthesis, duplex stability, nuclease resistance, and in vitro antisense potency. ChemBioChem, 13, 2513–2516.
189) Ghosh, M.G., Thompson, D.A., & Weigel, R.J. (2000) PDZK1 and GREB1 are estrogen-regulated genes expressed in hormone-responsive breast cancer. Cancer Res., 60, 6367–6375.
190) Matsumoto, S., Yamamichi, T., Shinzawa, K., Kasahara, Y., Nojima, S., Kodama, T., Obika, S., Takehara, T., Morii, E., Okuyama, H., et al. (2019) GREB1 induced by Wnt signaling promotes development of hepatoblastoma by suppressing TGFβ signaling. Nat. Commun., 10, 3882.
191) Koch, A., Denkhaus, D., Albrecht, S., Leuschner, I., von Schweinitz, D., & Pietsch, T. (1999) Childhood hepatoblastomas frequently carry a mutated degradation targeting box of the β-catenin gene. Cancer Res., 59, 269–273.
192) Kimura, H., Fumoto, K., Shojima, K., Nojima, S., Osugi, Y., Tomihara, H., Eguchi, H., Shintani, Y., Endo, H., Inoue, M., et al. (2016) CKAP4 is a Dickkopf1 receptor and is involved in tumor progression. J. Clin. Invest., 126, 2689–2705.
193) Niehrs, C. (2006) Function and biological roles of the Dickkopf family of Wnt modulators. Oncogene, 25, 7469–7481.
194) Kikuchi, A., Fumoto, K., & Kimura, H. (2017) The Dickkopf1-cytoskeleton-associated protein 4 axis creates a novel signalling pathway and may represent a molecular target for cancer therapy. Br. J. Pharmacol., 174, 4651–4665.
195) Shinno, N., Kimura, H., Sada, R., Takiguchi, S., Mori, M., Fumoto, K., Doki, Y., & Kikuchi, A. (2018) Activation of the Dickkopf1-CKAP4 pathway is associated with poor prognosis of esophageal cancer and anti-CKAP4 antibody may be a new therapeutic drug. Oncogene, 37, 3471–3484.
196) Kajiwara, C., Fumoto, K., Kimura, H., Nojima, S., Asano, K., Odagiri, K., Yamasaki, M., Hikita, H., Takehara, T., Doki, Y., et al. (2018) p63-dependent Dickkopf3 expression promotes esophageal cancer cell proliferation via CKAP4. Cancer Res., 78, 6107–6120.
197) Kimura, H., Yamamoto, H., Harada, T., Fumoto, K., Osugi, Y., Sada, R., Maehara, N., Hikita, H., Mori, S., Eguchi, H., et al. (2019) CKAP4, a DKK1 receptor, is a biomarker in exosomes derived from pancreatic cancer and a molecular target for therapy. Clin. Cancer Res., 25, 1936–1947.
著者紹介Author Profile
 菊池 章(きくち あきら)
菊池 章(きくち あきら)大阪大学大学院医学系研究科(分子病態生化学)教授.医学博士.
略歴1982年神戸大学医学部卒業,88年同大学院医学研究科博士課程(内科系専攻)修了,同内科学第三講座,同生化学第一講座,UCSF心臓血管研究所を経て,95年より広島大学医学部教授(生化学第一講座),2009年より現職.
研究テーマと抱負物質の振る舞いを理解するという“生化学”的アプローチを研究の基盤に置いて,低分子量Gタンパク質とWntシグナルの研究を行ってきた.今しばらくは,これまでの自分の研究を振り返りながら,その成果を生命の本質や疾患の理解に結びつけていきたい.
ウェブサイトhttp://www.med.osaka-u.ac.jp/pub/molbiobc/
趣味映画鑑賞,スポーツ(サッカー観戦と水泳による体力維持増強).