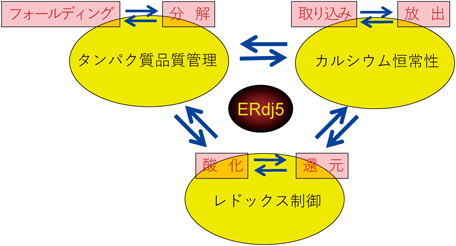
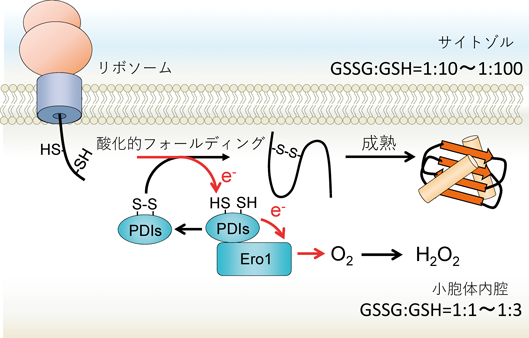
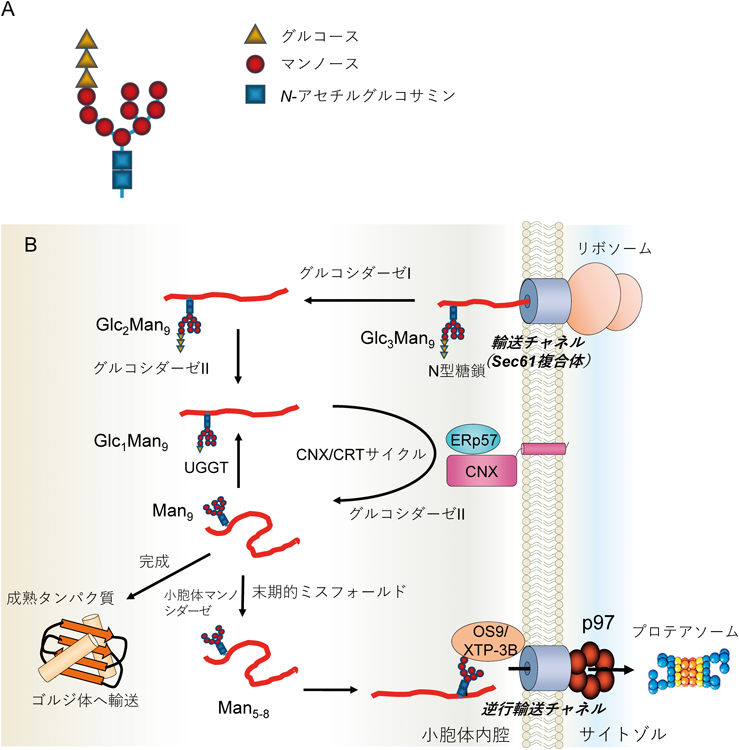
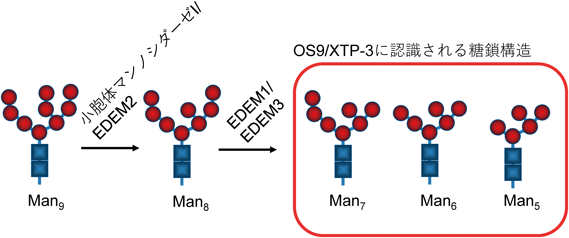
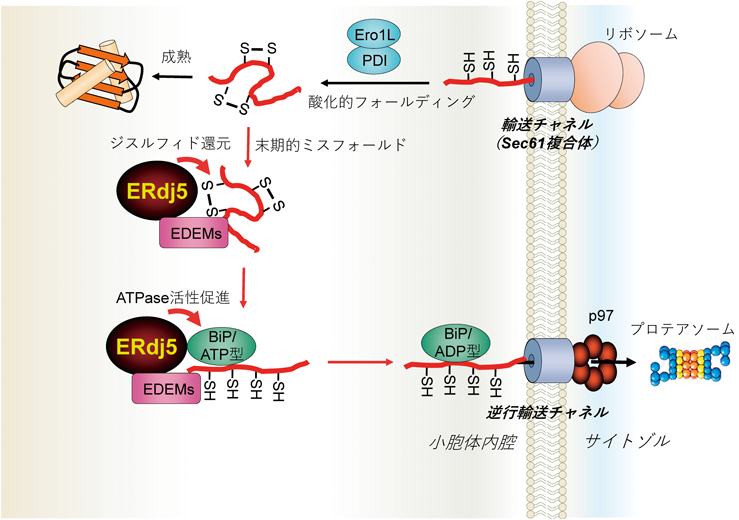
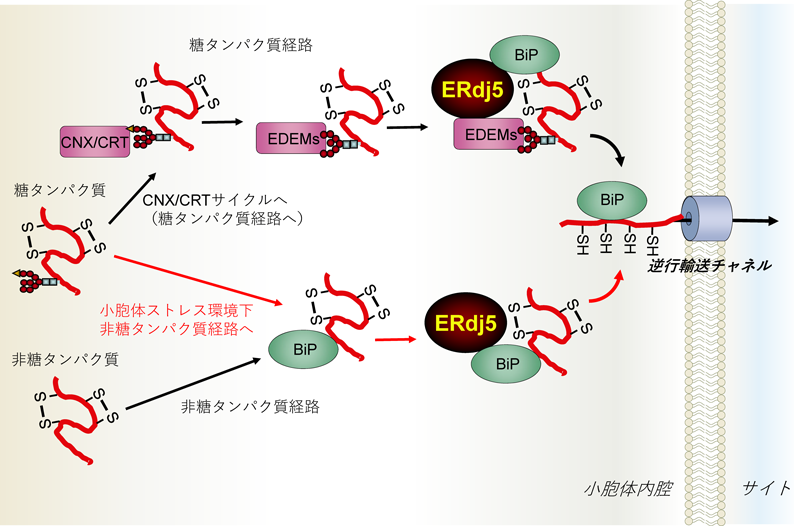
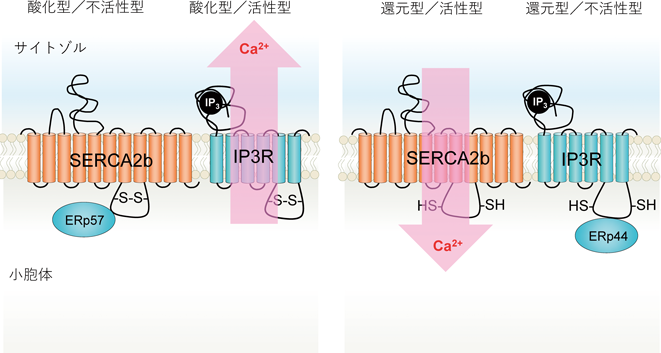
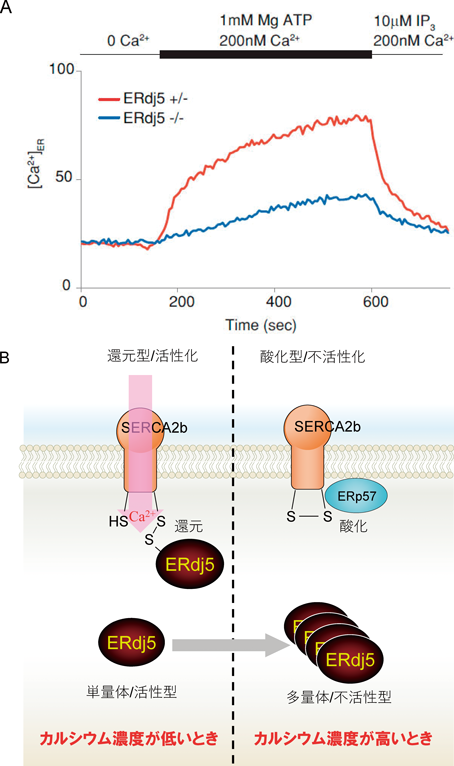
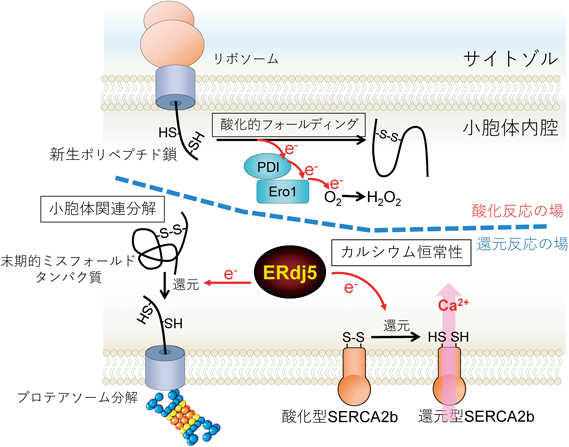
レドックス制御による小胞体恒常性維持機構の解明~還元反応の場としての小胞体~Maintenance of ER homeostasis by Redox regulation
京都産業大学生命科学部/京都産業大学タンパク質動態研究所Faculty of Life Sciences, Kyoto Sangyo University/Institute for Protein Dynamics, Kyoto Sangyo University ◇ 京都市北区上賀茂本山 ◇ Kamigamomotoyama, Kita-ku, Kyoto, Japan