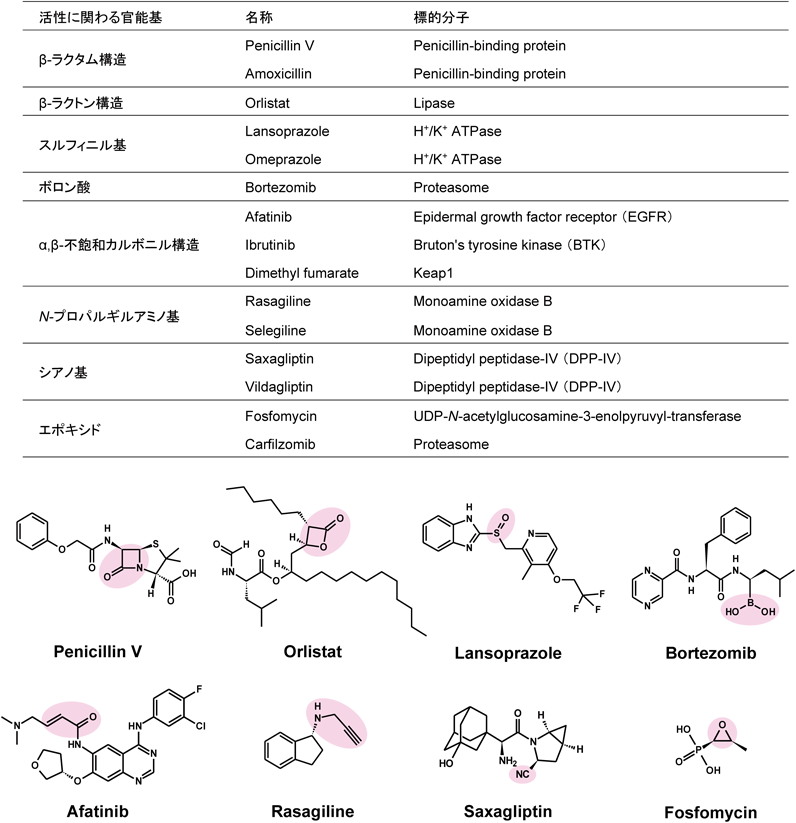
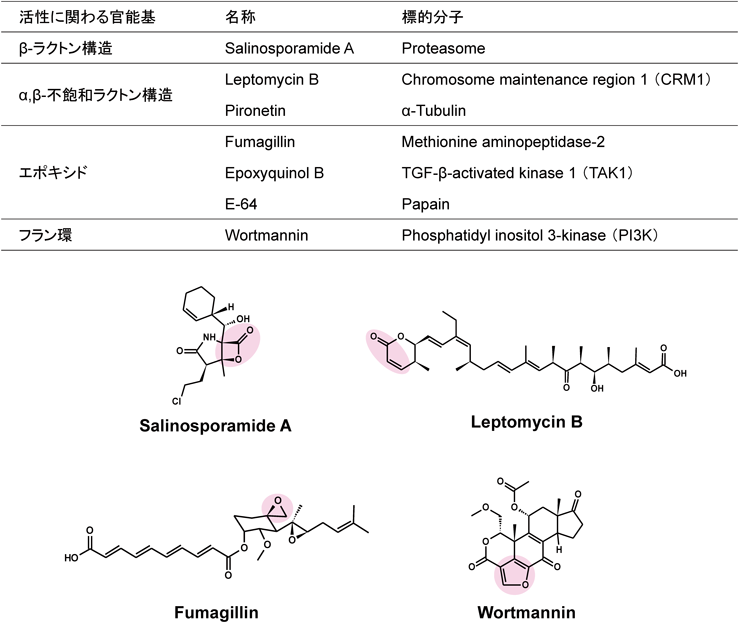
微生物が産生する二次代謝産物は,医薬品やバイオプローブの探索源として有望であり,これまできわめて多くの化合物が発見されてきた.その中には,標的分子に共有結合することで活性を示すものも報告されている(図2)4).
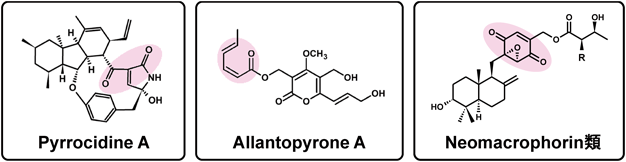
このような微生物二次代謝産物由来の共有結合性化合物が持つポテンシャルに着目し,著者らは天然資源,主に微生物二次代謝産物から生物活性物質の探索を行ってきた.その過程で,共有結合性に関わる特徴的な化学構造と顕著な生物活性を示す化合物として,Pyrrocidine A, Allantopyrone A,ならびにNeomacrophorin類を見いだした(図3).
1)Pyrrocidine A
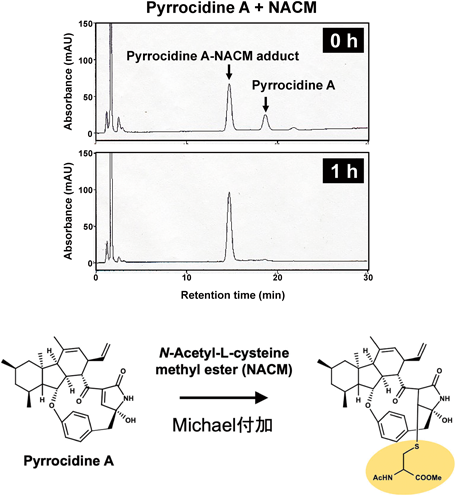
Pyrrocidine Aは,植物内生糸状菌Neonectria ramulariae Wollenw KS-246など数種の糸状菌から単離された既知化合物である5).薬剤耐性株を含むグラム陽性細菌に対して強力な抗菌作用を示し,その活性はα,β-不飽和カルボニル構造を持たない誘導体と比較して,著しく強いことが報告されている.我々は,Pyrrocidine Aがヒト急性前骨髄性白血病細胞HL60などのがん細胞株に対して,強力な細胞毒性(IC50=0.12 μM)を示すことを見いだした.Pyrrocidine Aは,HL60に対してcaspaseの活性化を伴うアポトーシスを誘導することで細胞を死滅させたことから,この活性にα,β-不飽和カルボニル構造が関与していると予想された.すなわち,α,β-不飽和カルボニル構造は,カルボニル基の酸素原子により電子が求引されることで,特にβ位の炭素原子が電子不足となり,高い反応性(親電子性または求電子性という)を示す.一方,タンパク質を構成するアミノ酸の中には,システインのチオール基に代表される電子供与性の高い(求核性という)官能基が存在する.そこで,求核性チオール基を持つN-アセチル-L-システインのメチルエステル誘導体(NACM)やグルタチオンをモデル求核剤として,Pyrrocidine Aとの反応性を解析した.その結果,NACMとグルタチオンは,いずれもPyrrocidine Aが誘導するcaspase経路の活性化とアポトーシスを打ち消すことがわかった.さらに,LC-MS解析により,Pyrrocidine AとNACMを混合すると速やかに新たな生成物が生じ,これが,Pyrrocidine Aのα,β-不飽和カルボニル構造にNACMのチオール基がMichael付加により共有結合した付加体であることがLC-MS分析により判明した(図4)6).以上よりPyrrocidine Aは,親電子性により標的分子の求核性官能基に共有結合することで,強力な生物活性を示すものと考えられた.その標的分子の候補因子のキナーゼをすでに1種同定しており,現在詳細な解析を進めている(上杉ら,未発表).多くのがんで,がん細胞の生存や増殖に関わるキナーゼシグナリングの活性化が知られている.したがって,がん特異的に亢進しているキナーゼシグナリングを阻害することで,細胞死や増殖阻害により,がんの抑制につながると考えられている.
2)Allantopyrone A
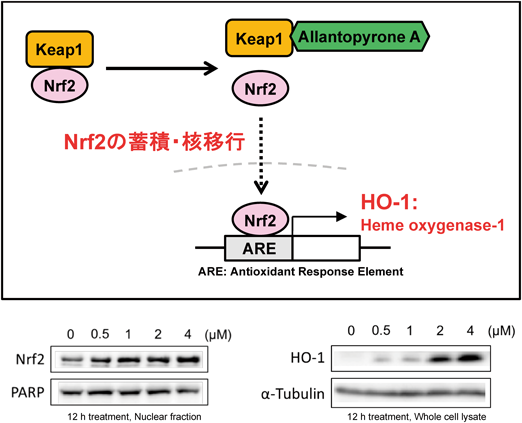
Allantopyrone Aは,山形大学の塩野らにより単離された植物内生糸状菌Allantophomopsis lycopodina KS-97が産生する新規化合物である7).これまでに,HL60に対する細胞毒性(IC50=0.36 μM)や,がんや炎症などに関わるNF-κB経路に対する阻害作用8)が明らかになってきた.本物質もα,β-不飽和カルボニル構造を持つことから,共有結合を介した生物活性を示すと考えられた.実際,Allantopyrone AもNACMと反応して付加体を形成することが判明した.そこで,Allantopyrone Aが引き起こす細胞応答を俯瞰することを目的とし,理化学研究所の長田らと共同で,2D-DIGE(蛍光標識二次元ディファレンスゲル電気泳動)を活用したプロテオーム解析9)を実施した.すると,Allantopyrone Aで処理した細胞では,転写因子Nrf2によって発現が調節されるタンパク質が共通して増加することが認められた.Nrf2は,多くの抗酸化酵素,第II相解毒酵素の転写調節を担っている10).Keap1-Nrf2経路は生体内における重要な抗酸化システムとして知られ,これを活性化することにより酸化ストレスが要因となる疾患の予防,改善につながることが期待されている.そこで,Allantopyrone AのKeap1-Nrf2経路に対する作用を検証した結果,Nrf2の核移行の促進,抗酸化酵素heme oxygenase-1(HO-1)の発現促進を誘導することが確認された(図5).
さらに,細胞をAllantopyrone Aで前処理することにより,過酸化水素による細胞死が抑制されたことから,本物質が抗酸化システムであるKeap1-Nrf2経路を活性化していることが強く示唆された.Keap1は25個のチオール基を持ち,それが酸化される,あるいは親電子物質により修飾されるとダイナミックな構造変化を起こす.すると,Keap1と結合していたNrf2が解離して核に移行し,抗酸化酵素,第II相解毒酵素の発現を誘導するため,Keap1は親電子物質のセンサーとして振る舞うことが知られている10).したがって,Allantopyrone AがKeap1のチオール基に結合している可能性が予想された.そこで,光親和型固定化法11)によりAllantopyrone A固定化担体を作製し,細胞溶解液から結合タンパク質をアフィニティー精製したところ,抗Keap1抗体を用いたwestern blottingによりKeap1が検出された.加えて,Allantopyrone Aを作用させた細胞から抽出したタンパク質を解析したところ,Allantopyrone Aが結合したと予想されるKeap1が検出された.以上より,Allantopyrone Aは細胞内でKeap1と結合することが明らかとなり,その結果1 μM以下でKeap1-Nrf2経路を活性化し,細胞を酸化ストレスから保護するものと考えられた(図5)12).酸化ストレスは,がんや炎症性疾患を中心にきわめて多くの病態に関与していることが次々と明らかになってきており,Keap1-Nrf2経路を活性化する化合物のさらなる活用が期待される.
3)Neomacrophorin類
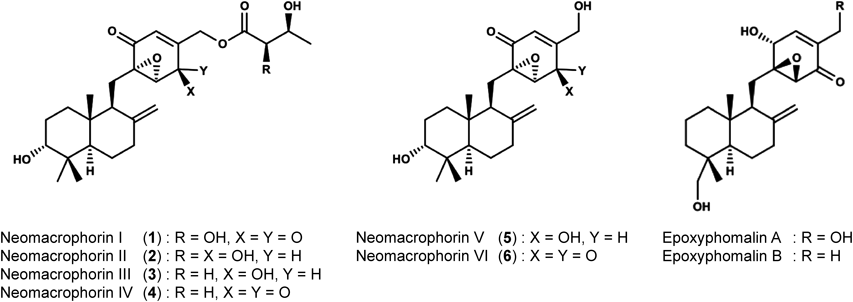
Neomacrophorin I~VIは,弘前大学の橋本らにより単離されたチャカイガラタケに寄生する糸状菌Trichoderma sp. 1212-03が産生する新規化合物群である13, 14).HL60に対する細胞毒性を調べた結果,キノン構造を持つI, IV, VIが,それぞれ対応するセミキノール構造を持つII, III, Vと比較して顕著に強い活性(0.3~2.6 μM)であることを見いだした.キノン構造も高い親電子性を示すことが知られるため,標的分子に共有結合することを予想した.一方で,Neomacrophorin類と類似骨格を持つEpoxyphomalin類が,タンパク質分解酵素であるプロテアソームの酵素活性を阻害することが報告されていた(図6)15).しかし,Neomacrophorin類やEpoxyphomalin類に共通する骨格を持つ化合物による,プロテアソーム阻害作用に関わる構造活性相関や細胞レベルでの作用については明らかにされていなかったため,6種のNeomacrophorin類を用いることでそれらの解明につながるのではないかと考えた.
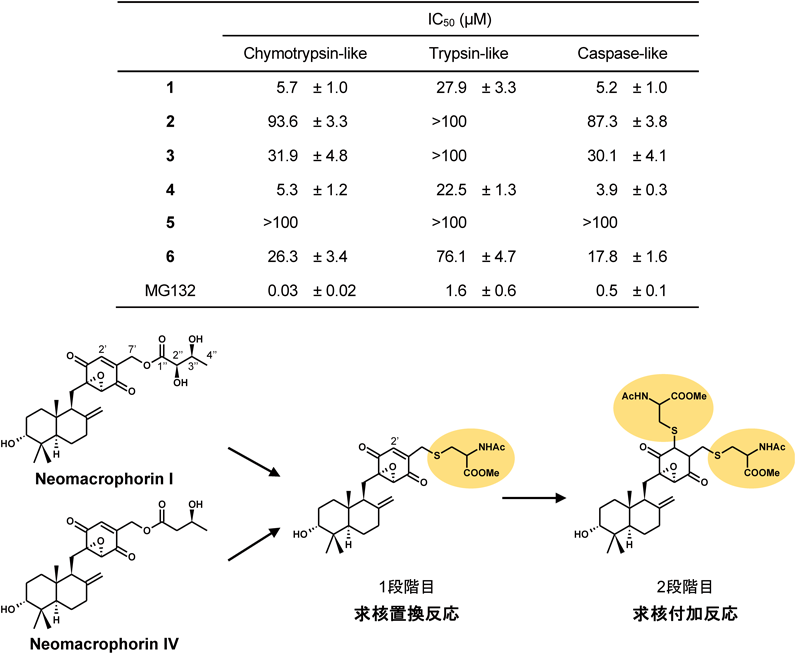
そこで,ヒト赤血球由来の精製20Sプロテアソームの酵素活性に対する作用を調べたところ,上記の細胞毒性と同様に,キノン型の3化合物がchymotrypsin様活性,trypsin様活性,caspase様活性のすべてを濃度依存的に阻害したが(3.9~76.1 μM),chymotrypsin様活性とcaspase活性をより強く阻害した.このことから,20Sプロテアソームの中で,それらの酵素活性をそれぞれ担うβ5サブユニットとβ1サブユニットに対する親和性が高いことが示唆された.一方で,セミキノール型は活性がない,または著しく弱いことが判明した(図7).細胞内でプロテアソームが阻害されると,ユビキチン・プロテアソーム系で分解されるべきユビキチン化タンパク質が蓄積する.キノン型のNeomacrophorin類3化合物で処理した細胞のみで,ユビキチン化タンパク質が1 μM程度から蓄積することも確認された.そして,これらにより誘導される細胞毒性やユビキチン化タンパク質の蓄積は,求核剤との併用により完全に打ち消された.これらの結果から,Neomacrophorin類はキノン構造の反応性を介して細胞内でプロテアソームの活性を阻害すると考えられた14).
そこで,次にLC-MSを用いてキノン型Neomacrophorin類と求核剤NACMの反応を解析したところ,ユニークな反応性を有していることを見いだした.キノン型の3化合物は,予想どおりNACMと速やかに反応して完全に消失し別な化合物に変換されるが,その反応は,キノン部位2′位へのNACMの求核付加が起こったものと当初予想した.すなわち,Neomacrophorin IとIVは,キノン構造とは離れた側鎖2″位の水酸基の有無が異なることから,水酸基の分の分子量が異なる付加体が生じると考えていた.しかし,得られた結果をみると,驚くべきことに両者はまったく同じMSスペクトルの2種の付加体を生じていた.このことは,1″–4″側鎖に何らかの変化が起こっていることを示している.MSスペクトルとUV吸収スペクトルなどの解析により,Neomacrophorin IまたはIVをNACMと混合すると,まず,7′位でNACMと求核置換反応が起こり共通のチオエーテル誘導体となり,次いで,2′位で予想した求核付加反応が起こったものと結論づけた(図7)14).1″–4″側鎖を持たないNeomacrophorin VIでは,2′位における求核付加体と考えられる単一の付加体のみを生じたことも,この結論を支持している.キノン型Neomacrophorin類は,いずれも強いプロテアソーム阻害活性を示した.それらの中で,1″–4″側鎖を持つIとIVが,持たないVIと比較して3~4倍程度強い酵素阻害活性を有していた.このことから,求核置換反応と求核付加反応の両方の反応性を持つことで,プロテアソームに対する親和性が向上し,より強く活性を阻害する可能性が考えられる.
橋本らは,同じ糸状菌株より非常にユニークな[4.4.3]プロペラン構造を持つ新規化合物Neomacrophorin Xを単離同定した16).この化合物の生合成も,今回明らかにしたNeomacrophorin類の特徴的な反応性に基づいていると考えられた.すなわち,同菌株が産生するアントラキノン化合物とNeomacrophorin生合成中間体が,上記の連続する求核置換反応と求核付加反応により結合することで,[4.4.3]プロペラン構造を生み出していると推測している14).
共有結合薬は,細胞内タンパク質に非特異的かつ強固に結合することで重篤な副作用を生じること,細胞内にmMオーダーで存在するグルタチオンに抱合されて活性が失われることなどが危惧され,臨床応用が難しいと考えられてきた.しかし,近年においても共有結合薬は承認されており,非小細胞肺がんに対する分子標的薬として日本でも承認されたアファチニブ(Afatinib)がその一例である.アファチニブは,α,β-不飽和カルボニル構造を活性部位としてEGFRやHer2などに共有結合し,それらの活性を不可逆的に阻害する.その一方で,共有結合性を有することにより,ヒトに投与した際の血漿タンパク結合率は95%と高いものの,臓器等へは十分に到達し薬効を発揮するとされている.また,副作用は休薬や減量あるいは積極的な支持療法によって十分に管理可能な程度とされている17).このような特徴から,従来はdrug-likeではないと考えられていた共有結合薬は,有効性と安全性を備えた医薬品として臨床応用が可能であることが実証され,見直されてきている.
また,共有結合性化合物は,さまざまなタンパク質に結合してしまい作用の特異性が低いと考えられているが,我々の実験結果からも,分子骨格の違いによりある程度選択的かつ多様な細胞応答を誘導できることが示された.従来の化合物がターゲットにできなかった標的分子に対する“魔法の弾丸”として,共有結合性化合物が今後さらに活躍することが期待される.