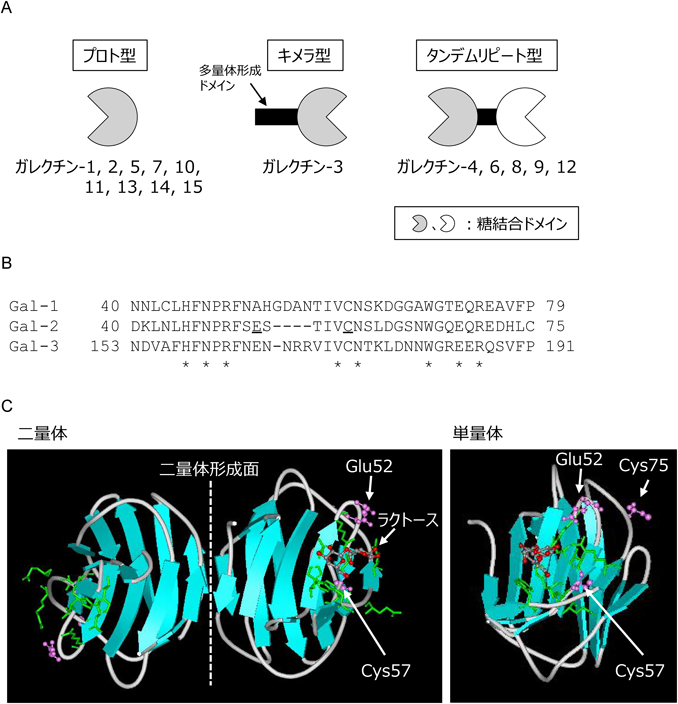
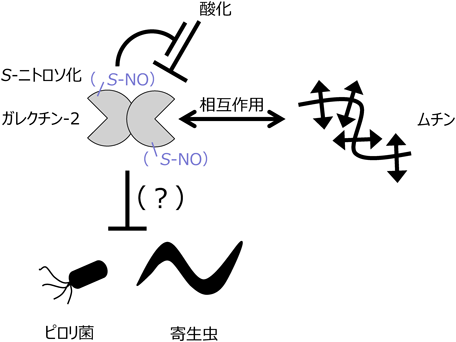
ガレクチン-2:その活性制御と生体防御における働きGalectin-2:its functional regulation and roles in host defense
1 城西大学薬学部Faculty of Pharmacy and Pharmaceutical Sciences, Josai University ◇ 〒350–0295 埼玉県坂戸市けやき台1–1 ◇ 1–1 Keyakidai, Sakado, Saitama 350–0295, Japan
2 帝京大学薬学部Teikyo University, Faculty of Pharma-Science ◇ 〒173–8605 東京都板橋区加賀2–11–1 ◇ 2–11–1 Kaga, Itabashi-ku, Tokyo 173–8605, Japan
3 東海大学医学部Tokai University, School of Medicine ◇ 〒259–1193 神奈川県伊勢原市下糟屋143 ◇ 143 Shimokasuya, Isehara, Kanagawa 259–1193, Japan