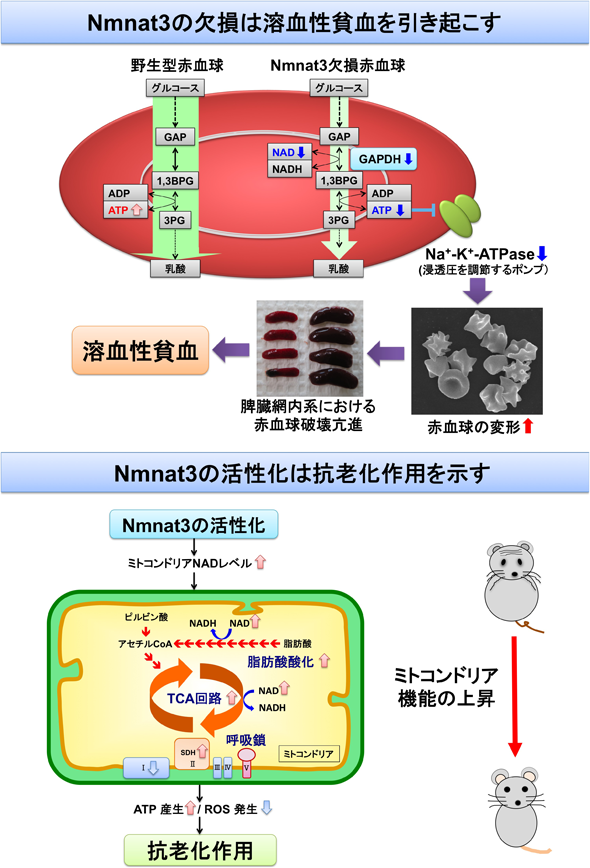
Nmnat3を介したNADの合成経路と老化制御における役割Metabolism of mitochondrial NAD and its role in aging process
富山大学学術研究部医学系分子医科薬理学講座Department of Molecular and Medical Pharmacology, Faculty of Medicine, University of Toyama ◇ 〒930–0194 富山市杉谷2630 ◇ 2630 Sugitani, Toyama, Toyama 930–0194, Japan