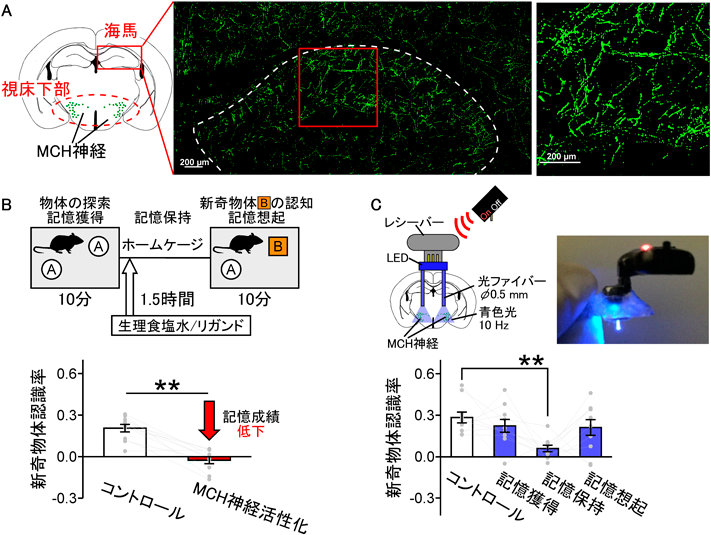
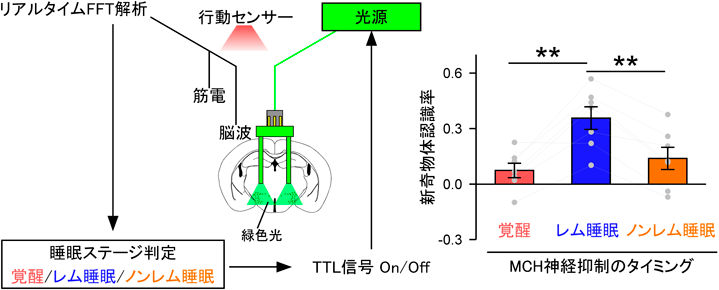
レム睡眠中に活動するメラニン凝集ホルモン産生神経が海馬依存記憶の忘却を誘導するREM sleep-active MCH neurons are involved in forgetting hippocampus-dependent memories
名古屋大学環境医学研究所神経系分野IIDepartment of Neuroscience II, Research Institute of Environmental Medicine, Nagoya University ◇ 〒464–8601 愛知県名古屋市千種区不老町 ◇ Chikusa, Nagoya, Aichi 464–8601, Japan