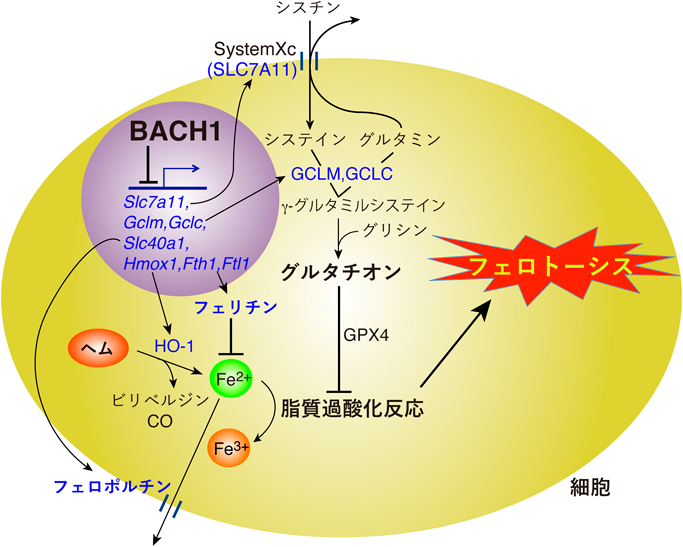
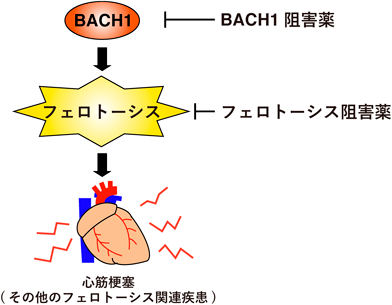
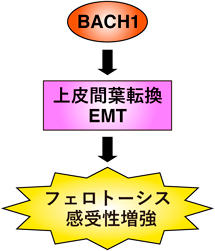
転写因子BACH1がつかさどるフェロトーシス制御の遺伝子ネットワークThe gene network of ferroptosis-regulation is controlled by the transcription factor BACH1
東北大学大学院医学系研究科生物化学分野The Department of Biochemistry, Tohoku University Graduate School of Medicine ◇ 宮城県仙台市青葉区星稜町2–1 ◇ 2–1 Seiryo-machi, Sendai 980–8575, Japan