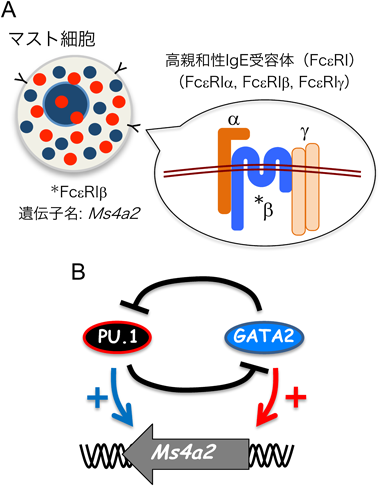
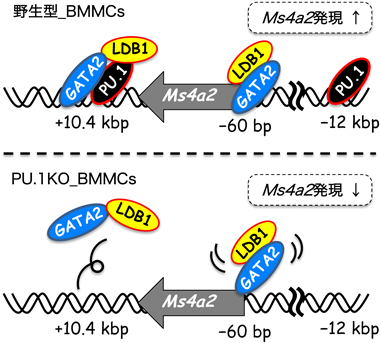
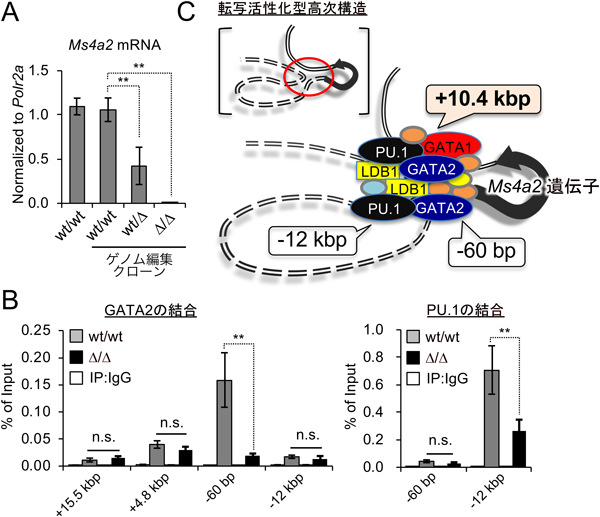
転写因子GATA2とPU.1による高親和性IgE受容体の発現と転写制御Expression and transcriptional regulation of high-affinity IgE receptor by transcription factors GATA2 and PU.1
1 高崎健康福祉大学薬学部Takasaki University of Health and Welfare ◇ 〒370–0033 群馬県高崎市中大類町60 ◇ 60, Nakaorui-machi Takasaki, 370–0033
2 東北大学東北メディカル・メガバンク機構ゲノム予防医学分野Tohoku University Tohoku Medical Megabank Organization ◇ 〒980–8573 宮城県仙台市青葉区星陵町2–1 ◇ 2–1 Seiryo-machi, Aoba-ku, Sendai, 980–8573