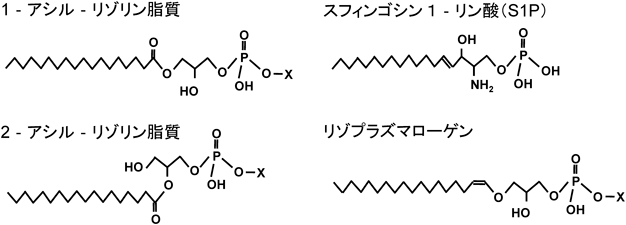
LPAはS1Pとともに,最もよく研究されている脂質メディエーターである.LPA(1-または2-アシル-sn-グリセロ-3-リン酸)は1本の脂肪酸とリン酸がグリセロール骨格に結合し,結合様式の違いにより複数の構造を持つ.リゾリン脂質メディエーターの研究には質量分析装置(LC-MS)を用いた測定が用いられることが多く,血漿中のLPAは約100 nMの濃度で存在する1).LPA産生酵素の一つであるオートタキシン(autotaxin:ATX)は血液や体液中に存在し,そのリゾホスホリパーゼD活性によりさまざまなリゾリン脂質をLPAに変化させる.ATXはLPAが関与するヒト疾患病態との相関性が高く,LPAの代替バイオマーカーとして診断に使用されている2).一方,もう一つのLPA産生酵素である膜結合型ホスファチジン酸特異的ホスホリパーゼA1α(mPA-PLA1α)は細胞外膜に存在し,ホスファチジン酸のsn-1位の脂肪酸を加水分解し,高度不飽和脂肪酸がsn-2に結合したLPAを産生する3).
LPAの受容体として6種類のGタンパク質共役型受容体(LPA1~LPA6)が同定され,LPAの多彩な生理作用が明らかになっている.LPA1は,1996年に同定された初めてのLPA受容体であり4),脳の特定の神経細胞に発現し,神経系の組織発達に寄与している5, 6).また,全身の間葉系幹細胞由来の細胞に広く局在し,特に軟骨細胞の分化および増殖に重要である7, 8).さらにLPA1はがんや炎症,神経性疼痛といったさまざまな疾患との関連性や,ATX-LPA-LPA1軸が肺線維症を亢進することが報告されている9).LPA2は腸管上皮細胞に高く発現し,腸管上皮細胞の細胞死に対して抑制的に働くことが報告されている10, 11).またがん細胞に発現しているLPA2は細胞増殖,薬剤抵抗性,血管新生を正に制御し悪性度と相関がある12).LPA3はグリセロール骨格のsn-2位の位置に不飽和脂肪酸を持つLPA分子種に非常に高い親和性を示す.LPA3は受精卵が接触する子宮内膜上皮細胞に局在し,受精卵の着床の時期に作用するLPA3シグナルは,受精卵を受け入れるための子宮内膜肥厚と血管新生の誘導に重要である13, 14).LPA4はグリセロール骨格のsn-1位の位置に脂肪酸を持つLPA分子種に高い親和性を持つ.LPA4は血管内皮細胞に発現し,正常な血管形成に重要であることが示唆されている15).また,白色脂肪組織に発現しているLPA4は白色脂肪細胞のリモデリングに寄与する16).LPA5は後根神経節に発現しており,LPA5遺伝子欠損マウスでは損傷による神経因性疼痛が保護されている17).LPA6は2-アシルLPAを認識して毛髪の成長に寄与する.2-アシルLPAを産生するmPA-PLA1αをコードする遺伝子(LIPH)は常染色体劣勢遺伝子の貧毛症の原因遺伝子であり18),さらにLPA6(P2Y5)をコードする遺伝子(P2RY5)の変異も同様の先天性乏毛症を引き起こす19, 20).これらの報告はともにヒト毛根の内毛根鞘においてmPA-PLA1α由来の2-アシルLPAがLPA6を介して毛根に作用することを示している.実際にmPA-PLA1αの遺伝子欠損マウスでは多くの乏毛症患者が合併する縮毛症に似た表現型を示し,毛包の2-アシルLPAが低下している21).
LysoPSは,グリセロール骨格に1本の脂肪酸,極性頭部にリン酸基とセリンを有するリゾリン脂質である.生体内にはLysoPSをde novoで合成する経路は存在せず,LysoPSの前駆体は脂肪酸を2本有するホスファチジルセリン(PS)であると考えらえている.血漿中のLysoPS濃度は約10 nMと定常時にはきわめて低値であり,炎症刺激や免疫応答の活性化に伴って受容体や産生酵素の発現量が増加されることに伴い血中LysoPSの濃度も増加する25).また,LysoPSは組織中にも検出され,急性冠症候群の病変部位で検出されるLysoPSとLysoPS産生酵素PS-PLA1の濃度に正の相関性がある26).
LysoPSの生理活性はラットの腹腔マスト細胞の脱顆粒反応を促進する作用として見いだされた27).マスト細胞はIgE依存的な脱顆粒応答を引き起こし,ヒスタミンの放出などを介してアレルギー疾患を引き起こす細胞である.IgEを感作させたマスト細胞に,抗原とLysoPSを添加すると,抗原単独と比較して顕著な脱顆粒反応の促進がみられる.通常PSは脂質二重膜の内層に分布し,その非対称性はフリッパーゼにより維持されているが,アポトーシスや血小板の活性化によりPSは脂質二重膜の外側に露出される.LysoPS産生酵素のPS-PLA1は細胞外に分泌され,好中球に作用することでマスト細胞の脱顆粒に関与することが示されている28).しかし,PS-PLA1はLysoPSを分解する活性も有しているため,PS-PLA1がLysoPS産生酵素として機能するかについては問題が残っている.最近,別のLysoPS産生酵素としてα/βヒドロラーゼファミリーの一種であるABHD16Aが同定された29).ABHD16Aは脳および活性化マクロファージにおいて発現し,これに対応するようにABHD16A遺伝子欠損マウスの脳および活性化マクロファージの上清中のLysoPS量が減少していた.ABHD16AはLysoPS以外にもモノアシルグリセロール,プロスタグランジン結合型グリセロールを基質とし,脂肪酸やプロスタグランジンを産生することが示されており,LysoPS産生酵素としての生理的な役割を発揮しているかについては議論が残る.
LysoPS受容体はLPS1/GPR34, LPS2/P2Y10, LPS3/GPR174の3種類がLysoPSを認識するとして同定されている.LPS1/GPR34は全身臓器で発現しているものの特にマスト細胞での発現が高い30).しかしながらLPS1/GPR34-KOマウスの解析からこの受容体はマスト細胞の活性化には影響がない.また,LPS3/GPR174は抑制性の制御性T細胞の機能に寄与している31).ヒトのゲノムワイド関連解析からLPS3/GPR174の変異が自己免疫疾患の一つのバセドウ病の発症と正の相関が示されており32, 33),LysoPS-LPS3/GPR174経路が免疫制御因子としての役割を担っているかもしれない.
P-LPEは,グリセロール骨格に1本のビニルエーテル結合を伴う脂肪酸,極性頭部にリン酸基とエタノールアミンを有するリゾリン脂質である.筆者らは分泌性ホスホリパーゼA2(sPLA2)の研究を通してP-LPEが表皮角化細胞の活性化を制御し,表皮バリア機能の維持に寄与することを発見した42).この節では,P-LPEの発見に至った経緯について紹介する.
1)ホスホリパーゼA2(PLA2)
リゾリン脂質産生酵素のPLA2は,リン脂質のsn-2位のエステル結合を加水分解しリゾリン脂質と脂肪酸を産生する酵素群である.PLA2は特徴的な基質選択性を示し,生体内局所環境に応じて多様な脂質代謝産物を動員する.PLA2の基質となるリン脂質は,ホスファチジルコリン(phosphatidylcholine:PC)やホスファチジルエタノールアミン(phosphatidylethanolamine:PE)などの極性基の違いだけではなく,グリセロール骨格のsn-1位の炭化水素鎖がエステル結合したものの他にO-アルキル結合(エーテル型)あるいはO-アルケニル結合(ビニルエーテル型)したサブクラスも存在する.これに加えてsn-1位とsn-2位に結合している脂肪酸の違いにより膨大な数の分子種を構成する.PLA2の多くは基質としてこれらのリン脂質を選択的に認識する.PLA2分子群は構造上および局在の違いから,sPLA2の他に細胞質PLA2,Ca2+非依存性PLA2,血小板活性化因子アセチルヒドラーゼおよびその他のファミリーに分類される.さらに,広義のPLA2ファミリーの中には,リン脂質のsn-2位のエステル結合を加水分解する活性だけでなく,sn-1位を切るPLA1活性や中性脂質を分解するリパーゼ活性,さらにはPLA2の逆反応であるトランスアシラーゼまたはアシルトランスフェラーゼ活性を有する酵素もある.そのため,生体内におけるPLA2の機能を把握するためには,各サブタイプの酵素学的・構造学的特徴を理解した上で,その発現細胞や標的基質の存在状態を考慮する必要がある.
2)sPLA2の基質選択性
一般的に,酵素の基質選択性を知るためには反応初速度をみる必要があり,このためには適切な酵素濃度,基質の濃度と組成,反応時間を設定する必要がある.従来のsPLA2酵素活性測定系では,生体内に存在しない単一の標識リン脂質や鎖長の短い脂肪酸を持つリン脂質が基質として用いられており,さまざまな脂肪酸や極性基の組み合わせからなるリン脂質がsPLA2の真の基質となりうることを考慮すると,問題がある.さらにsPLA2はサブタイプごとに発現部位が異なること,その発現局所におけるリン脂質の組成や形態(生体膜,ベシクル等)によって酵素反応が異なることが想定される.そこで,筆者らは,sPLA2サブタイプの基質選択性をin vitroの系で評価するにあたり,当該sPLA2が本来局在している組織あるいは細胞から抽出した全リン脂質を再構成したリポソーム,あるいは培養細胞上清を基質として用いることにした.これらの基質に異なる濃度のsPLA2を添加し,基質であるリン脂質分子種の減少ならびに代謝産物である脂肪酸とリゾリン脂質の増加についてリピドミクスにより定量を行った43).その結果,高濃度の酵素ではすべてのリン脂質が一様に加水分解されてしまうが,酵素濃度を下げると明らかな基質選択性がみられる.試験管内での評価系はあくまでも人為的条件なので,後に述べるマウスを使った解析結果と照合して総合評価する必要があるが,sPLA2を理解する上でin vitroの系は重要な情報を提供してくれる.
3)sPLA2反応により得られる代謝産物
sPLA2過剰発現マウスを使ったリピドミクス解析は,in vivoにおけるsPLA2の基質特異性をスクリーニングする上で有益である.各sPLA2過剰発現マウスの表現型はすべて同一ではない42, 44–49).このことは個々のsPLA2が酵素固有の基質特異性に伴う表現型を持つことを示している.一般にsPLA2過剰発現マウスの組織を用いて得られた脂質プロファイルの変化は容易に捉えられることができ,過剰発現マウスで増加する脂肪酸やリゾリン脂質はsPLA2の酵素代謝産物の可能性があるが,過剰発現マウスでは本来内因性の酵素が発現していない細胞や組織においても強制的に発現させていることから,リピドミクスで得られた結果は注意を払って解釈する必要がある.一方,sPLA2欠損マウスの対象組織のリピドミクスを行った結果,野生型マウスと比較して遺伝子欠損による表現型が認められれば,当該sPLA2の基質と生成産物が決まる.このストラテジーは単純明快であるが,いくつかの問題を慎重に考慮する必要性がある.i)対照マウスと欠損マウスにおける脂質プロファイルが,直接的な影響によるものなのか,あるいは間接的なものであるか区別する必要性がある.すなわち,観察される脂質の変化が,当該sPLA2の本質的な基質と生成物を反映しているものか,あるいは単に他のPLA2やリパーゼの補填的影響を反映しているか考慮する.ii)パルミチン酸やステアリン酸は組織全体における絶対量が高い.また,一般的に不安定な酸化脂肪酸代謝物は即座に別の代謝産物に分解されるとともにリゾリン脂質はリン脂質に再利用される.このようにバックグラウンドが高く代謝回転の速い脂質は,局所における時空間的な脂質代謝の本質的解明に影響を与える.iii)仮に脂質プロファイルの表現型が得られたとしても,当該組織において対象となるsPLA2の発現が認められず,酵素反応の本質を反映しない場合がある.そのような場合,遠隔地にある臓器の影響が考えられ,対象となるsPLA2が内在的に発現する遠隔臓器を使った分析が必要となる.iv)ターゲットとなるリン脂質がsPLA2分泌細胞そのものである可能性があり,基質となるリン脂質およびsPLA2の発現量および分泌細胞自体の状態を注意深く検討する必要性がある.v)sPLA2分泌細胞あるいは近隣の細胞から分泌されたマイクロベシクルの生体膜を基質とする可能性があり,sPLA2の反応を評価するために適切なsPLA2分泌細胞とリン脂質供与細胞を使った共培養システムが必要である.
筆者らのグループではsPLA2分子群の網羅的遺伝子改変マウスを作出し,リピドミクス技術を組み合わせて網羅的に解析することで,sPLA2は局所的かつ時期特異的な発現をすること,その微少環境中の固有のリン脂質を動員し,さまざまな生命応答に関わることを明らかにしてきた42–54).
4)難治性皮膚疾患を調節する新しいリゾリン脂質の発見
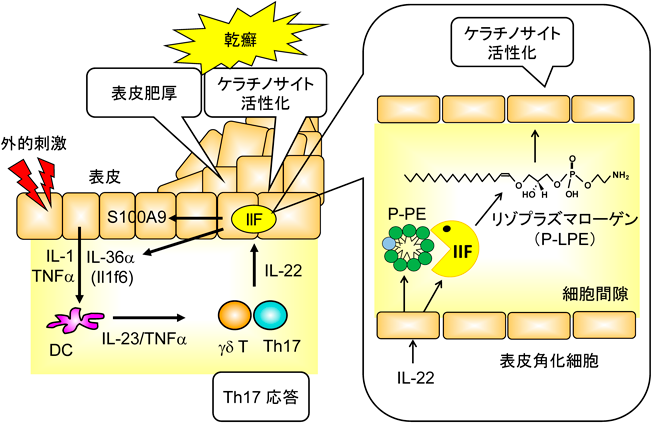
皮膚の恒常性を考える上で脂質は非常に重要な生体成分である.外界に接する皮膚表面の表皮角化細胞は,セラミドの層を作り,体内からの水分の蒸散または病原体などの侵入から体を守る皮膚バリア機能を持つ.表皮角化細胞は分化と増殖を繰り返し皮膚バリアを形成するが,このサイクルが壊れると難治性疾患に代表される乾癬や接触性皮膚炎などの表皮肥厚性疾患につながる.sPLA2-X45)やsPLA2-IIA55)の過剰発現マウスは,炎症とは無関係に表皮の肥厚,皮脂腺膨張,脱毛などの皮膚異常を示す.しかし,これらのアイソザイムは表皮に内在性の発現がほとんど認められず,sPLA2-X過剰発現マウスで観察された表皮の肥厚を伴う表現型の意義に関しては不明であった.そこでマウス皮膚のマイクロアレイ解析を行うと,表皮肥厚に関連する遺伝子群の増加に加え,当時機能未知のsPLA2であったsPLA2-IIFの発現が野生型マウスの皮膚において他の脂質代謝関連遺伝子と比較して高いことに気がついた.sPLA2-IIFは表皮の顆粒層から角質層に局在する主要なsPLA2である.sPLA2-IIF過剰発現マウスは脱毛や肥厚を伴う強い皮膚異常を示し,Th17サイトカインの発現誘導に伴う乾癬様の症状を示す.乾癬はTh17応答を介する表皮肥厚性疾患であり,マウスの皮膚にイミキモドを連続塗布することによりヒト乾癬と類似した皮膚炎が誘導されることが知られている56).表皮の肥厚とともに表皮角質層におけるsPLA2-IIFの発現増加が認められ,さらに,ヒト乾癬の表皮肥厚部位でもsPLA2-IIFが増加しており,このことからsPLA2-IIFが表皮肥厚性疾患に関与することが示唆された.
一方,sPLA2-IIF欠損マウスの皮膚は一見正常であるが,腹部皮膚の角質剥離および体外への水分漏出量の増加を伴う皮膚バリア機能が低下している.sPLA2-IIF欠損マウスにイミキモド反復塗布乾癬モデルを施行すると,野生型と比較して表皮の肥厚および乾癬の発症や悪化に関与する細胞活性化マーカーS100a9やIL-36α(Il1f6)mRNA量の増加が抑制され,病態が有意に改善する.かぶれや金属アレルギーに代表される接触性皮膚炎は,表皮肥厚を伴うTh1応答性の皮膚免疫疾患である57).sPLA2-IIF欠損マウスに接触性皮膚炎モデルを施行すると野生型と比較して耳介の肥厚とケラチノサイトの活性化および炎症が抑制される.さらに二段階皮膚がんモデルをsPLA2-IIF欠損マウスに施行すると,野生型と比較して発症する腫瘍の数には差はないが,大きな腫瘍が低減し,炎症性細胞浸潤,血管新生,炎症および表皮肥厚の低下傾向が認められる.以上の結果は,sPLA2-IIFは表皮肥厚性疾患の進行に促進的に作用することを示している.
次に初代培養ケラチノサイトを用いてex vivoの実験を行うと,野生型マウス由来のケラチノサイトでは分化および活性化に依存してsPLA2-IIFの発現が著しく誘導されるが,sPLA2-IIF欠損マウス由来の細胞では分化活性化マーカーの発現が低下する.すなわち,sPLA2-IIFがケラチノサイトの分化や活性化に関与することを示唆している.さらにケラチノサイトにTh17サイトカインの一つであるIL-22を添加するとsPLA2-IIFの発現が強く誘導されるが,sPLA2-IIF欠損ケラチノサイトでは細胞の活性化がほぼ完全に消失する.このことは,IL-22によるケラチノサイトの活性化にsPLA2-IIFが関与することを示している.
sPLA2-IIFの機能には,この酵素が産生する脂質代謝物が関与することが想定される.そこで,sPLA2-IIFが動員する責任脂質パスウェイを同定するため,sPLA2-IIF過剰発現マウスの皮膚についてリピドミクスを行った.sPLA2-IIF過剰発現マウスの皮膚ではDHAを持つPEおよびプラズマローゲン型ホスファチジルエタノールアミン(P-PE)が特徴的に低下している.これらのリン脂質の低下と合致して,DHAおよびDHA代謝産物のプロテクチンD1(PD1)の増加,LPEおよびP-LPEの増加がみられる.sPLA2-IIF欠損マウスに施行した各種皮膚疾患モデル(乾癬,接触性皮膚炎,皮膚がん)の皮膚では,P-LPEが唯一対照とほぼ同じレベルにまで低下し,sPLA2-IIF欠損マウスの表現型と合致する唯一の脂質代謝産物であることを突き止めた.さらに,初代培養ケラチノサイトを用いたリピドミクスでは,ケラチノサイトの分化に応じてP-PEが培養上清中に分泌される.実際,培養上清および皮膚から抽出したリン脂質にリコンビナントsPLA2-IIFを作用するとP-LPEが選択的に産生される.以上の結果は,sPLA2-IIFはケラチノサイトから分泌されるDHA含有P-PEを優先的に加水分解し,DHAとP-LPEを産生することを示している.PD1はケラチノサイト培養上清から検出されないことから,おそらくPD1は他の免疫細胞から産生されケラチノサイトに作用することが想定される.さらに,P-LPEの生理機能を明らかにするために,sPLA2-IIF欠損マウスにP-LPEを添加して乾癬を惹起すると遺伝子欠損による抑制の表現型が回復し,表皮の肥厚およびケラチノサイトの活性化が亢進する.またsPLA2-IIF欠損ケラチノサイトにP-LPEを添加するとケラチノサイトの活性化が亢進され,遺伝子欠損による表現型の回復が認められる.
以上の結果から,ケラチノサイトから分泌されるP-PEはsPLA2-IIFの作用によってP-LPEに変換され,このP-LPEがケラチノサイトの活性化を引き起こして表皮肥厚性疾患を制御するものと結論した(図2).sPLA2-IIFはケラチノサイトから分泌されるリン脂質に作用し,DHAを持つアルケニル型リン脂質(P-PE)をリゾリン脂質(アルケニル型リゾリン脂質,P-LPE)に代謝する.P-LPEは表皮肥厚性疾患の新規バイオマーカーのみならず,新規生理活性脂質としても位置づけられる.
P-LPEの前駆体であるP-PEはプラズマローゲンとも呼ばれ,グリセロール骨格のsn-1がエステル結合でなくエーテル結合により脂肪酸と結合しているリン脂質である.プラズマローゲンは生体内に約2割存在し,脳神経系,心筋,リンパ球,マクロファージでの含量が多く,プラズマローゲンの生合成不全症は致死性の神経疾患を呈することが知られている58).また,マクロファージ細胞膜上のプラズマローゲンレベルが細胞膜の再構成とリモデリング活性化の引き金となり,貪食作用を促している59).筆者らの研究はプラズマローゲンの代謝産物が生理活性を持つことを示した初めての報告であり,P-LPEおよびsPLA2-IIFが皮膚疾患治療薬としての標的となることが期待される.しかしながら,P-LPEが作用機序の解明の手がかりとなる特異的受容体の同定には至っておらず,この受容体の同定が待たれる.