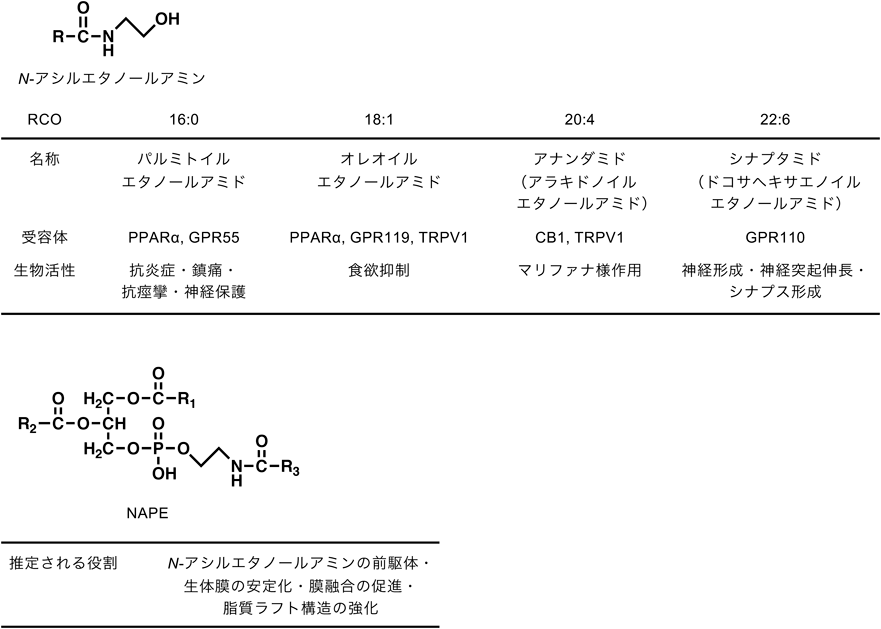
N-アシルエタノールアミンは種々の長鎖脂肪酸とエタノールアミンがアミド結合を介して縮合した構造を有し,脂質メディエーターに分類される一群の内因性分子である(図1).これらは動植物の体内に普遍的に存在し,代表的分子であるパルミトイルエタノールアミドが卵黄や大豆,ピーナッツなどの食品に含まれ,抗炎症作用を持つことが1950年代にはすでに知られていた1, 2).一方,大麻(マリファナ)に含まれるΔ9-テトラヒドロカンナビノールと類縁化合物をカンナビノイドと称し,その精神作用はGタンパク質共役型のカンナビノイド受容体を介することが1990年までに明らかになっていた.そして1992年に,本受容体の内因性アゴニストとして,アラキドン酸を含むN-アシルエタノールアミンであるアナンダミド(アラキドノイルエタノールアミド)が同定された3).これを契機として,N-アシルエタノールアミン類の生物活性があらためて注目されることとなった.
これらN-アシルエタノールアミンは哺乳類の体内において生合成されて生物活性を発揮し,役割を終えると酵素的に加水分解を受ける.筆者らはこの代謝機構に興味を持ち,経路と責任酵素の研究を進めてきた.特に生合成については,3本の脂肪酸鎖を構造に含む特殊なリン脂質であるN-アシル-ホスファチジルエタノールアミン(N-acyl-phosphatidylethanolamine:NAPE)(図1)が前駆体としてまず酵素的に生成し,次に多数の酵素が関与する複数の経路によりN-アシルエタノールアミンの生成に至ることが近年明らかとなり,これらの酵素は創薬の標的としても注目されている4–6).そこで本稿では,これらN-アシルエタノールアミンの生物活性を概説した後,生合成機構について筆者らの知見を中心に紹介させていただきたい.
種々のN-アシルエタノールアミンのうち,体内で量的に圧倒的に多く存在するのは飽和脂肪酸ないしは一価不飽和脂肪酸を構造に含む分子種である.前者の代表であるパルミトイルエタノールアミドはパルミチン酸を含み,前述のとおり抗炎症作用を有する他,鎮痛,抗痙攣,神経保護作用を有する7, 8).これらの生物活性の少なくとも一部はペルオキシソーム増殖剤活性化受容体α(peroxisome proliferator-activated receptor α:PPARα)を介する9).欧米では慢性疼痛に有効なニュートラシューティカル(機能性食品)あるいはサプリメントとして販売されており,医薬品としての開発も進んでいる.また,Gタンパク質共役型受容体GPR55のアゴニストであることも報告されている10).
オレオイルエタノールアミドは一価不飽和脂肪酸であるオレイン酸を含むN-アシルエタノールアミンであり,PPARαを介して食欲抑制および体重減少作用を発揮する11, 12).本分子は小腸で生合成され,求心性神経を介して満腹感を引き起こす内因性物質であると考えられている13, 14).GPR119受容体15)およびバニロイド受容体TRPV116)にもアゴニストとして作用するが,これらの受容体は食欲抑制作用には必須ではない17, 18).一方,パーキンソン病のモデルマウスにおいて,オレオイルエタノールアミドはTRPV1を介してレボドパ(L-DOPA)によるジスキネジア(不随意運動)を抑制することから,レボドパ製剤の長期投与による有害反応として生じるジスキネジアを軽減することに応用できる可能性がある19).
多価不飽和脂肪酸を含むN-アシルエタノールアミンとして,最もよく知られているのはアナンダミドである.前述のとおり,本物質はカンナビノイド受容体の内因性アゴニストとして同定されたが3),後に,2-アラキドノイルグリセロール(2-arachidonoylglycerol:2-AG)も同様の作用を示すことがわかった20, 21).両者はまとめてエンドカンナビノイドと呼ばれ,「カンナビノイドの四徴」である自発運動低下,体温低下,鎮痛,カタレプシー誘発をはじめ,精管の電気刺激誘発攣縮の抑制,血圧低下,徐脈,眼圧低下といったさまざまな生物活性を有する.カンナビノイド受容体には,主として中枢神経系に発現するCB1と免疫細胞などに発現するCB2の少なくとも2種類が存在する22).2-AGは両受容体の完全アゴニストであるが,アナンダミドはCB1受容体の部分アゴニストであり,CB2には弱い作用しか示さない.さらに,アナンダミドの体内レベルは一般に2-AGと比較して数百分の1以下である.これらのことから,生理的には2-AGの方がエンドカンナビノイドとして重要であると考えられている23).しかし,アナンダミドの主要な分解酵素である脂肪酸アミド加水分解酵素(fatty acid amide hydrolase:FAAH)の阻害薬の投与や同酵素のノックアウトマウスでアナンダミドの体内濃度が上昇するとカンナビノイド様作用が観察されることから,局所で何らかの生理的役割を果たしている可能性がある.アナンダミドは,カンナビノイド受容体の他,TRPV1にアゴニストとして作用するエンドバニロイドであることも報告されている24).
最近,多価不飽和脂肪酸であるドコサヘキサエン酸を含むドコサヘキサエノイルエタノールアミドの解析が進んでいる25).シナプタミドと名づけられた本分子は神経形成や神経突起伸長,シナプス形成を促進することが示された.作用はGPR110受容体(別名adhesion G protein-coupled receptor F1:ADGRF1)を介することが報告され26, 27),シナプタミドと本受容体が神経発達および神経保護を制御する上でのターゲットとなる可能性がある.
3. N-アシルエタノールアミンの生合成経路の概略
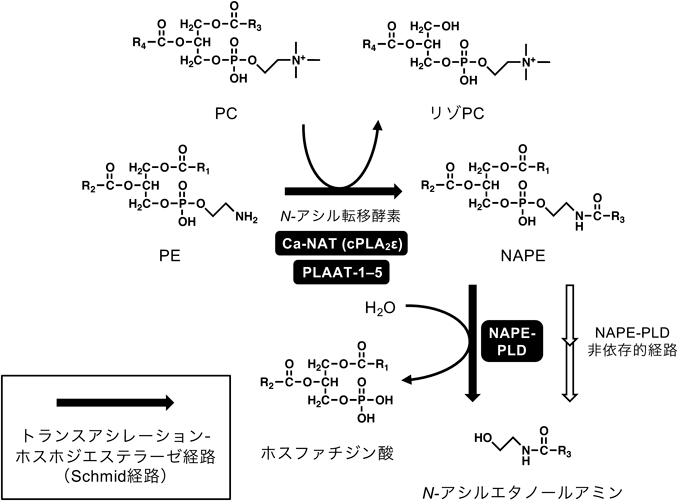
動物細胞において,種々のN-アシルエタノールアミンは共通の経路で生合成されると考えられている.その主要経路は,膜リン脂質であるホスファチジルエタノールアミン(phosphatidylethanolamine:PE)のN-アシル化によるNAPEの生成と,引き続いて起こるNAPEのホスホリパーゼD(phospholipase D:PLD)型加水分解の2段階で構成され,「トランスアシレーション-ホスホジエステラーゼ経路」と呼ばれる(図2).この経路は古く1980年代からSchmidらにより提唱・解析されており28),Schmid経路とも呼ばれている.本経路の前半の反応を触媒するN-アシル転移酵素は活性発現にCa2+を要求することが当初から知られ,Ca2+依存性N-アシル転移酵素(Ca-NAT)と呼ばれていたが,そのcDNAの同定は2016年までなされず,30年以上を要した29).筆者らは,これとは別にCa2+非存在下で本反応を触媒する酵素群としてホスホリパーゼA/アシルトランスフェラーゼ(phospholipase A and acyltransferase:PLAAT)-1~5を見いだし,解析を進めてきた4).
第一段階で生成したNAPEは3本のアシル鎖を有する希有な構造の脂質分子である30).NAPEを含むことで膜構造が受ける影響として,O-アシル鎖に加えてN-アシル鎖も生体膜に埋め込まれることで膜安定化を来すことが示唆されている.加えて,Ca2+依存的膜融合の促進および脂質ラフト構造の強化といった作用が示唆されているものの,その生理的意義はよくわかっていない.NAPEは脳虚血や心筋梗塞の部位で顕著に増加するが,増加したNAPEが実際に膜安定化作用による細胞保護効果を有するかについても不明である.一方,NAPEの生理的意義として,Schmid経路の後半の反応の基質となってN-アシルエタノールアミンを生成する代謝中間体として機能することは確立している.本反応はNAPE加水分解PLD(NAPE-PLD)によって触媒されるが,筆者らは本酵素のcDNAクローニングを2004年に行い,酵素タンパク質としての実体を明らかにした31).併せて,NAPE-PLD欠損マウスの解析により,NAPEのO-アシル鎖が1本脱離したリゾ体(N-アシル-リゾPE,リゾNAPE)を介してN-アシルエタノールアミンを生成するNAPE-PLD非依存的多段階経路も体内で働いていることが明らかとなった32).以下,動物組織でN-アシルエタノールアミンの生成に関わる酵素について一つずつ紹介したい.
Ca-NATの活性は,脳をはじめ,心臓,骨格筋や精巣で検出され,その後,ラット脳の膜画分からの部分精製標品を用いた性状解析が行われた33).活性発現にmMオーダーのCa2+を必要とし,還元剤であるジチオスレイトールによって活性が上昇する一方で,SerやHisをアルキル化する試薬によって阻害された.アシル基供与体基質として,アシルCoAではなくグリセロリン脂質を用い,そのsn-1位のアシル基を転移することが明らかにされた33).グリセロリン脂質のsn-1位には飽和脂肪酸や一価不飽和脂肪酸が多く結合していることから,Ca-NATによって合成されるNAPEのN-アシル基の分子種は主として飽和脂肪酸や一価不飽和脂肪酸となるはずである.実際,組織中に存在するNAPEとN-アシルエタノールアミンはN-アシル基として飽和脂肪酸や一価不飽和脂肪酸が結合している分子種が量的に多い一方で,アナンダミド等の高度不飽和脂肪酸を含むN-アシルエタノールアミンや対応する前駆体NAPE分子種が微量であることとよく一致する.脳においてCa-NATの活性は出生直後が最も高く,その後,生後30日までの間に4分の1程度にまで継続的に減少した34).また,ラット脳の初代培養細胞をCa2+イオノフォアで処理するとNAPEの生成が促進することから,細胞内でもCa2+要求性が認められた35).しかしながら,同酵素は膜結合性の微量タンパク質であることから精製が困難であり,遺伝子は長らく同定されていなかった.
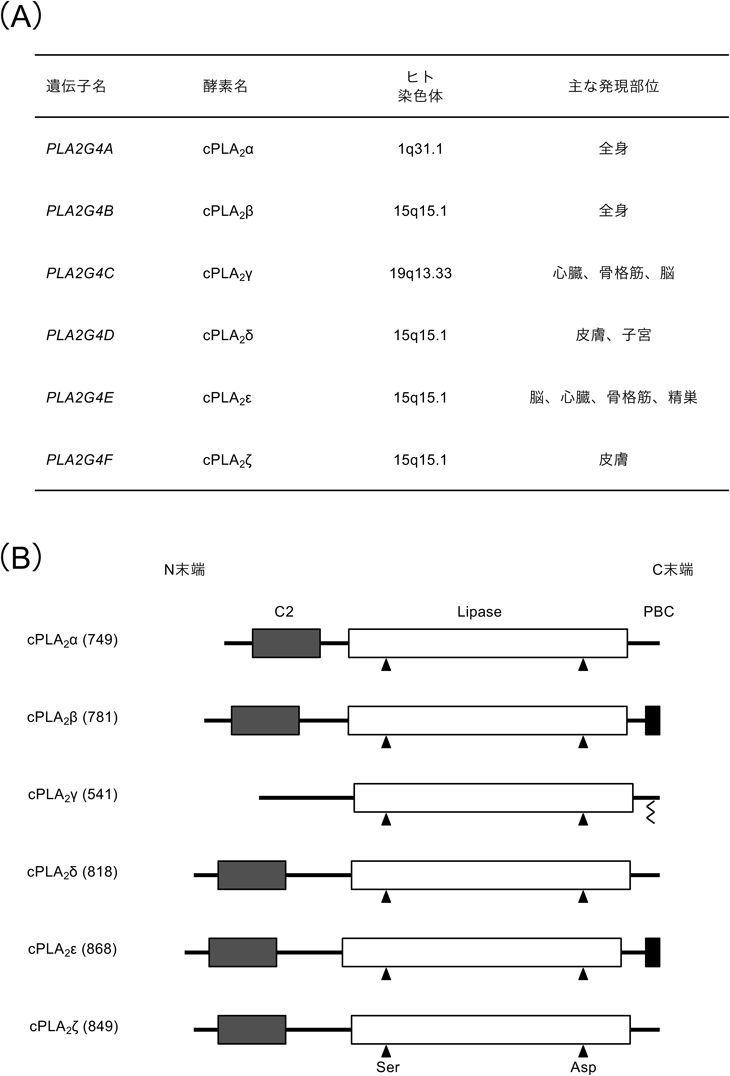
米国のCravattらは,マウス脳におけるCa-NATの活性とそれに対する阻害剤を応用したプロテオミクス解析を行い,以前にOhtoらによって細胞質型ホスホリパーゼA2(cytosolic phospholipase A2:cPLA2)のアイソフォームとして単離されていたcPLA2ε(PLA2G4E)36)がCa-NATの本体であることを報告した29).マウスcPLA2εの性状解析より,同分子は膜結合性で,活性発現にはmMオーダーのCa2+が必要であり,アシル基供与体としてグリセロリン脂質を用い,そのsn-1位から脂肪酸鎖を引き抜く等,これまでに報告されていた脳の部分精製標品が示す特徴をすべて満たしていた.cPLA2εは六つのアイソフォーム(α, β, γ, δ, ε, ζ)からなるcPLA2ファミリーの一つで(図3A),これらはN末端側からCa2+との結合に関わるC2ドメイン(γは除く)と,活性中心を構成するSerとAspを含むリパーゼドメインからなる(図3B)37).またcPLA2εにはβと同様に,C末端側に塩基性アミノ酸が連なった多塩基性クラスターが認められるが38),γが有するプレニル化部位は存在しない.他のアイソフォームにはN-アシル転移活性は報告されていない.
筆者らはヒトcPLA2εの精製組換えタンパク質を用いて性状解析を行い,マウスcPLA2εと同様にCa-NAT活性を保有していることを明らかにした39, 40).cPLA2εに含まれるC2ドメインは,Ca2+との結合に加えてリン脂質と相互作用することが知られているので,種々のリン脂質を添加してcPLA2εの酵素活性への効果を検討した.その結果,ホスファチジルセリン(phosphatidylserine:PS)やホスファチジルイノシトール4,5-ビスリン酸等の酸性リン脂質によって,Ca2+依存的酵素活性がさらに増加した.次に,cPLA2εを安定発現する細胞を樹立し,2種類のPS合成酵素(PSS1とPSS2)をsiRNAによって抑制したところ,cPLA2εの発現量や酵素活性が有意に減少した40).共焦点顕微鏡による観察から,cPLA2εは形質膜と細胞内小胞に局在しており,その分布はPSに対するプローブであるLactC2とよく一致した.PS合成酵素を抑制した細胞ではLactC2のシグナルが減少し,それに伴ってcPLA2εの細胞内シグナル,特に細胞内小胞でのシグナルが減少した.cPLA2εの変異体解析より,活性中心であるSerをAlaに置換した点変異体,C2ドメイン,または多塩基性クラスターを欠損させた変異体はいずれも酵素活性が消失し,その局在も細胞質へと変化していた.以上の結果から,cPLA2εはCa2+に加えて酸性リン脂質によって活性化され,特にPSはcPLA2εの安定化や細胞内局在にも必要であることが示唆された.
組換えcPLA2ε発現細胞の脂質分子を液体クロマトグラフィー・タンデムマススペクトロメトリー(LC-MS/MS)によって分析したところ,NAPEおよびN-アシルエタノールアミンがコントロール細胞と比較して数倍増加していた41).また,sn-1位にアシル基でなくアルケニル基が結合したプラスマローゲン型NAPEであるN-アシル-プラスメニルエタノールアミン(N-アシル-PlsEt)の増加もみられた.in vitroでのcPLA2εのsn-1位アシル基選択性とよく一致して,これらのN-アシル基は飽和脂肪酸または一価不飽和脂肪酸が大部分を占めた.cPLA2ε発現細胞をCa2+イオノフォアであるイオノマイシンで処理すると,NAPEとN-アシルエタノールアミンの含量は著しく増加し,コントロール細胞のそれぞれ70倍と66倍以上にまで達した.これに伴い,不飽和脂肪酸を持つリゾPCやリゾPEも著増した.以上の結果から,cPLA2εは細胞内においてCa2+依存的にPCやPEのsn-1位に結合している脂肪酸をPEのアミノ基に転移してNAPEを生成し,それがN-アシルエタノールアミンの生成に利用されること,およびその結果,2-アシル-リゾリン脂質が生じることが強く示唆された.
脳虚血や心筋梗塞などの病態時にNAPEやN-アシルエタノールアミンが大量に蓄積することが古くから報告されてきた30).NAPEが示す膜安定化作用やN-アシルエタノールアミンの神経保護作用によってこれらの分子が傷害部位を保護する可能性が指摘されている27, 42).cPLA2εは両臓器で内因性に発現しており,今後,同酵素の遺伝子欠損マウスなどの解析によってこれらの脂質分子の病態時における役割が明らかになることが期待される.
5. PLAATファミリー・メンバーによるNAPEの生成
PLAATファミリーは5種類のタンパク質分子(PLAAT-1~5)から構成され,互いに一次構造上の配列類似性を示す(図4)43).これらはもともとがん原遺伝子であるRasの機能を阻害するがん抑制遺伝子群として単離されたが,タンパク質としての性状は不明であった.しかしながら,その一次構造はビタミンAの体内動態を制御するレシチン・レチノール・アシル転移酵素(lecithin retinol acyltransferase:LRAT)に類似しており,LRATの活性中心を構成するHisとCys残基も保存されていたことから酵素であることが想定された44).LRATはPCのsn-1位のアシル基をall-trans-レチノールに転移することでレチニルエステルを生成する.筆者らはLRATの触媒するアシル基転移反応がN-アシル転移酵素の反応に類似していることに着想を得て,PLAATファミリーの脂質代謝酵素活性について検討を行った.精製組換えタンパク質を用いた実験から,同ファミリーの5種類すべてが程度の差はあれN-アシル転移酵素活性を示してNAPEを生成することが明らかとなった45, 46).また,グリセロリン脂質から脂肪酸を遊離させるホスホリパーゼA1/A2活性と,リゾリン脂質にグリセロリン脂質からアシル基を転移するO-アシル転移酵素活性も検出されたが,これら3種の相対活性は5種類の分子間で異なっていた.さらなる検討から,PLAAT分子群はリン脂質のsn-1位に加えてsn-2位のアシル基もある程度転移し,活性発現にはジチオスレイトールなどの還元剤やNonidet P-40等の界面活性剤を必要とする一方で,Ca2+等の二価陽イオンは必要としないことが明らかになった47, 48).PLAATファミリー分子はProを多く含むproline-richドメイン,活性中心のHisを含むHボックスとCysを含むNCドメイン,そして疎水性ドメインから構成されている(図4B).また,PLAAT-1にはN末端側にArgに富んだ多塩基性ドメインが存在する.PLAAT-3の種々の変異体を用いた実験から,HisとCysの両残基,proline-richドメイン,および疎水性ドメインのすべてが酵素活性に重要であることがわかった47).HisとCysが活性中心を形成することは,PLAAT-3の結晶構造解析からも確認されている49, 50).以上の結果から,PLAATファミリーはNAPE合成活性を含む多機能酵素としてリン脂質代謝に関わることが明らかとなった.
NAPEの合成能を細胞レベルで解析するため,相対的に高いN-アシル転移酵素活性を示すPLAAT-1と-2のいずれかを安定発現するHEK293細胞を樹立し,細胞内のNAPEの分子種をLC-MS/MSによって分析した51, 52).その結果,N-アシル基として飽和脂肪酸または一価不飽和脂肪酸を含むNAPEが著しく増加していた.N-アシルエタノールアミンも増加しており,同様のアシル基組成を示した.このことから,上述のようにPLAATファミリーはリン脂質のsn-1位とsn-2位の両方からアシル基を転移できるが,細胞内では主としてsn-1位のアシル基を転移していることが示唆された.興味深いことに,NAPEのsn-2位のアシル基はほとんどがオレイン酸(18 : 1)であり,この特徴は組換えPLAAT分子を発現させていない対照細胞のNAPEでも同様であった.また,NAPEの生成酵素が何であるかはさておき,オレイン酸の優位はマウスの脳でも観察される一方で32),心臓や空腸などではsn-2位にリノール酸(18 : 2)が結合した分子種も多く存在しており53),組織特異的な違いもみられた.上述のcPLA2εとは異なり,同ファミリー分子は活性発現にCa2+を必要としないことから,定常状態におけるNAPEの生合成に寄与しているのかもしれない.
PLAATファミリーに属する分子種の数は動物間で違い,ヒトやチンパンジー等の霊長類では5種類存在するが,マウスやラットではPLAAT-1,-3および-5の3種類のみが存在する.これらは組織特異的な発現パターンを示し,PLAAT-1は脳,心臓,筋肉や精巣で,PLAAT-3は脂肪組織で,PLAAT-5は精巣で特に高発現している43).一方,PLAAT-2や-4は普遍的な発現がみられる43).細胞内局在に関して,PLAAT分子群は主に細胞質全体に存在しているが,PLAAT-1は核にも存在する46).興味深いことに,マウス組織では多塩基性ドメインが欠損したPLAAT-1アイソフォームのmRNAも発現しており,この組換え体をCOS-7細胞で発現させると同分子は核にはほとんど存在せず,主に細胞質に認められることから,多塩基性ドメインは核移行シグナルとして機能すると考えられた46).また,PLAAT-3をHEK293細胞で発現させるとペルオキシソームの形成に必須のPex19pの機能を酵素活性依存的に阻害することでペルオキシソームの消失を引き起こすことを我々は見いだした54, 55).一方,PLAAT-4ではレチノイン酸で発現が誘導されることが示されており56),分子間で異なる性状や機能も報告されている.
PLAATファミリーの遺伝子改変動物としてPLAAT-3の遺伝子欠損マウスが作製されており,高脂肪食による肥満に耐性を示すことが報告されている57).PLAATファミリーに対する特異的阻害剤(Ki値=数十nM)の開発も進められており58),今後,これらを応用することで個体レベルでの生理機能解析の進展が期待される.
6. NAPE-PLDによるN-アシルエタノールアミンの生成
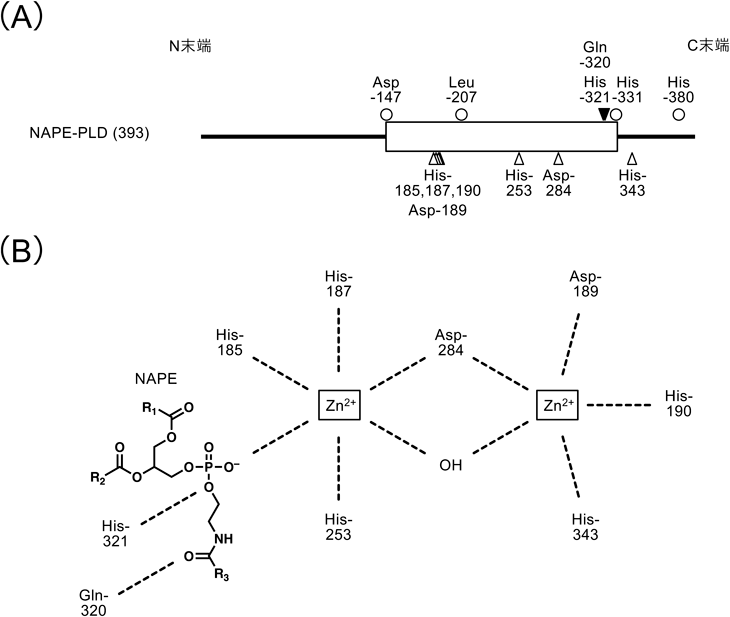
NAPE-PLDはNAPEを特異的に加水分解してN-アシルエタノールアミンとホスファチジン酸を生成するPLD型酵素である.現在の知見では,本酵素は哺乳類において当該反応を触媒できる唯一の酵素である.植物にはNAPE-PLDのオルソログはないが,グリセロリン脂質に広い基質特異性を持つ複数のPLDが当該反応も触媒できる59).筆者らがヒト,マウス,ラットからcDNAクローニングを行ったところ,NAPE-PLDは,よく知られている他のPLDとは異なり,メタロ-β-ラクタマーゼ・フォールドファミリーに属することが判明した31).精製組換えタンパク質の原子吸光分析の結果,亜鉛を含んでおり,精製標品の亜鉛含量と比活性がよく相関することから触媒活性に必須であると考えられた60).点変異体を解析したところ,いくつかのHis, Asp, Leu残基が触媒活性に重要であった(図5A).そこで,同じファミリーに属する枯草菌リボヌクレアーゼZの結晶構造をテンプレートとして,NAPE-PLDの立体構造をモデル化した61).その結果,1分子のNAPE-PLDに亜鉛イオンが2個含まれ,His-185, His-187, His-253が一方の亜鉛イオンに,Asp-189, His-190, His-343が他方の亜鉛イオンに結合しており,Asp-284は両イオン間を架橋すると推定された(図5B).また,His-321は基質であるNAPEのリン酸部分と結合していると考えられた.これらのアミノ酸残基のうちHis-343以外はすべて,前述の点変異体の解析で触媒活性に重要であることが判明しており,両結果はよく一致した.
後にMagottiらはヒトNAPE-PLDの結晶構造解析により本モデルが正しいことを実証し,さらにGln-320がNAPEのアミド結合部分の酸素原子と水素結合を形成することを示唆した62).NAPE-PLDはホモ二量体として存在しており,二つのサブユニットが結合している領域付近の疎水性ポケットに,結晶化に界面活性剤として用いたデオキシコール酸(胆汁酸の一種)が4分子結合していた.デオキシコール酸は酵素活性を3.5倍促進した(EC50値186 μM).一方,安定な二量体を形成できない点変異体の酵素活性はきわめて低く,二量体の形成が触媒機能にも重要と考えられた.
筆者らは精製組換え標品を用いて,本酵素の基質特異性を検討した60).その結果,N-アシル基の炭素数が4以上のNAPEがよい基質であり,パルミトイルエタノールアミド,オレオイルエタノールアミド,アナンダミドのそれぞれ前駆体であるN-パルミトイル-PE(C16:0-NAPE),N-オレオイル-PE(C18:1-NAPE),N-アラキドノイル-PE(C20:4-NAPE)に対しておおむね同程度(1 : 1.2 : 0.7)の活性を持つことが明らかとなった.N-アシル基を持たないPEやその他のグリセロリン脂質は基質とならなかった.興味深いことに,反応に用いる界面活性剤が基質特異性に影響する.筆者らは0.1%オクチルグルコシドを用いたが,Margheritisらは0.2%デオキシコール酸の存在下でC20:4-NAPEがC16:0-NAPEの7倍効率よく加水分解されることを示した63).この結果は胆汁酸の存在する小腸などでアナンダミドが選択的に生成される可能性を示しているが,C18:1-NAPEに対する活性は報告されておらず,摂食後の食欲抑制性のオレオイルエタノールアミドの生成に関わるかは不明である.
酸化ストレスによる脂質過酸化の結果,多価不飽和脂肪酸からイソレブグランジンのような脂質アルデヒドが生成する.これら脂質アルデヒドは起炎性および細胞毒性を有するが,少なくとも作用の一部はPEのアミノ基と反応して生じる脂質アルデヒド修飾PEによることが知られている.Guoらは,NAPE-PLDがイソレブグランジン修飾PEを加水分解できることを示した64).この結果は有害な脂質アルデヒド修飾PEの消去という,本酵素の新たな生理的役割を提示したものとして注目される.
筆者らは,NAPE-PLDの酵素活性を促進する物質として,Mg2+やCa2+などの二価陽イオンや60, 65),スペルミンなどのポリアミン類66),非イオン性界面活性剤Triton X-10065),PEなどのリン脂質67)を報告してきた.これらのうち,Mg2+,ポリアミン類,リン脂質は,細胞内の濃度でNAPE-PLDの活性化が認められることから,前述の胆汁酸と併せて,体内におけるNAPE-PLDの活性維持に貢献している可能性がある.NAPE-PLDの阻害薬については,2019年以前に報告されたものはいずれもIC50値が10 μM以上と強力でなく,特異性も不明だったが68, 69),2020年になってAggarwalらはIC50値が2 μM程度の2種類のジクロロフェン化合物(ヘキサクロロフェンおよびビチオノール)を70),MockらはKi値が27 nM(IC50値は100 nM以下)のLEI-401を71)報告した.LEI-401はCB1およびCB2受容体,ジアシルグリセロールリパーゼやモノアシルグリセロールリパーゼ等の2-AGの代謝酵素,cPLA2ε, FAAHなどを阻害しないことから特異性が高く,さらにin vivoでも視床下部-下垂体-副腎系の活性化や恐怖記憶消去の障害といったCB1アンタゴニスト様の作用が認められ,今後,NAPE-PLDの生理的意義の解明に役立つことが期待される.
NAPE-PLDは全身のさまざまな臓器に発現している.若干の種差があるが,マウスでは精巣,脳,腎臓に多く分布している31).NAPE-PLDの生理的役割を解析する目的で,筆者らを含む三つのグループが全身でNAPE-PLDを欠損するマウスを個々に作出して解析した32, 72, 73).いずれの系統でも外観上の異常は報告されていないが,パルミトイルエタノールアミドなどの飽和脂肪酸およびオレオイルエタノールアミドなどの一価不飽和脂肪酸を含むN-アシルエタノールアミンの脳内含量が野生型と比較して低下した.また,筆者らを含む二つのグループではアナンダミドなどの高度不飽和脂肪酸を含むN-アシルエタノールアミンについても低下を認めたが32, 73),別のグループでは有意差を認めなかった72).これらの系統間の差の原因は不明であるが,食餌の脂肪酸組成が影響する可能性がある74).また,NAPE-PLD欠損マウスの脳ではNAPE含量の顕著な増加も認められた32, 72).以上の結果から,NAPE-PLDは脳における種々のN-アシルエタノールアミンの生合成に中心的な役割を果たすと考えられた.
末梢組織では,筆者らは心臓,腎臓,肝臓,空腸においてNAPE-PLD欠損マウスでもN-アシルエタノールアミン含量が野生型と変わらないことを報告した53).このことはN-アシルエタノールアミンの生合成におけるNAPE-PLDの役割が小さいことを示唆している.しかしながら,NAPE-PLD欠損マウスでは炎症反応の減弱がみられ75),本酵素の炎症における役割が示唆されている.この表現型は,炎症時にはNAPE-PLDの発現低下により抗炎症性のN-アシルエタノールアミンの産生が低下するが,欠損マウスでは他の機構により作られるN-アシルエタノールアミンの産生が持続するためと説明されている.さらに,脂肪細胞76)あるいは腸管上皮細胞77)のNAPE-PLDを特異的に欠損したマウスでは肥満傾向を示すことから,これらの組織に存在する本酵素がエネルギー代謝に関わることが示唆されている.後者のマウスについては,野生型では食後に産生誘導される食欲抑制性のオレオイルエタノールアミドが腸管で生合成できないことが過食と肥満の原因であると考えられた.NAPE-PLDを欠損させた腸管上皮様Caco-2細胞を用いた検討でも,本酵素がオレオイルエタノールアミドの生合成と脂肪の吸収を制御するなど,これを支持する知見が報じられている78).
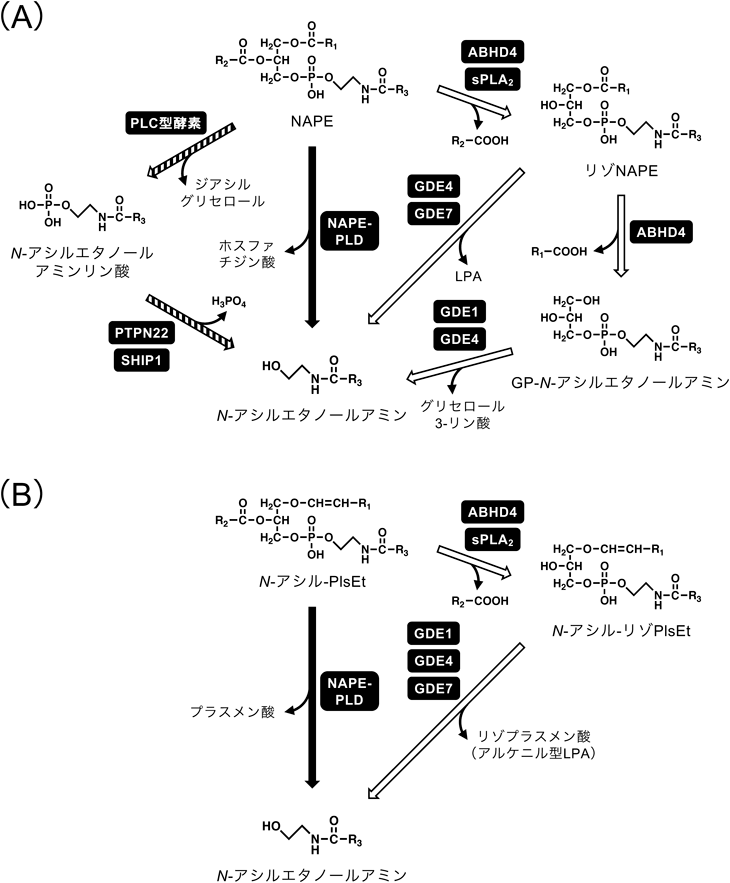
7. NAPE-PLD非依存的なN-アシルエタノールアミンの生成
前章のとおり,NAPE-PLD欠損マウスの臓器でも一定量のN-アシルエタノールアミンが含まれるが,これはNAPE-PLD非依存的なN-アシルエタノールアミンの生成機構の存在を示している.1984年には,NAPEからO-アシル鎖が1本脱離したN-アシル-リゾPE(リゾNAPE)を介して,NAPEからN-アシルエタノールアミンが生成することがイヌ脳由来のタンパク質標品を用いた実験から示されていた(図6A)79).リゾNAPEは,さらにO-アシル鎖が脱離してグリセロホスホ-N-アシルエタノールアミン(GP-N-アシルエタノールアミン)となった後に,ホスホジエステル結合が加水分解されてN-アシルエタノールアミンが生成する.もしくは,リゾNAPEがリゾPLD型反応によるホスホジエステル結合の加水分解を受けてN-アシルエタノールアミンが生成する.筆者らはNAPE-PLD欠損マウスの脳においてNAPEだけでなく,リゾNAPEやGP-N-アシルエタノールアミンが顕著に蓄積していることを示し,実際にマウス脳で本経路が機能していることを明らかにした32).
脳にはPlsEtのようなプラスマローゲン型エタノールアミンリン脂質が豊富なことと一致してN-アシル-PlsEtが存在するが,NAPEと同様にNAPE-PLDの基質となりN-アシルエタノールアミンを生成する(図6B)32).筆者らはNAPE-PLD欠損マウスの脳でN-アシル-PlsEtおよび,そのO-脱アシル体であるN-アシル-リゾプラスメニルエタノールアミン(N-アシル-リゾPlsEt)が蓄積していることを示し,N-アシル-PlsEtもin vivoでNAPE-PLD依存的および非依存的なN-アシルエタノールアミン生成経路の前駆体となることを示唆した32).N-アシル-リゾPlsEtのsn-1位にはエーテル結合が存在し,リゾNAPEを加水分解するエステラーゼでは切断できないと考えられるので,N-アシル-リゾPlsEtを介したN-アシルエタノールアミンの生成にはリゾPLD反応が重要である.
筆者らを含む複数の研究者が,NAPE-PLD非依存的なN-アシルエタノールアミンの生成経路に関わる酵素の解析を進めている.筆者らは分泌型ホスホリパーゼA2のうち,少なくともグループIB, IIA, VはNAPEを加水分解してリゾNAPEを生成できることを示した80).同様にN-アシル-PlsEtも基質となると予想される.その後,SimonとCravattはα/βヒドロラーゼ4(α/β-hydrolase 4あるいはα/β hydrolase domain-containing protein 4:ABHD4)がNAPEをリゾNAPEに,さらにリゾNAPEをGP-N-アシルエタノールアミンに加水分解する二つの脱O-アシル化反応を順次触媒することを示した81).ABHD4はN-アシル-PlsEtも基質とする82).ABHD4欠損マウスの脳ではGP-N-アシルエタノールアミンおよびN-アシル-リゾPlsEtが減少しており,本酵素は生理的に重要と考えられる82).GP-N-アシルエタノールアミンを加水分解してN-アシルエタノールアミンを生成するホスホジエステラーゼ活性を持つ酵素として,グリセロホスホジエステラーゼ(glycerophosphodiesterase:GDE)・ファミリーに属するGDE1をSimonとCravattが83),後にGDE4を筆者らが84)報告した.両者とも活性発現にMg2+を必要とするが,GP-N-アシルエタノールアミンに対する精製酵素の水解活性はGDE1がGDE4より100倍以上強く,GDE1欠損マウスの脳ホモジネートでは同活性がほとんど消失した85).しかしながら,GDE1欠損マウスのGP-N-アシルエタノールアミンおよびN-アシルエタノールアミンの脳内含量に異常はなく,また,NAPE-PLD欠損マウスに対して,GDE1欠損を導入して二重欠損マウスとしてもN-アシルエタノールアミンの脳内含量は有意に変わらなかった.したがって,GDE1とNAPE-PLDを介さずにN-アシルエタノールアミンを生成する未知の機構の存在が示唆された.
前述のとおり,N-アシル-リゾPEもしくはN-アシル-リゾPlsEtがリゾPLD型の加水分解を受けると,GP-N-アシルエタノールアミンを介さずにN-アシルエタノールアミンが生成される.本反応を触媒する酵素として,筆者らはGDE484)とGDE786)を見いだした.Mg2+依存性のGDE4と対照的に,GDE7の活性はCa2+依存的であった.GDE1もN-アシル-リゾPlsEtを加水分解できるが,その活性はきわめて低い32).リゾPLD型反応ではリゾホスファチジン酸(LPA)が同時に生成することからLPA生成機構としての役割も考えられる.
O-脱アシル体(リゾ体)を介さないアナンダミドの生合成経路として,ホスホリパーゼC-ホスファターゼ経路も提唱されている87, 88).すなわち,ホスホリパーゼC型の酵素によりC20:4-NAPEからアナンダミドリン酸が生成し,その後,チロシンホスファターゼPTPN22もしくはイノシトール5-ホスファターゼSHIP1による脱リン酸化を受けてアナンダミドが生成する反応であるが,in vivoでの解析は進んでいない.また,N-アシルエタノールアミンの加水分解酵素であるFAAHの逆反応により,アラキドン酸とエタノールアミンからアナンダミドが生成することも可能であり89),実際,FAAH欠損マウスを用いた解析により,死後の脳におけるアナンダミドの蓄積がFAAHに依存することが明らかにされた90).
本稿では,N-アシルエタノールアミンの生合成経路と責任酵素に焦点を当てた.生合成の前半では生体膜に豊富に存在するPEから特殊なリン脂質であるNAPEがN-アシル転移反応により生成する.この反応を触媒できる酵素は少なくとも6種類あり,酵素タンパク質としての実体解明と性状解析が行われた.今後,それぞれの酵素の生理・病態生理的役割を解明する目的で,遺伝子欠損マウスを用いた解析が進展することを期待したい.
後半の反応ではNAPEからN-アシルエタノールアミンが遊離されるが,この反応を一段階で触媒するNAPE-PLDに加えて,NAPE-PLD非依存的な多段階経路の実体が明らかとなりつつある.NAPE-PLDについては遺伝子欠損マウスや特異的阻害薬を用いて生理的意義の解明が始まっており一定の成果が得られつつある.N-アシルエタノールアミンが脂質メディエーターとして広範な生理・病態生理過程に関わることを考慮すれば,今後もさまざまな病態モデルで検討されることが望まれる.NAPE-PLD非依存的経路に関わる酵素の生理的意義についてはほとんどわかっておらず,遺伝子欠損マウスを用いた解析が待たれる.
同一の反応を複数の酵素が触媒し,またN-アシルエタノールアミンに至る複数の経路が存在することから多重欠損マウスの利用を含めた検討が,当該酵素ならびにN-アシルエタノールアミンの生理的役割の解明に有効かもしれない.併せて,リゾNAPEやGP-N-アシルエタノールアミンが単なる中間代謝物でなく,それ自体に生物活性がある可能性もある.今後の解析に期待したい.
引用文献References
1) Kuehl, F.A. Jr., Jacob, T.A., Ganley, O.H., Ormond, R.E., & Meisinger, M.A.P. (1957) The identification of N-(2-hydroxyethyl)-palmitamide as a naturally occurring anti-inflammatory agent. J. Am. Chem. Soc., 79, 5577–5578.
2) Ganley, O.H., Graessle, O.E., & Robinson, H.J. (1958) Anti-inflammatory activity on compounds obtained from egg yolk, peanut oil, and soybean lecithin. J. Lab. Clin. Med., 51, 709–714.
3) Devane, W.A., Hanus, L., Breuer, A., Pertwee, R.G., Stevenson, L.A., Griffin, G., Gibson, D., Mandelbaum, A., Etinger, A., & Mechoulam, R. (1992) Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science, 258, 1946–1949.
4) Hussain, Z., Uyama, T., Tsuboi, K., & Ueda, N. (2017) Mammalian enzymes responsible for the biosynthesis of N-acylethanolamines. Biochim. Biophys. Acta, 1862, 1546–1561.
5) Binte Mustafiz, S.S., Uyama, T., Hussain, Z., Tsuboi, K., & Ueda, N. (2018) The biosynthetic pathways of N-acylethanolamines in mammals. in eLS, a27711, John Wiley & Sons, Ltd., Chichester.
6) Tsuboi, K., Uyama, T., Okamoto, Y., & Ueda, N. (2018) Endocannabinoids and related N-acylethanolamines: biological activities and metabolism. Inflamm. Regen., 38, 28.
7) Mattace Raso, G., Russo, R., Calignano, A., & Meli, R. (2014) Palmitoylethanolamide in CNS health and disease. Pharmacol. Res., 86, 32–41.
8) Petrosino, S. & Di Marzo, V. (2017) The pharmacology of palmitoylethanolamide and first data on the therapeutic efficacy of some of its new formulations. Br. J. Pharmacol., 174, 1349–1365.
9) Lo Verme, J., Fu, J., Astarita, G., La Rana, G., Russo, R., Calignano, A., & Piomelli, D. (2005) The nuclear receptor peroxisome proliferator-activated receptor-α mediates the anti-inflammatory actions of palmitoylethanolamide. Mol. Pharmacol., 67, 15–19.
10) Ryberg, E., Larsson, N., Sjögren, S., Hjorth, S., Hermansson, N.-O., Leonova, J., Elebring, T., Nilsson, K., Drmota, T., & Greasley, P.J. (2007) The orphan receptor GPR55 is a novel cannabinoid receptor. Br. J. Pharmacol., 152, 1092–1101.
11) Fu, J., Gaetani, S., Oveisi, F., Lo Verme, J., Serrano, A., Rodríguez de Fonseca, F., Rosengarth, A., Luecke, H., Di Giacomo, B., Tarzia, G., et al. (2003) Oleylethanolamide regulates feeding and body weight through activation of the nuclear receptor PPAR-α. Nature, 425, 90–93.
12) Pavón, F.J., Serrano, A., Romero-Cuevas, M., Alonso, M., & Rodríguez de Fonseca, F. (2010) Oleoylethanolamide: a new player in peripheral control of energy metabolism. Therapeutic implications. Drug Discov. Today Dis. Mech., 7, e175–e183.
13) Piomelli, D. (2013) A fatty gut feeling. Trends Endocrinol. Metab., 24, 332–341.
14) DiPatrizio, N.V. & Piomelli, D. (2015) Intestinal lipid-derived signals that sense dietary fat. J. Clin. Invest., 125, 891–898.
15) Overton, H.A., Babbs, A.J., Doel, S.M., Fyfe, M.C.T., Gardner, L.S., Griffin, G., Jackson, H.C., Procter, M.J., Rasamison, C.M., Tang-Christensen, M., et al. (2006) Deorphanization of a G protein-coupled receptor for oleoylethanolamide and its use in the discovery of small-molecule hypophagic agents. Cell Metab., 3, 167–175.
16) Wang, X., Miyares, R.L., & Ahern, G.P. (2005) Oleoylethanolamide excites vagal sensory neurones, induces visceral pain and reduces short-term food intake in mice via capsaicin receptor TRPV1. J. Physiol., 564, 541–547.
17) Lan, H., Vassileva, G., Corona, A., Liu, L., Baker, H., Golovko, A., Abbondanzo, S.J., Hu, W., Yang, S., Ning, Y., et al. (2009) GPR119 is required for physiological regulation of glucagon-like peptide-1 secretion but not for metabolic homeostasis. J. Endocrinol., 201, 219–230.
18) Lo Verme, J., Gaetani, S., Fu, J., Oveisi, F., Burton, K., & Piomelli, D. (2005) Regulation of food intake by oleoylethanolamide. Cell. Mol. Life Sci., 62, 708–716.
19) González-Aparicio, R. & Moratalla, R. (2014) Oleoylethanolamide reduces L-DOPA-induced dyskinesia via TRPV1 receptor in a mouse model of Parkinson’s disease. Neurobiol. Dis., 62, 416–425.
20) Mechoulam, R., Ben-Shabat, S., Hanus, L., Ligumsky, M., Kaminski, N.E., Schatz, A.R., Gopher, A., Almog, S., Martin, B.R., & Compton, D.R. (1995) Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors. Biochem. Pharmacol., 50, 83–90.
21) Sugiura, T., Kondo, S., Sukagawa, A., Nakane, S., Shinoda, A., Itoh, K., Yamashita, A., & Waku, K. (1995) 2-Arachidonoylglycerol: a possible endogenous cannabinoid receptor ligand in brain. Biochem. Biophys. Res. Commun., 215, 89–97.
22) Howlett, A.C. & Abood, M.E. (2017) CB1 and CB2 receptor pharmacology. Adv. Pharmacol., 80, 169–206.
23) Sugiura, T., Kishimoto, S., Oka, S., & Gokoh, M. (2006) Biochemistry, pharmacology and physiology of 2-arachidonoylglycerol, an endogenous cannabinoid receptor ligand. Prog. Lipid Res., 45, 405–446.
24) Starowicz, K., Nigam, S., & Di Marzo, V. (2007) Biochemistry and pharmacology of endovanilloids. Pharmacol. Ther., 114, 13–33.
25) Watson, J.E., Kim, J.S., & Das, A. (2019) Emerging class of omega-3 fatty acid endocannabinoids & their derivatives. Prostaglandins Other Lipid Mediat., 143, 106337.
26) Lee, J.-W., Huang, B.X., Kwon, H., Rashid, M.A., Kharebava, G., Desai, A., Patnaik, S., Marugan, J., & Kim, H.-Y. (2016) Orphan GPR110 (ADGRF1) targeted by N-docosahexaenoylethanolamine in development of neurons and cognitive function. Nat. Commun., 7, 13123.
27) Kim, H.-Y. & Spector, A.A. (2018) N-Docosahexaenoylethanolamine: A neurotrophic and neuroprotective metabolite of docosahexaenoic acid. Mol. Aspects Med., 64, 34–44.
28) Schmid, H.H.O., Schmid, P.C., & Natarajan, V. (1990) N-Acylated glycerophospholipids and their derivatives. Prog. Lipid Res., 29, 1–43.
29) Ogura, Y., Parsons, W.H., Kamat, S.S., & Cravatt, B.F. (2016) A calcium-dependent acyltransferase that produces N-acyl phosphatidylethanolamines. Nat. Chem. Biol., 12, 669–671.
30) Wellner, N., Diep, T.A., Janfelt, C., & Hansen, H.S. (2013) N-acylation of phosphatidylethanolamine and its biological functions in mammals. Biochim. Biophys. Acta, 1831, 652–662.
31) Okamoto, Y., Morishita, J., Tsuboi, K., Tonai, T., & Ueda, N. (2004) Molecular characterization of a phospholipase D generating anandamide and its congeners. J. Biol. Chem., 279, 5298–5305.
32) Tsuboi, K., Okamoto, Y., Ikematsu, N., Inoue, M., Shimizu, Y., Uyama, T., Wang, J., Deutsch, D.G., Burns, M.P., Ulloa, N.M., et al. (2011) Enzymatic formation of N-acylethanolamines from N-acylethanolamine plasmalogen through N-acylphosphatidylethanolamine-hydrolyzing phospholipase D-dependent and -independent pathways. Biochim. Biophys. Acta, 1811, 565–577.
33) Cadas, H., di Tomaso, E., & Piomelli, D. (1997) Occurrence and biosynthesis of endogenous cannabinoid precursor, N-arachidonoyl phosphatidylethanolamine, in rat brain. J. Neurosci., 17, 1226–1242.
34) Cadas, H., Gaillet, S., Beltramo, M., Venance, L., & Piomelli, D. (1996) Biosynthesis of an endogenous cannabinoid precursor in neurons and its control by calcium and cAMP. J. Neurosci., 16, 3934–3942.
35) Moesgaard, B., Petersen, G., Jaroszewski, J.W., & Hansen, H.S. (2000) Age dependent accumulation of N-acyl-ethanolamine phospholipids in ischemic rat brain: a 31P NMR and enzyme activity study. J. Lipid Res., 41, 985–990.
36) Ohto, T., Uozumi, N., Hirabayashi, T., & Shimizu, T. (2005) Identification of novel cytosolic phospholipase A2s, murine cPLA2δ, ε, and ζ, which form a gene cluster with cPLA2β. J. Biol. Chem., 280, 24576–24583.
37) Kita, Y., Shindou, H., & Shimizu, T. (2019) Cytosolic phospholipase A2 and lysophospholipid acyltransferases. Biochim. Biophys. Acta, 1864, 838–845.
38) Capestrano, M., Mariggio, S., Perinetti, G., Egorova, A.V., Iacobacci, S., Santoro, M., Di Pentima, A., Iurisci, C., Egorov, M.V., Di Tullio, G., et al. (2014) Cytosolic phospholipase A2ε drives recycling through the clathrin-independent endocytic route. J. Cell Sci., 127, 977–993.
39) Hussain, Z., Uyama, T., Kawai, K., Binte Mustafiz, S.S., Tsuboi, K., Araki, N., & Ueda, N. (2018) Phosphatidylserine-stimulated production of N-acyl-phosphatidylethanolamines by Ca2+-dependent N-acyltransferase. Biochim. Biophys. Acta, 1863, 493–502.
40) Binte Mustafiz, S.S., Uyama, T., Hussain, Z., Kawai, K., Tsuboi, K., Araki, N., & Ueda, N. (2019) The role of intracellular anionic phospholipids in the production of N-acyl-phosphatidylethanolamines by cytosolic phospholipase A2ε. J. Biochem., 165, 343–352.
41) Binte Mustafiz, S.S., Uyama, T., Morito, K., Takahashi, N., Kawai, K., Hussain, Z., Tsuboi, K., Araki, N., Yamamoto, K., Tanaka, T., et al. (2019) Intracellular Ca2+-dependent formation of N-acyl-phosphatidylethanolamines by human cytosolic phospholipase A2ε. Biochim. Biophys. Acta, 1864, 158515.
42) Palese, F., Pontis, S., Realini, N., & Piomelli, D. (2019) A protective role for N-acylphosphatidylethanolamine phospholipase D in 6-OHDA-induced neurodegeneration. Sci. Rep., 9, 15927.
43) Uyama, T., Tsuboi, K., & Ueda, N. (2017) An involvement of phospholipase A/acyltransferase family proteins in peroxisome regulation and plasmalogen metabolism. FEBS Lett., 591, 2745–2760.
44) Jahng, W.J., Xue, L., & Rando, R.R. (2003) Lecithin retinol acyltransferase is a founder member of a novel family of enzymes. Biochemistry, 42, 12805–12812.
45) Shinohara, N., Uyama, T., Jin, X.-H., Tsuboi, K., Tonai, T., Houchi, H., & Ueda, N. (2011) Enzymological analysis of the tumor suppressor A-C1 reveals a novel group of phospholipid-metabolizing enzymes. J. Lipid Res., 52, 1927–1935.
46) Hussain, Z., Uyama, T., Kawai, K., Rahman, I.A.S., Tsuboi, K., Araki, N., & Ueda, N. (2016) Comparative analyses of isoforms of the calcium-independent phosphatidylethanolamine N-acyltransferase PLAAT-1 in humans and mice. J. Lipid Res., 57, 2051–2060.
47) Uyama, T., Morishita, J., Jin, X.-H., Okamoto, Y., Tsuboi, K., & Ueda, N. (2009) The tumor suppressor gene H-Rev107 functions as a novel Ca2+-independent cytosolic phospholipase A1/2 of the thiol hydrolase type. J. Lipid Res., 50, 685–693.
48) Uyama, T., Jin, X.-H., Tsuboi, K., Tonai, T., & Ueda, N. (2009) Characterization of the human tumor suppressors TIG3 and HRASLS2 as phospholipid-metabolizing enzymes. Biochim. Biophys. Acta, 1791, 1114–1124.
49) Golczak, M., Kiser, P.D., Sears, A.E., Lodowski, D.T., Blaner, W.S., & Palczewski, K. (2012) Structural basis for the acyltransferase activity of lecithin:retinol acyltransferase-like proteins. J. Biol. Chem., 287, 23790–23807.
50) Pang, X.-Y., Cao, J., Addington, L., Lovell, S., Battaile, K.P., Zhang, N., Rao, J.L.U.M., Dennis, E.A., & Moise, A.R. (2012) Structure/function relationships of adipose phospholipase A2 containing a Cys-His-His catalytic triad. J. Biol. Chem., 287, 35260–35274.
51) Uyama, T., Ikematsu, N., Inoue, M., Shinohara, N., Jin, X.-H., Tsuboi, K., Tonai, T., Tokumura, A., & Ueda, N. (2012) Generation of N-acylphosphatidylethanolamine by members of the phospholipase A/acyltransferase (PLA/AT) family. J. Biol. Chem., 287, 31905–31919.
52) Uyama, T., Inoue, M., Okamoto, Y., Shinohara, N., Tai, T., Tsuboi, K., Inoue, T., Tokumura, A., & Ueda, N. (2013) Involvement of phospholipase A/acyltransferase-1 in N-acylphosphatidylethanolamine generation. Biochim. Biophys. Acta, 1831, 1690–1701.
53) Inoue, M., Tsuboi, K., Okamoto, Y., Hidaka, M., Uyama, T., Tsutsumi, T., Tanaka, T., Ueda, N., & Tokumura, A. (2017) Peripheral tissue levels and molecular species compositions of N-acyl-phosphatidylethanolamine and its metabolites in mice lacking N-acyl-phosphatidylethanolamine-specific phospholipase D. J. Biochem., 162, 449–458.
54) Uyama, T., Ichi, I., Kono, N., Inoue, A., Tsuboi, K., Jin, X.-H., Araki, N., Aoki, J., Arai, H., & Ueda, N. (2012) Regulation of peroxisomal lipid metabolism by catalytic activity of tumor suppressor H-rev107. J. Biol. Chem., 287, 2706–2718.
55) Uyama, T., Kawai, K., Kono, N., Watanabe, M., Tsuboi, K., Inoue, T., Araki, N., Arai, H., & Ueda, N. (2015) Interaction of phospholipase A/acyltransferase-3 with Pex19p: a possible involvement in the down-regulation of peroxisomes. J. Biol. Chem., 290, 17520–17534.
56) DiSepio, D., Ghosn, C., Eckert, R.L., Deucher, A., Robinson, N., Duvic, M., Chandraratna, R.A.S., & Nagpal, S. (1998) Identification and characterization of a retinoid-induced class II tumor suppressor/growth regulatory gene. Proc. Natl. Acad. Sci. USA, 95, 14811–14815.
57) Jaworski, K., Ahmadian, M., Duncan, R.E., Sarkadi-Nagy, E., Varady, K.A., Hellerstein, M.K., Lee, H.-Y., Samuel, V.T., Shulman, G.I., Kim, K.-H., et al. (2009) AdPLA ablation increases lipolysis and prevents obesity induced by high-fat feeding or leptin deficiency. Nat. Med., 15, 159–168.
58) Zhou, J., Mock, E.D., Martella, A., Kantae, V., Di, X., Burggraaff, L., Baggelaar, M.P., Al-Ayed, K., Bakker, A., Florea, B.I., et al. (2019) Activity-based protein profiling identifies α-ketoamides as inhibitors for phospholipase A2 group XVI. ACS Chem. Biol., 14, 164–169.
59) Kilaru, A., Blancaflor, E.B., Venables, B.J., Tripathy, S., Mysore, K.S., & Chapman, K.D. (2007) The N-acylethanolamine-mediated regulatory pathway in plants. Chem. Biodivers., 4, 1933–1955.
60) Wang, J., Okamoto, Y., Morishita, J., Tsuboi, K., Miyatake, A., & Ueda, N. (2006) Functional analysis of the purified anandamide-generating phospholipase D as a member of the metallo-β-lactamase family. J. Biol. Chem., 281, 12325–12335.
61) Okamoto, Y., Wang, J., Morishita, J., & Ueda, N. (2007) Biosynthetic pathways of the endocannabinoid anandamide. Chem. Biodivers., 4, 1842–1857.
62) Magotti, P., Bauer, I., Igarashi, M., Babagoli, M., Marotta, R., Piomelli, D., & Garau, G. (2015) Structure of human N-acylphosphatidylethanolamine-hydrolyzing phospholipase D: regulation of fatty-acid ethanolamide biosynthesis by bile acids. Structure, 23, 598–604.
63) Margheritis, E., Castellani, B., Magotti, P., Peruzzi, S., Romeo, E., Natali, F., Mostarda, S., Gioiello, A., Piomelli, D., & Garau, G. (2016) Bile acid recognition by NAPE-PLD. ACS Chem. Biol., 11, 2908–2914.
64) Guo, L., Gragg, S.D., Chen, Z., Zhang, Y., Amarnath, V., & Davies, S.S. (2013) Isolevuglandin-modified phosphatidylethanolamine is metabolized by NAPE-hydrolyzing phospholipase D. J. Lipid Res., 54, 3151–3157.
65) Ueda, N., Liu, Q., & Yamanaka, K. (2001) Marked activation of the N-acylphosphatidylethanolamine-hydrolyzing phosphodiesterase by divalent cations. Biochim. Biophys. Acta, 1532, 121–127.
66) Liu, Q., Tonai, T., & Ueda, N. (2002) Activation of N-acylethanolamine-releasing phospholipase D by polyamines. Chem. Phys. Lipids, 115, 77–84.
67) Wang, J., Okamoto, Y., Tsuboi, K., & Ueda, N. (2008) The stimulatory effect of phosphatidylethanolamine on N-acylphosphatidylethanolamine-hydrolyzing phospholipase D (NAPE-PLD). Neuropharmacology, 54, 8–15.
68) Petersen, G., Pedersen, A.H., Pickering, D.S., Begtrup, M., & Hansen, H.S. (2009) Effect of synthetic and natural phospholipids on N-acylphosphatidylethanolamine-hydrolyzing phospholipase D activity. Chem. Phys. Lipids, 162, 53–61.
69) Castellani, B., Diamanti, E., Pizzirani, D., Tardia, P., Maccesi, M., Realini, N., Magotti, P., Garau, G., Bakkum, T., Rivara, S., et al. (2017) Synthesis and characterization of the first inhibitor of N-acylphosphatidylethanolamine phospholipase D (NAPE-PLD). Chem. Commun. (Camb.), 53, 12814–12817.
70) Aggarwal, G., Zarrow, J.E., Mashhadi, Z., Flynn, C.R., Vinson, P., Weaver, C.D., & Davies, S.S. (2020) Symmetrically substituted dichlorophenes inhibit N-acyl-phosphatidylethanolamine phospholipase D. J. Biol. Chem., 295, 7289–7300.
71) Mock, E.D., Mustafa, M., Gunduz-Cinar, O., Cinar, R., Petrie, G.N., Kantae, V., Di, X., Ogasawara, D., Varga, Z.V., Paloczi, J., et al. (2020) Discovery of a NAPE-PLD inhibitor that modulates emotional behavior in mice. Nat. Chem. Biol., 16, 667–675.
72) Leung, D., Saghatelian, A., Simon, G.M., & Cravatt, B.F. (2006) Inactivation of N-acyl phosphatidylethanolamine phospholipase D reveals multiple mechanisms for the biosynthesis of endocannabinoids. Biochemistry, 45, 4720–4726.
73) Leishman, E., Mackie, K., Luquet, S., & Bradshaw, H.B. (2016) Lipidomics profile of a NAPE-PLD KO mouse provides evidence of a broader role of this enzyme in lipid metabolism in the brain. Biochim. Biophys. Acta, 1861, 491–500.
74) Lin, L., Metherel, A.H., Kitson, A.P., Alashmali, S.M., Hopperton, K.E., Trépanier, M.-O., Jones, P.J., & Bazinet, R.P. (2018) Dietary fatty acids augment tissue levels of n-acylethanolamines in n-acylphosphatidylethanolamine phospholipase D (NAPE-PLD) knockout mice. J. Nutr. Biochem., 62, 134–142.
75) Zhu, C., Solorzano, C., Sahar, S., Realini, N., Fung, E., Sassone-Corsi, P., & Piomelli, D. (2011) Proinflammatory stimuli control N-acylphosphatidylethanolamine-specific phospholipase D expression in macrophages. Mol. Pharmacol., 79, 786–792.
76) Geurts, L., Everard, A., Van Hul, M., Essaghir, A., Duparc, T., Matamoros, S., Plovier, H., Castel, J., Denis, R.G.P., Bergiers, M., et al. (2015) Adipose tissue NAPE-PLD controls fat mass development by altering the browning process and gut microbiota. Nat. Commun., 6, 6495.
77) Everard, A., Plovier, H., Rastelli, M., Van Hul, M., de Wouters d’Oplinter, A., Geurts, L., Druart, C., Robine, S., Delzenne, N.M., Muccioli, G.G., et al. (2019) Intestinal epithelial N-acylphosphatidylethanolamine phospholipase D links dietary fat to metabolic adaptations in obesity and steatosis. Nat. Commun., 10, 457.
78) Igarashi, M., Watanabe, K., Tsuduki, T., Kimura, I., & Kubota, N. (2019) NAPE-PLD controls OEA synthesis and fat absorption by regulating lipoprotein synthesis in an in vitro model of intestinal epithelial cells. FASEB J., 33, 3167–3179.
79) Natarajan, V., Schmid, P.C., Reddy, P.V., & Schmid, H.H.O. (1984) Catabolism of N-acylethanolamine phospholipids by dog brain preparations. J. Neurochem., 42, 1613–1619.
80) Sun, Y.-X., Tsuboi, K., Okamoto, Y., Tonai, T., Murakami, M., Kudo, I., & Ueda, N. (2004) Biosynthesis of anandamide and N-palmitoylethanolamine by sequential actions of phospholipase A2 and lysophospholipase D. Biochem. J., 380, 749–756.
81) Simon, G.M. & Cravatt, B.F. (2006) Endocannabinoid biosynthesis proceeding through glycerophospho-N-acyl ethanolamine and a role for α/β-hydrolase 4 in this pathway. J. Biol. Chem., 281, 26465–26472.
82) Lee, H.-C., Simon, G.M., & Cravatt, B.F. (2015) ABHD4 regulates multiple classes of N-acyl phospholipids in the mammalian central nervous system. Biochemistry, 54, 2539–2549.
83) Simon, G.M. & Cravatt, B.F. (2008) Anandamide biosynthesis catalyzed by the phosphodiesterase GDE1 and detection of glycerophospho-N-acyl ethanolamine precursors in mouse brain. J. Biol. Chem., 283, 9341–9349.
84) Tsuboi, K., Okamoto, Y., Rahman, I.A.S., Uyama, T., Inoue, T., Tokumura, A., & Ueda, N. (2015) Glycerophosphodiesterase GDE4 as a novel lysophospholipase D: a possible involvement in bioactive N-acylethanolamine biosynthesis. Biochim. Biophys. Acta, 1851, 537–548.
85) Simon, G.M. & Cravatt, B.F. (2010) Characterization of mice lacking candidate N-acyl ethanolamine biosynthetic enzymes provides evidence for multiple pathways that contribute to endocannabinoid production in vivo. Mol. Biosyst., 6, 1411–1418.
86) Rahman, I.A.S., Tsuboi, K., Hussain, Z., Yamashita, R., Okamoto, Y., Uyama, T., Yamazaki, N., Tanaka, T., Tokumura, A., & Ueda, N. (2016) Calcium-dependent generation of N-acylethanolamines and lysophosphatidic acids by glycerophosphodiesterase GDE7. Biochim. Biophys. Acta, 1861, 1881–1892.
87) Liu, J., Wang, L., Harvey-White, J., Osei-Hyiaman, D., Razdan, R., Gong, Q., Chan, A.C., Zhou, Z., Huang, B.X., Kim, H.-Y., et al. (2006) A biosynthetic pathway for anandamide. Proc. Natl. Acad. Sci. USA, 103, 13345–13350.
88) Liu, J., Wang, L., Harvey-White, J., Huang, B.X., Kim, H.-Y., Luquet, S., Palmiter, R.D., Krystal, G., Rai, R., Mahadevan, A., et al. (2008) Multiple pathways involved in the biosynthesis of anandamide. Neuropharmacology, 54, 1–7.
89) Katayama, K., Ueda, N., Katoh, I., & Yamamoto, S. (1999) Equilibrium in the hydrolysis and synthesis of cannabimimetic anandamide demonstrated by a purified enzyme. Biochim. Biophys. Acta, 1440, 205–214.
90) Patel, S., Carrier, E.J., Ho, W.-S.V., Rademacher, D.J., Cunningham, S., Reddy, D.S., Falck, J.R., Cravatt, B.F., & Hillard, C.J. (2005) The postmortal accumulation of brain N-arachidonylethanolamine (anandamide) is dependent upon fatty acid amide hydrolase activity. J. Lipid Res., 46, 342–349.
著者紹介Author Profile
 坪井 一人(つぼい かずひと)
坪井 一人(つぼい かずひと)川崎医科大学医学部薬理学講師.博士(薬学).
略歴1974年奈良市に生る.96年京都大学薬学部卒業.2001年同大学院薬学研究科博士後期課程修了.香川大学医学部(助手,助教),米国イリノイ大学シカゴ校(学振海外特別研究員)を経て,17年より現職.
研究テーマと抱負受容体・代謝・シグナル伝達と,脂質メディエーターの生理的役割の解明を目指して様々な側面からアプローチしてきました.日々の研究が人類の健康増進に貢献出来ることを願っております.
ウェブサイトhttps://m.kawasaki-m.ac.jp/classroom/course.php?id=205
趣味子供と散歩.
 宇山 徹(うやま とおる)
宇山 徹(うやま とおる)香川大学医学部生体分子医学講座生化学学内講師.博士(薬学).
略歴1976年山口県に生る.2000年神戸薬科大学薬学部卒業.05年同大学院薬学研究科修了.04~06年学術振興会特別研究員.06~07年University of Alabama at Birmingham校博士研究員.07年より香川大学医学部助教,16年より学内講師,現在に至る.
研究テーマと抱負生理活性脂質およびその代謝酵素の機能解析.現在従事しているPLAATファミリーの生理機能やN-アシル化リン脂質の機能を明らかにしたい.
ウェブサイトhttp://www.kms.ac.jp/~biochem/index.html
趣味旅行,お酒.
 上田 夏生(うえだ なつお)
上田 夏生(うえだ なつお)香川大学医学部生体分子医学講座生化学教授.医学博士.
略歴1958年大阪市に生る.83年徳島大学医学部医学科卒業.87年同大学院医学研究科博士課程修了.徳島大学助手,講師,助教授等を経て,2001年より香川医科大学(現・香川大学医学部)教授.17年より医学部長を併任.現在に至る.
研究テーマと抱負酵素学及び脂質生物学.これまでの経験を活かし,脂質生化学分野において機能未知の脂質分子や酵素に焦点を充て,それらの生理作用や病態との係わりを明らかにしていきたい.
ウェブサイトhttp://www.kms.ac.jp/~biochem/index.html
趣味鉄道旅行,美術館・寺社巡り.