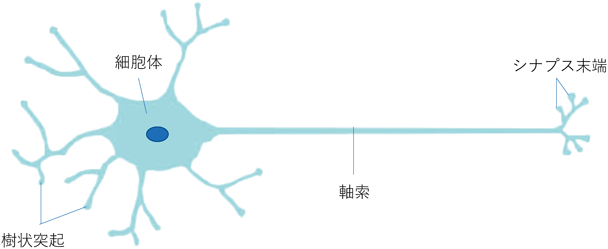
神経細胞の細胞膜は,シナプス領域,傍シナプス領域,軸索領域,細胞体領域など,機能の異なる複数の領域を持つ(図1).このように細胞表面の限られた領域に特定の機能を与えること(機能ドメインの形成)により,神経細胞は,その細胞機能である方向性を持つ情報伝達と複雑な神経回路の形成を可能にしている.また,この種の機能ドメインは,神経細胞に限らず,細胞極性を持つ多くの細胞においても見いだされ,細胞機能に必須の役割を担っている.
細胞膜上に機能ドメインを形成するためには,大きく分けて以下の二つの機構が関与する.第一は,各膜ドメイン固有の機能を担うタンパク質(標的膜タンパク質)を各々の機能ドメインへ正しく輸送する機構である.膜タンパク質は細胞内小胞の膜に埋め込まれた形で輸送(小胞輸送)されるので,この過程は,標的膜タンパク質を選択的に運ぶ輸送小胞の形成機構,これを細胞表面の目的の膜領域近傍へ運ぶ機構,最後に,細胞膜上の正しい膜領域とのみ輸送小胞が膜融合する機構などと,さらに分割して考えられる.第二は,目的の膜領域に届けられた標的膜タンパク質の局在を維持する機構である.Singer-Nicolsonの流動モザイクモデル1)で知られるように,一般的に細胞膜上の膜タンパク質は数分で細胞を一周しうる速度で不規則に細胞表面全体を動いている2).機能ドメインを維持するには,この流動性にもかかわらず,標的タンパク質を所定の範囲内(本稿で扱うのは径にして0.1 µm~数十μmの領域内)に選択的に集め,散逸を防ぐ機構が必要となる.これらの機構については,どちらも長く研究されてきているが,いまだ解明されていない3–5).
上記のように機能ドメインの形成には,特定の膜タンパク質を選択的に運び,かつ,選択的に局在を維持することが求められる.このため,多様な標的膜タンパク質の識別を可能とする局在制御機構が働いていると考えられる.最近,こうした局在制御に生体膜の主要成分であるリン脂質の脂肪酸構成と,これを制御する脂肪酸リモデリングが関与するという証拠が出てきた.本稿では最近の筆者らの研究を中心に紹介する6, 7).
生体膜は,グリセロリン脂質(リン脂質)を主成分とする脂質二重層で構成されている.リン脂質は分子内に親水性頭部と2本の脂肪酸を持ち,これらがグリセロールを介して結合している.リン酸基を含む親水性頭部は結合するアルコールの有無とその種類の違いにより主なものだけで6種類以上あり,クラス多様性と呼ばれるバリエーションが存在する.これに加えて,付加される2本の脂肪酸の組合わせがさまざまに異なることにより分子種多様性と呼ばれるバリエーションも存在する8).細胞は,いったん2本の脂肪酸を持つリン脂質を合成(de novo合成)した後,膜に埋め込まれたリン脂質の一方の脂肪酸をホスホリパーゼAにより切り離し,続いてアシルトランスフェラーゼ,もしくはトランスアシラーゼにより異なる脂肪酸を付加することによりリン脂質分子の脂肪酸構成を能動的に変換する(脂肪酸リモデリング反応)9–11).脂肪酸には炭素鎖長,不飽和結合を持つ位置やその数の違いにより,多くのバリエーションが存在し,またグリセロール骨格に2か所の脂肪酸結合部位が存在するため,このリモデリング反応の結果,実に多様なリン脂質分子種バリエーションが生じることになる.この反応は酵母から動植物細胞に至る真核細胞に普遍的に認められること12),また,異なった細胞種が含有するリン脂質の分子種組成は各々に固有であって厳密に制御されていること11),などから,何らかの細胞機能が予想されるが,個々のリン脂質分子種の細胞内機能はほとんど解明されてこなかった.
3. 1-オレオイル-2-パルミトイル-ホスファチジルコリン(OPPC)が集積した膜ドメイン
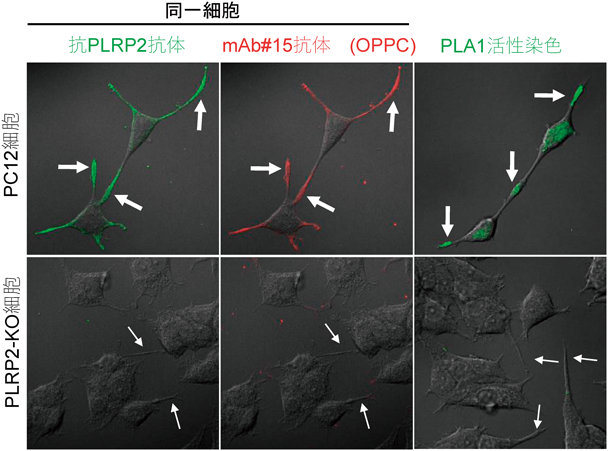
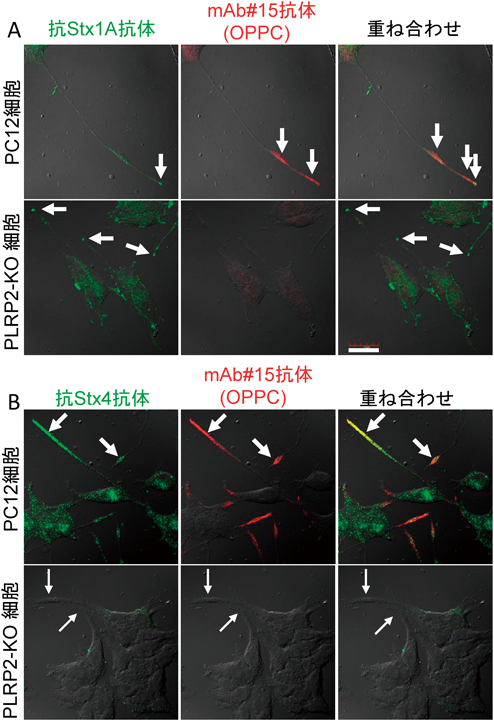
筆者らは,培養神経細胞の一種PC12細胞(ラット副腎髄質褐色細胞腫由来)を実験モデルにして,神経細胞における細胞膜機能ドメイン形成機構を解析してきた.この細胞は,増殖には神経成長因子(nerve growth factor:NGF)を必要としないが,NGFを添加すると神経突起を伸長し,その先端部にドーパミン輸送体タンパク質(dopamine transporter:DAT)等の神経シナプスの機能に関連した膜タンパク質が集積した機能ドメインを形成する6, 13).この神経突起先端部膜画分を遠心法で単離しマウスに免疫することで得られた単クローン抗体の一つ(mAb#15)は,複数の培養神経細胞種の神経突起先端部や(図2),マウス脳皮質神経における前シナプス部位の細胞膜およびその近傍の膜小胞を認識して結合する.この抗体の抗原を解析すると,当初の予想に反して,リン脂質成分を認識することが明らかになった.そこで神経突起先端部由来の膜画分から脂質を抽出し,mAb#15に対する反応性を指標にカラム精製したところ,抗原分子はsn-1位に不飽和脂肪酸オレイン酸を持ちsn-2位に飽和脂肪酸パルミチン酸を持つホスファチジルコリン(phosphatidylcholine:PC)の分子種の一つ,1-オレオイル-2-パルミトイル-PC(1-oleoyl-palmitoyl-PC:OPPC)であることがわかった.リン脂質はsn-1位に飽和脂肪酸を持ち,sn-2位に不飽和脂肪酸を持つものが多いので,その逆の構造であるまれな分子種のOPPCが神経突起先端部やシナプス部位の細胞膜に局在し,リン脂質膜ドメインを形成していることが明らかになった6).
4. pancreatic lipase related protein 2が制御するリン脂質リモデリングが作るOPPCの先端部局在
OPPCの特異な脂肪酸構造からその生成に脂肪酸リモデリングが関与することが予想された.そこで,リモデリング反応の初段を行う酵素であるホスホリパーゼA1(phospholipase A1:PLA1)とホスホリパーゼA2(PLA2)について,それぞれの酵素活性に依存して蛍光を発する試薬を用いて活性染色し,PC12細胞内の分布を解析すると,sn-1位を切断するPLA1がOPPCの局在に一致して神経突起先端部に発現していることがわかった(図2).このことから,sn-1位で起こる脂肪酸リモデリング反応によりOPPCの先端部局在が形成されることが予想された.細胞内で働くPLA2酵素については多くの研究が存在し,数多くが同定されている14).一方,細胞内に存在し,かつPCを基質にするPLA1酵素は先行研究がなかった.そこで,細胞外に分泌されて働くとされているPLA1酵素類や,各種トリアシルグリセロールリパーゼなどを含めて,PLA1活性を持つ既知の酵素15)を,免疫染色を用いてスクリーニングし,PC12細胞の神経突起においてOPPCの局在と一致する酵素がないか解析した.その結果,新生児期に特に強く膵臓から消化管に分泌されるリパーゼとして知られているpancreatic lipase related protein 2(PLRP2)15, 16)が,神経突起先端部においてOPPCの局在と一致して存在していることがわかった(図2).次に,CRISPR/Cas9法17)を用いてこの酵素の遺伝子に変異を加え,PLRP2タンパク質が消失したPC12細胞由来のPLRP2-KO細胞を作成した.この細胞では,NGF刺激に応答して神経突起伸長は起こるものの,神経突起先端におけるPLA1活性がほぼ消失した(図2).これにより,PLRP2が突起先端部に存在するPLA1活性の主要な部分を担う酵素であることがわかった.重要なことに,このPLRP2-KO細胞では,突起先端部におけるmAb#15の抗原(OPPC)が消失し(図2),かつ,神経突起膜画分におけるOPPCの存在量が有意に減少することがLC-MS解析により示された7).これにより,PC12細胞の神経突起先端部におけるOPPCの局在には,PLRP2が持つPLA1活性を介したsn-1位におけるリン脂質リモデリング反応が必要であることが明らかになった.ところで,sn-1位におけるリモデリング反応を完結してOPPCを産生するには,PLA1によるsn-1位切断の後,同じ場所にオレイン酸を付加するアシル化反応が必要となる(この場合,リモデリング前の基質はsn-2位にパルミチン酸を持つPCと仮定している).現在,この再アシル化反応の詳細は明らかでないが,興味深いことに,本来はOPPCを発現しない6),神経とは無関係のCOS7細胞(アフリカミドリザル腎線維芽細胞)やHeLa細胞(ヒト子宮頚がん細胞)にPLRP2を異所発現させると,この酵素の局在と一致してOPPCが検出されるようになる7).このことは,OPPC局在の生成には,PLRP2が決定因子であることを示すとともに,sn-1位にオレイン酸をアシル化する機構は細胞種を問わず広く存在することを示唆している.
5. ドーパミン輸送体タンパク質(DAT)機能ドメインの形成にはPLRP2が必要である
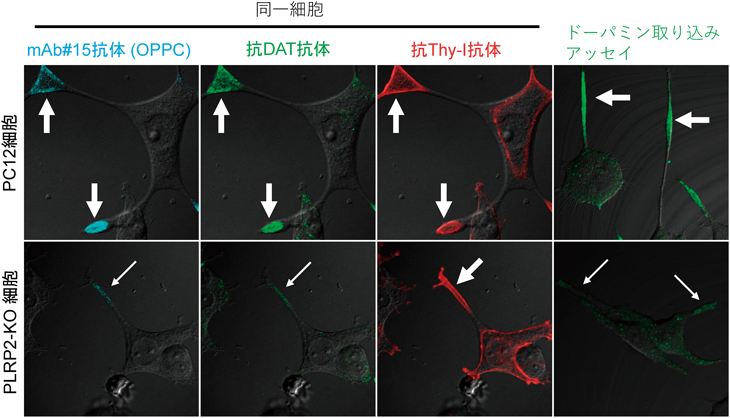
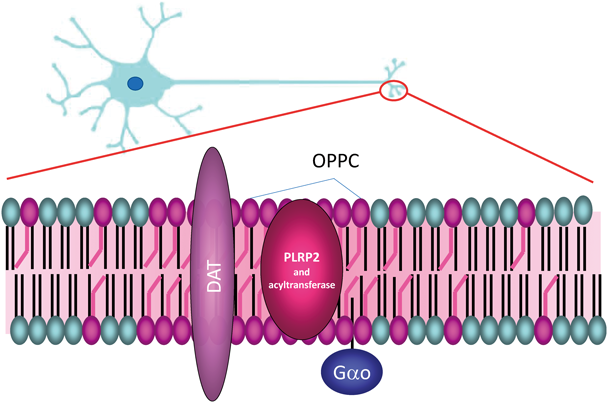
先に述べたように,PC12細胞の神経突起先端部にはドーパミン輸送体タンパク質(DAT)が局在し,機能ドメインを形成している.この膜タンパク質DATの局在と,リン脂質OPPCの局在の関係を,免疫二重染色により解析すると,OPPCとDATは突起先端部において共局在し,両者の間で蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)が検出された7).このことは,DATとOPPCが分子レベルで近傍に存在することを明らかにしている.一方,OPPCドメインが消失したPLRP2-KO細胞においては,先端部に局在していたDATは消失し,細胞のどの部位にも免疫染色で検出されなくなった.他方,膜タンパク質Thy-Iの分布には影響がみられなかった(図3).興味深いことに,元のPC12細胞とPLRP2-KO細胞の間で,細胞抽出液中のDATのタンパク質総量に変化がなかった.このことから,PLRP2-KO細胞ではDATが分散して存在していることが推定された7).さらに,DATの局在消失は,突起先端部におけるドーパミンの取り込みがPLRP2-KO細胞では消失したことからも確認された(図3)7).これらの結果により,PLRP2によって作られる神経突起先端部でのOPPCの局在が,DATやGタンパク質の同領域への選択的集積に必要なことが明らかになった(図4).
6. Syntaxin 4がOPPC膜ドメイン上に集積する
PLRP2-KO細胞においてDATが分散して存在することは,PLRP2がDATの小胞輸送にも関与することを示唆した.そこでDATの小胞輸送機構を解析するためSoluble N-ethylmaleimide-sensitive factor attachment protein receptor(SNARE)タンパク質群に注目した.SNAREタンパク質は,小胞輸送において膜の標識の役割を担う.個々の輸送小胞には,その行先ごとに異なる種類のvesicular-SNARE(v-SNARE)が細胞質側表面にSNAREドメインを突出して結合している.一方,輸送小胞が届けられるべき目的の膜領域には,固有のtarget-SNARE(t-SNARE)が,同様に細胞質側表面にSNAREドメインを突出して局在している.このv-SNAREとt-SNAREが正しい組合わせで結合するときのみ,輸送小胞と標的膜の膜融合が起こり,結果として積荷である膜タンパク質が輸送小胞から標的の膜領域に届けられる18).先行研究では,DATとt-SNAREの一種Syntaxin 1A(Stx1A)との直接的結合が報告されていた19, 20).そこで,Stx1Aを含む複数のt-SNAREタンパク質のPC12細胞神経突起における局在を,免疫染色で検討した.予想に反して,DATとOPPCは,Stx1Aではなく,別種のt-SNAREタンパク質のSyntaxin 4(Stx4)と共局在した(図5)7).一方,Stx1Aは,OPPC-DAT-Stx4が局在する領域よりも,さらに神経突起の先端部側に局在した(図5)7).重要なことに,PLRP2-KO細胞では,OPPCとDATの先端部局在が失われるとともに,Stx4の先端部局在も消失した(図5)7).一方,Stx1Aの最先端部局在は,PLRP2-KO細胞においても変化しない,もしくは,より強いものとなった(図5)7).さらに詳細に解析するため,OPPCをHRP-DABで染色し,Stx4を金コロイドで染色することにより両者を二重染色した後,電子顕微鏡により観察した.その結果,Stx4は一部の小胞と細胞膜上のOPPCが存在する領域に集積して存在することが示された7).これに加えて,Stx4とmAb#15を認識する抗体間でFRETが検出された(Stx1とmAb#15では検出されなかった)7).これらの結果,PLRP2はOPPCを介した脂質-タンパク質相互作用を介してStx4の局在を制御していることが示唆された.
7. PLRP2, Stx4とDATは同じ小胞に存在する
上記の免疫染色を用いた解析は,DATとStx4がともにOPPCから数十nmの範囲内に存在すること,細胞膜ならびに,突起先端部に内在する小胞にDATとStx4が存在し,ともにOPPC膜ドメイン上に局在することを示した.次いで,PLRP2, Stx4, DATの三者の局在を生化学的な免疫沈降法により解析した.PC12細胞とPLRP2-KO細胞から神経突起に含まれる細胞内小胞を遠心法で分離し,Stx4に対する抗体を用いて免疫沈降し,Stx4を含有する小胞にPLRP2もしくはDATが含まれるか検討した.Stx4を含む小胞は,両方の細胞から量的に変わらず回収されたが,この小胞には細胞膜に存在するThy-Iは検出されなかった.一方,このStx4を含む小胞画分には,PLRP2を発現する元の細胞を用いたときのみ,DATとPLRP2が検出され,PLRP2-KO細胞からは,DATもPLRP2も検出されなかった7).このことから,PLRP2, Stx4, DATの三者が,PC12細胞において同じ小胞に存在していること,また,その形成にはPLRP2が必要であることが示された.この結果はPLRP2がDATの輸送小胞の形成にも関与していることを示唆している.
8. OPPCの脂肪酸構造をStx4の膜貫通ドメインが認識することにより細胞膜上のStx4の局在位置が決められる
上記の結果は,OPPC膜ドメインが,その特異な脂肪酸構造を介した脂質-タンパク質相互作用によりStx4の局在を制御することを示唆している.脂質二重膜内部に埋もれた脂肪酸部の構造を認識するのは膜タンパク質の膜貫通領域(transmembrane domain:TMD)であると予想された.幸い,Stx1AとStx4はどちらも,そのカルボキシ末端に1か所だけTMDを持つ18).そこで,この二つのSNAREタンパク質が持つTMDの局在決定における役割を解析するため,蛍光タンパク質mCherryのカルボキシ末端にそれぞれStx1AとStx4由来のTMDを結合した融合レポータータンパク質,mCherry-TMD(Stx1A)とmCherry-TMD(Stx4)を作製した.mCherry-TMD(Stx1A)を発現させると,PLRP2の発現の有無にかかわらず,元のStx1Aタンパク質と同じように神経突起の最先端部に局在した7).一方,mCherry-TMD(Stx4)は,元のPC12細胞では突起先端に局在したが,PLRP2-KO細胞では細胞全体に拡散して存在した7).さらに,mAb#15とmCherry-TMD(Stx4)との間でFRETが検出された[mCherry-TMD(Stx1A)とmAb#15では検出されなかった]7).またStx4のTMD中に存在する290番目のアミノ酸IleをPheに置換した変異体mCherry-TMD(Stx4 290IF)は突起先端への局在能を失うことも示された7).以上の結果は,Stx1AとStx4はともに,その膜貫通領域が細胞膜上の局在位置を決めていること,Stx4の神経突起先端部局在は,その膜貫通領域とリン脂質OPPCの間でのアミノ酸配列特異的なタンパク質–脂質相互作用が決定要因であることを明らかにした.
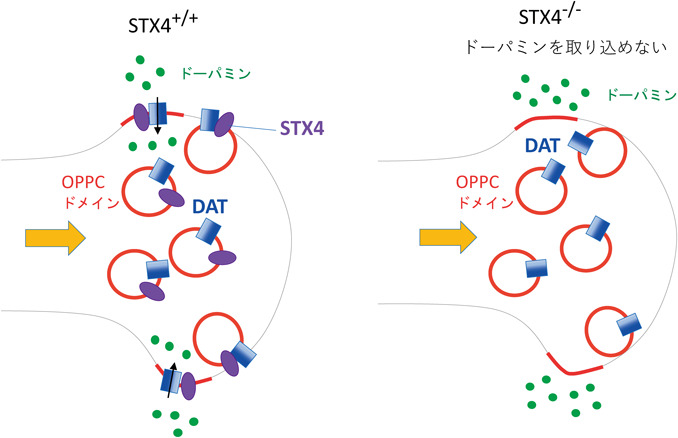
以上の結果は,DATとStx4ともに,神経突起先端部局在にはPLRP2が必要であることを示している.逆に,Stx4のPLRP2やDATの局在における役割を解析するため,stx4遺伝子をCRISPR/Cas9法17)で破壊したStx4-KO細胞を次に作製した7).この細胞では,Stx4タンパク質は検出されなくなるが,NGF刺激に応答した神経突起伸長には影響が認められなかった7).また,Stx4-KO細胞は,OPPCの突起先端部局在は変わらず認められた7).このことは,Stx4はPLRP2の先端部局在に必要でないことを示している.驚いたことに,このStx4-KO細胞では,DATの先端部局在が元のPC12細胞より強く検出された.一方,突起先端部におけるドーパミンの取り込みは元のPC12に比較して35%に減少していた7).表面タンパク質のビオチン化アッセイ21)を用いてDATの細胞表面露出を検討すると,元のPC12細胞に比較して37%に減少していた7).これらの結果より,Stx4が欠損すると,DATは輸送小胞のOPPCドメインに載って突起先端部まで輸送されるが,細胞表面に出ることができず,ドーパミンを取り込めないと示唆された(図6).
10. PLRP2とStx4がDATの細胞膜局在を決める主要因子である.
以上の結果は,PLRP2とStx4の両者ともDATの細胞膜局在に必要であることを示している.逆に,この二つのタンパク質がその局在制御に十分かどうか検討するため,PLRP2, Stx4, DATのすべてを本来発現しないCOS7細胞にDATを発現させた.この実験系では,細胞に普遍的な膜タンパク質局在制御機構は存在するが,神経細胞に特異的な機構は存在しないと考えられる.この細胞にPLRP2とStx4をさまざまな組合わせで発現し,DATの細胞膜局在を解析した.その結果,PLRP2とStx4をともに発現したときのみ,COS7細胞が作る突起の先端に強くDATが検出された.このことは,DATが集積する膜領域を作るのには,PLRP2とStx4の共発現が制御因子として必要であり,かつ,十分であることを示唆している.さらに,DATを単独で発現させたときに比べて,PLRP2とStx4をともに発現したときは9倍のドーパミンの取り込みがみられた7).以上の結果は,PLRP2とStx4が,DATの細胞膜局在を決める主要因子であることを明らかにした.
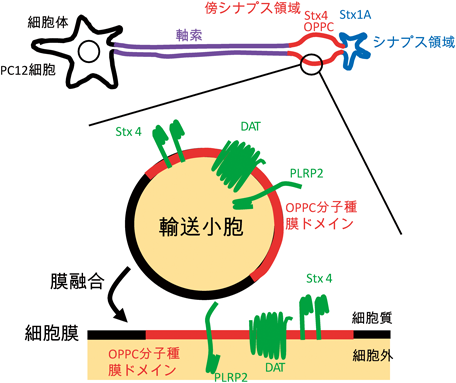
本稿では,PLA1(PLRP2)が制御する局所的なリン脂質リモデリングにより,細胞膜機能ドメインが形成される事例を紹介した.PC12細胞の神経突起先端部では,脂肪酸リモデリングにより生じる特定のリン脂質分子種(OPPC)の局在が,脂質–タンパク質相互作用を介して膜タンパク質DATやStx4を領域内にとどめる.さらに,こうして局在化されるt-SNARE(Stx4)が標的膜タンパク質(DAT, Stx4, PLRP2自身を含む)を載せた輸送小胞の膜融合を促し,目的の機能を担う一群の膜タンパク質が集積した機能ドメインが形成されるものと考えられる(図7).
本研究により,小胞輸送と,細胞表面における機能ドメイン形成との連携機構の一部が明らかになった.加えて,両者の因果関係も明確にされた.PLRP2はStx4の局在に必要であるが,Stx4はPLRP2の局在に必要でないので,PLRP2の局在が何らかの機構で先に作られ,その後,Stx4を含めた他の標的タンパク質の局在化が起こると考えられる.したがって,今後,PLRP2の局在化機構の解析が,上記膜機能ドメインの形成機構解明に重要であると考えられる.また,本研究で解析したStx1AとStx4以外にも,多種のt-SNAREが細胞膜上の限局した領域や細胞内小器官に局在し,膜タンパク質の選別輸送に関わっている18).こうした各種t-SNAREの局在における,脂質分子種の関与やリン脂質リモデリングの関与を順次解析することにより,膜タンパク質局在制御における脂質の役割が,系統的に解明されうると期待している.
本研究のもう一つの成果は,選択的な膜タンパク質局在化機構の一つを明らかにした点である.上記の機構は,神経細胞の機能ドメインが持つ選択的な特徴と一致する5)のみならず,細胞内における膜タンパク質の局在化や選別輸送にも広く適用できる可能性がある.生体は,構造の異なる各種の脂肪酸を食物から取り込み,かつ,体内で合成し,さらに,脂肪酸リモデリングを通じて,膜リン脂質が持つ脂肪酸構成の多様なバリエーションを形成している.OPPC以外の多くのリン脂質分子種が,同様に,膜ドメイン形成や膜タンパク質の局在制御に関わっているかどうかは現在未解明であるが,本研究結果は,今後さらに,各種ホスホリパーゼAの細胞内局在,個々のリン脂質分子種の細胞内動態,膜タンパク質と特定のリン脂質分子種の会合等を解析する意義を示している.
引用文献References
1) Singer, S.J. & Nicolson, G.L. (1972) The fluid mosaic model of the structure of cell membranes. Science, 175, 720–731.
2) Jacobson, K., Ishihara, A., & Inman, R. (1987) Lateral diffusion of proteins in membranes. Annu. Rev. Physiol., 49, 163–175.
3) Winckler, B. & Poo, M. (1996) No Diffusion Barrier at Axon Hillock. Nature, 379, 213.
4) Winckler, B., Forscher, P., & Mellman, I. (1999) A Diffusion Barrier Maintains Distribution of Membrane Proteins in Polarized Neurons. Nature, 397, 698–701.
5) Fukano, T., Hama, H., & Miyawaki, A. (2004) Similar diffusibility of membrane proteins across the axon-soma and dendrite-soma boundaries revealed by a novel FRAP technique. J. Struct. Biol., 147, 12–18.
6) Kuge, H., Akahori, K., Yagyu, K., & Honke, K. (2014) Functional compartmentalization of the plasma membrane of neurons by a unique acyl chain composition of phospholipids. J. Biol. Chem., 289, 26783–26793.
7) Kuge, H, Miyamoto, I., Yagyu, K. & Honke, K. (2020) PLRP2 selectively localizes synaptic membrane proteins via acyl-chain remodeling of phospholipids. J. Lipid. Res. in press, doi: 10.1194/jlr.RA120001087
8) Hermansson, M., Hokynar, K., & Somerharju , P. (2011) Mechanisms of glycerophospholipid homeostasis in mammalian cells. Prog. Lipid Res., 50, 240–257.
9) Lands, W. (1958) Metabolism of glycerolipides; a comparison of lecithin and triglyceride synthesis. J. Biol. Chem., 231, 883–889.
10) Shindou, H., Hishikawa, D., Harayama, T., Yuki, K., & Shimizu, T. (2009) Recent progress on acyl CoA: lysophospholipid acyltransferase research. J. Lipid Res., 50(Suppl), S46–S51.
11) Yamashita, A., Hayashi, Y., Nemoto-sasaki, Y., Ito, M., Oka, S., Tanikawa, T., Waku, K., & Sugiura, T. (2014) Acyltransferases and transacylases that determine the fatty acid composition of glycerolipids and the metabolism of bioactive lipid mediators in mammalian cells and model organisms. Prog. Lipid Res., 53, 18–81.
12) Patton-Vogt, J. & de Kroon, A.I.P.M. (2020) Phospholipid turnover and acyl chain remodeling in the yeast ER. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1865, 158462.
13) Kadota, T., Yamaai, T., Saito, Y., Akita, Y., Kawashima, S., Moroi, K., Inagaki, N., & Kadota, K. (1996) Expression of dopamine transporter at the tips of growing neurites of PC12 cells. J. Histochem. Cytochem., 44, 989–996.
14) Murakami, M., Nakatani, Y., Atsumi, G.I., Inoue, K., & Kudo, I. (2017) Regulatory Functions of Phospholipase A2. Crit. Rev. Immunol., 37, 121–179.
15) Aoki, J., Inoue, A., Makide, K., Saiki, N., & Arai, H. (2007) Structure and function of extracellular phospholipase A1 belonging to the pancreatic lipase gene family. Biochimie, 89, 197–204.
16) Lowe, M.E. (2000) Properties and function of pancreatic lipase related protein 2. Biochimie, 82, 997–1004.
17) Sanjana, N.E., Shalem, O., & Zhang, F. (2014) Improved vectors and genome-wide libraries for CRISPR screening. Nat. Methods, 11, 783–784.
18) Jahn, R. & Scheller, R.H. (2006) SNAREs—engines for membrane fusion. Nat. Rev. Mol. Cell Biol., 7, 631–643.
19) Lee, K.H., Kim, M.Y., Kim, D.H., & Lee, Y.S. (2004) Syntaxin 1A and receptor for activated C kinase interact with the N-terminal region of human dopamine transporter. Neurochem. Res., 29, 1405–1409.
20) Cervinski, M.A., Foster, J.D., & Vaughan, R.A. (2010) Syntaxin 1A regulates dopamine transporter activity, phosphorylation and surface expression. Neuroscience, 170, 408–416.
21) Witting, S.R., Maiorano, J.N., & Davidson, W.S. (2003) Ceramide enhances cholesterol efflux to apolipoprotein A-I by increasing the cell surface presence of ATP-binding cassette transporter A1. J. Biol. Chem., 278, 40121–40127.
著者紹介Author Profile
 久下 英明(くげ ひであき)
久下 英明(くげ ひであき)高知大学医学部生化学教室助教.博士(理学).
略歴1988年大阪大学理学部卒業.93年同大学院理学研究科後期課程生物化学専攻修了.同年米国ウースター医学生物学研究所博士特別研究員~研究員.97年より現職.
研究テーマ脂質生化学による細胞生物学.
抱負脂肪酸の多様性とリン脂質分子種が担う細胞機能を,広く明らかにしていきたい.
ウェブサイトhttp://www.kochi-ms.ac.jp/~ff_bichm/
趣味四季の草花いじり.
 本家 孝一(ほんけ こういち)
本家 孝一(ほんけ こういち)高知大学理事・副学長.博士(医学).
略歴1983年北海道大学医学部卒業.86年北海道大学助手.99年大阪大学助教授.2003年高知医科大学教授.18年より現職.
研究テーマ膜マイクロドメインの生合成と機能,硫酸化糖鎖の機能.
抱負化学物質と生き物の境界を知りたい.
ウェブサイトhttp://www.kochi-ms.ac.jp/~ff_bichm/
趣味高知の酒と山海の味覚を楽しむこと.