生体は250種類以上にも及ぶ細胞で構成されており,それぞれの細胞が相互にコミュニケーションをとりながら社会を形成している.コミュニケーションの手段は多数あり,細胞どうしが直接接触することもあれば,タンパク質や小胞など液性因子を放出し近隣や遠隔地にいる細胞に情報を伝達することもある.そして,細胞自体が目的の細胞の近くまで移動し,これらのコミュニケーションを行うことでより効果的に生命活動を維持することができる.その典型例は免疫系である.たとえば,微生物の感染により体内に異常が生じると,まず全身をくまなく巡回している好中球やマクロファージなどの免疫細胞がその感染局所に集積し,続いてリンパ球など他の免疫細胞が集まってくる.そして,これらの免疫細胞が情報交換しながら炎症応答を惹起することにより,速やかに組織恒常性が取り戻される.このように,正常な生体反応が誘導されるためには,各細胞が適切な場所に適切なタイミングで移動し,活動拠点を正確に定めることが重要である.もし必要な細胞が必要なタイミングで存在しない場合,病的な状態へとつながる可能性がある.上記の例でいえば,免疫系がうまく働かず感染が全身にまで拡大するか,あるいは,過剰な炎症応答により組織破壊が進行する可能性が考えられる.そこで,“各細胞がいつどのように移動し、そこでどのような振る舞いをするのか”という細胞の時空間的な動態を調べる研究が生命活動の本質を理解する上で必要とされる.
我々はこれまでに,生体イメージング技術を独自に開発することにより,生きた組織内で繰り広げられる細胞の多彩な生命活動の一部始終を可視化することに成功してきた.本稿では,①脂肪組織における炎症性細胞の動態,②生体組織におけるがん細胞の動態,③骨組織における破骨細胞の動態,以上三つの研究事例を紹介しながら生体イメージング技術を駆使した細胞動態研究について解説する.
1)細胞動態研究における生体イメージングの利点
従来の研究では,細胞の動態や局在変化,細胞どうしの相互作用を調べるために,組織切片や細胞・組織培養系を活用した解析が主に行われてきた.組織切片を用いた解析では,細胞の種類や数,局在,形態,機能的分子の発現などをある程度解析することができる.しかし,“固定”した組織を切片にして解析を行うため,細胞の瞬間的な状態を評価しているにすぎず,“動き”や“状態変化”という時間軸を含む動態情報は得られない.それに対して,培養系を用いた解析では,生体組織から取り出した組織や細胞を培養することで“生きた”細胞の動態を捉えることができる.実際に,体内から摘出したリンパ節を培養条件下に置き,免疫細胞の動きや細胞間相互作用をリアルタイム観察した研究などがある1, 2).しかしながら,生体内のような複雑な環境を培養ディッシュ上で再現するのは困難である.特に,培養系では血管からの影響をある程度再現できても,血流は流れていないため血流を介した細胞への影響は再現できない.このように,培養系を用いて細胞動態解析を行う際には,解析対象に対して必要な条件を満たした環境を作り出せているかを注意する必要がある.以上のことから,細胞の動態を基軸とした生命現象を解明するには,個体を生かした状態で生体内のありのままのようすを観察・解析する方法が一番有効である.生体イメージングはまさにこの要望に応える実験技術であり,近年生体イメージングを活用した細胞動態研究が増えてきている.
2)生体イメージングの原理
生体イメージングで使用する2光子励起顕微鏡は蛍光顕微鏡の一種であり,注目する細胞や分子を蛍光物質で標識することで可視化することができる.2光子励起顕微鏡の最大の特性は,解析対象の組織が表皮や皮膜に包まれた場合においても標本の深部を観察できる点があげられる.この特性を実現する2光子励起顕微鏡の原理的な特徴をまとめると,以下のようになる.
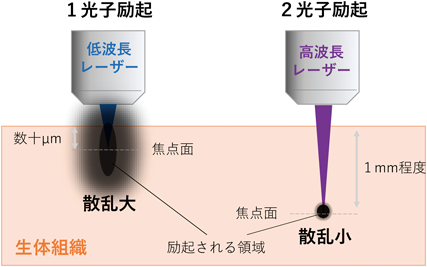
①組織透過性の高い近赤外光を励起に用いるため,内部散乱の影響を受けにくく,標本深部で蛍光励起を起こすことができる(図1):2光子励起顕微鏡では,1光子励起とは違って,その名前のとおり,2個の光子を蛍光分子に同時に当てて励起させる.2個の光子による励起では,光子1個分のエネルギーが1光子励起の約半分で済む.そのため,2光子励起ではエネルギーが約半分である長波長域の光(一般的には,波長が780~1000 nmの近赤外光)を使用する.このような波長の長い近赤外光は,物質に衝突することで生じる光散乱が少なく,物質透過性が高いため,組織の深部まで到達することができる.どの程度の深さまで観察できるかは臓器によって異なるが,脳などの軟部組織では最大1.5 mm程度まで観察することができる.
②高エネルギー密度の焦点付近以外は励起されないため,空間解像度に優れ,組織の侵襲性が低い(図1):2個の光子による励起は自然界ではきわめて起こりにくい現象であるが,光学技術の発展により顕微観察環境下では光子密度が空間的に高くなる焦点付近で容易に起こすことができる.逆にいえば,焦点面でしか,2光子励起は起こらない.そのため,観察している焦点面以外からの蛍光は一切漏れ込まず,解像度の高い像が得られる.さらに,焦点面でしか励起が起こらないので,周囲の非観察細胞に対する余分な励起がなく,細胞への光毒性や蛍光退色を抑えることができる.
3)生体イメージングによってわかることとその可視化方法
これまで生体イメージングの利点として生理的な環境下で細胞の“動き”を解析できる点に焦点を当てて述べてきたが,さまざまなバイオセンサー型蛍光プローブの開発・普及により,今や細胞の“状態”や“機能”まで可視化することができるようになってきた.たとえば,細胞内のシグナル伝達や細胞周期,細胞内イオン濃度,細胞内ATP濃度などを定量的に可視化することができる.その他,生体イメージングで見えること・わかることについて表1にまとめたので,参照していただきたい.
表1 生体イメージングに見えること・わかること| 見えること | わかること |
|---|
| 細胞の動きに関する情報 | 移動方向,移動速度,移動距離,形態変化など |
| 細胞間相互作用 | 接触回数,接触時間,細胞外小胞やエクソソームを介した情報伝達など |
| 細胞の状態・細胞内情報 | イオン濃度,シグナル伝達,細胞死シグナル,ATP濃度,細胞周期など |
蛍光プローブには,フルオレセインやローダミンのような低分子化学蛍光プローブと緑色蛍光タンパク質(GFP)などの蛍光タンパク質型の蛍光プローブの2種類がある.化学蛍光プローブで作られたバイオセンサーとしては,カルシウムイオン濃度を感知するFura-2やFura-3が有名であるが,この他にも種々のイオン濃度,pH,膜電位,細胞内レドックスなどを感知するものがある.
蛍光タンパク質型のバイオセンサーの多くは,蛍光共鳴エネルギー移動(fluorescent resonance energy transfer:FRET)現象に基づいて設計されている.FRET現象とは,たとえば,シアン色の蛍光タンパク質CFP(ドナー)と黄色の蛍光タンパク質YFP(アクセプター)が近接しているとき,CFPを励起した際に生じる蛍光のエネルギーによってYFPが励起される現象のことである.つまり,CFPの励起によりYFPの蛍光が発生する.このFRET現象が起こる効率は二つの蛍光分子間の距離に依存する.この性質を利用して,シグナル伝達やイオン濃度などを計測することができる.たとえば,リン酸化やイオンの結合により分子が構造変化を起こしてその両端が近接する場合,その分子の両端に蛍光分子を結合させておくことで,構造変化に伴ってFRET現象が観測される.このようにして,FRET効率をもとにシグナル伝達分子のリン酸化(活性化)やイオンの存在量を計測することが可能になる.これまでに,FRET現象を利用したバイオセンサーとして,カルシウムイオン濃度を感知するChameleonや,カスパーゼ3の活性を感知するアポトーシス可視化プローブSCAT, ATP濃度を感知するATeam,などが開発されている.
化学蛍光プローブを使用する際の注意点として,プローブを生体内の目的の細胞や目的の場所に特異的に導入するのが難しい点がある.多くの場合は,プローブを適切な官能基で修飾することでこの問題を克服することができるが,生物化学系や有機化学系の高度な専門知識が必要となる.一方,蛍光タンパク質型のバイオセンサーは,標的細胞のマーカー分子のプロモーター下に遺伝子導入することができるため,化学蛍光プローブとは異なり,細胞特異的にプローブを発現させやすい.
3. 脂肪組織の生体イメージングで明らかになった肥満時の炎症の実態
1)肥満に伴う脂肪組織内のマクロファージの動態変化
生活習慣病の一種である肥満症では脂肪組織内に慢性的な炎症がみられる.従来の研究により,肥満の進行過程でマクロファージなどの免疫系細胞が脂肪組織内に浸潤し,病態の形成・増悪に関与していることが報告されていた3).しかしながら,マクロファージの動態が病態進展に伴いどのように変化するのかは不明であった.そこで我々は,肥満を誘導してから病態が成熟するまでの脂肪組織内のマクロファージの動態を経時的に調べた4).
まず,肥満症の病態が発症・成熟するまでのタイムコースを明らかにするために,マウスに高脂肪食を与えて,脂肪組織内の炎症性細胞数,脂肪細胞サイズ,マウスの体重,血中グルコース濃度を経時的に解析した.その結果,高脂肪食を与えて1週間ではこれらのパラメータに変化がみられなかったが,8週目にようやく炎症性細胞の増大,体重増加,血中グルコース濃度の上昇(インスリン抵抗性の発生),脂肪細胞の肥大化がみられた.このことから,高脂肪食摂取1週目では炎症は起こっておらず,高脂肪食摂取8週目で過剰な炎症が起こり,肥満症が成熟していることが示唆された.
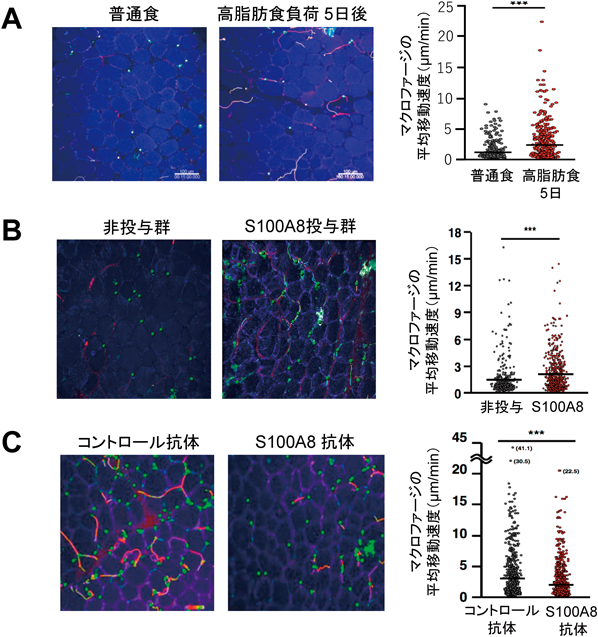
次に,生体イメージング技術を活用して,肥満の進行に伴う脂肪組織内のマクロファージの動態を経時的に解析した.具体的には,マクロファージを緑色で蛍光標識したマウス(LysM-GFPマウス)の精巣上脂肪を体外に露出させ,2光子励起顕微鏡を用いて脂肪組織内を観察した.その結果,健常マウスでは脂肪組織に存在するマクロファージの数が少なく,動きがほとんどないのに対して,高脂肪食を与えて5日目から多くの炎症性マクロファージが脂肪組織に浸潤し,組織内を活発に動き回っているようすがみられた(図2A).以上の結果から,高脂肪食を与えて5日目の早期では肥満症の病態が発生していないにもかかわらず,すでにマクロファージが活発に動いており,脂肪組織への出入りを繰り返していることが明らかになった.
2)肥満脂肪組織における炎症トリガー分子S100A8の同定と機能の解明
脂肪組織の炎症において,CCL2やCCL3などのケモカインがマクロファージの遊走に関与することが報告されていた5, 6).実際に,高脂肪食を与えて8週目ではこれらのケモカインの発現量が増大していた.その一方で,高脂肪食を与えて5日目では,マクロファージの動きが活発であり,組織内への浸潤も確認されたにもかかわらず,これらのケモカインの発現量は健常時と比較して変化していなかった4).この結果を受けて我々は,脂肪組織の炎症初期では異なるマクロファージ遊走制御因子が作用していると考えた.そこで,マクロファージの遊走に影響を与えることが知られる分子を網羅的に探索し,高脂肪食を与えて5日目で発現が上昇する分子として,S100A8を新たに同定した.
続いて,このS100A8がマクロファージの動態ひいては機能に与える影響について解析を行った.通常食を摂取したマウスにS100A8を脂肪組織内に投与すると,脂肪組織内のマクロファージの動きが活発になり遊走が促進された(図2B).また,S100A8がマクロファージに作用することによって,マクロファージにおける炎症性サイトカイン(TNF-α)やケモカイン(CCL2)の発現が誘導され,炎症応答のトリガーとして働くことも明らかになった.反対に,高脂肪食を与えたマウスにS100A8の中和抗体を投与すると,マクロファージの遊走が抑制された(図2C).さらにS100A8中和抗体を投与し続けた結果,慢性炎症を軽減し肥満症におけるインスリン抵抗性を改善することができた.
4. 生体イメージングで明らかになったがん細胞浸潤メカニズムの解明
1)がん細胞の細胞周期と細胞運動性・浸潤性の関係性解明
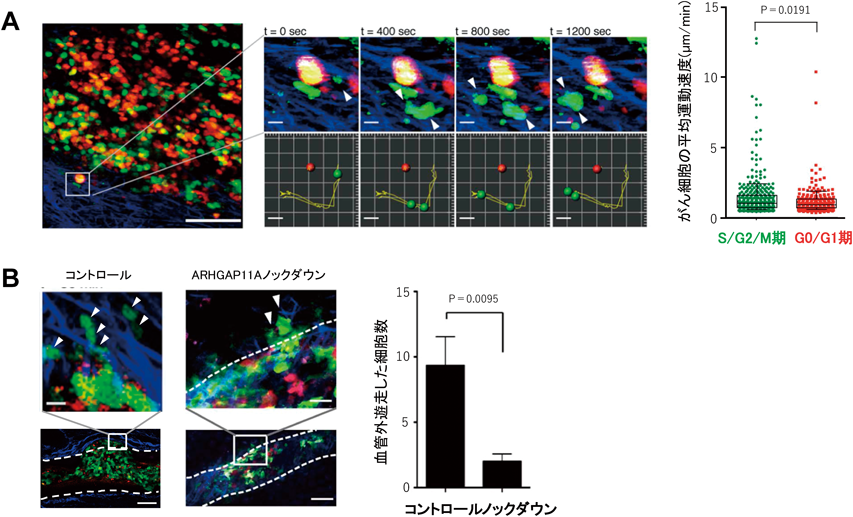
がん細胞の特徴的な性質として,制御不能な細胞増殖と活発な運動性があげられる.この性質により,がん細胞は組織局所で細胞増殖を絶えず繰り返し,周囲の組織構造を破壊しながら血管やリンパ管へと浸潤していく7).そして,血液やリンパ液の流れに乗って遠隔組織へ転移し,積極的に血管・リンパ管の外に出て,新天地で同様の活動を繰り返す.このようなシェーマが広く受け入れられている一方で,がん細胞における細胞周期と運動性の関係性については不明な点が多く残されていた.特に,生きた動物の体内におけるがん細胞の細胞周期と運動性の実態について詳細に調べた研究はなかった.そこで我々は,がん細胞の細胞周期と動きを生体内で同時に可視化する生体イメージング系の確立を試みた8).まず,細胞周期を可視化するために,fluorescent ubiquitination-based cell cycle indicators(Fucci)システムを用いた9).このシステムではS/G2/M期に発現するGemininが緑色で,G0/G1期に発現するCdt1が赤色で蛍光標識されている.すなわち,色調によって細胞周期のステップを把握することができる仕組みである.このFucciを浸潤性大腸がん細胞株HCT116に形質導入し,その細胞株をマウスの皮下に移植することで大腸がんモデルマウスを作製した.このモデルマウスに生じた腫瘍を生体イメージングにより観察したところ,がん浸潤の先端領域にはS/G2/M期を示す緑色の細胞が多く存在した.さらに,がん細胞の動態の観察を続けたところ,がん細胞は腫瘍から正常な組織に向かって進展するように動き,少数の細胞が腫瘍を取り巻く間質領域に飛び込むような動きを見せた(図3A左).興味深いことに,このような動きを示す細胞はすべて緑色であった.このことから,がん細胞の浸潤性の運動は細胞周期に依存することが示唆された.また,がん細胞の動きを細胞周期のステージごとに解析した結果,S/G2/M期の細胞はG0/G1期に比べて運動速度が有意に高いことが明らかになった(図3A右).
2)細胞周期依存的に発現するがん細胞運動の制御因子Arhgap11aの同定
細胞周期依存的ながん細胞運動の制御機構を明らかにするために,Fucciを発現するがん細胞を生体内の腫瘍から取り出し,細胞周期ごとに分離して網羅的遺伝子発現解析を行った.G0/G1期細胞群とS/G2/M期細胞群の間で発現差が有意に大きな遺伝子群をGene Ontology解析にかけ,その結果から細胞運動に関連する遺伝子を抽出した.そして,それぞれの遺伝子の発現を確認した結果,Rho GTPase-activating proteinであるArhgap11aがS/G2/M期の細胞において有意に発現上昇していることを見いだした.
このArhgap11aががん細胞の運動能に影響していることを確認するために,Arhgap11aに対するsmall hairpin RNA(shRNA)をHCT116細胞株に発現させて,Arhgap11aのタンパク質発現レベルを低下させたノックダウン細胞株を作製した.この細胞株を用いて,まずはin vitroで細胞増殖能を確認したところ,コントロール細胞とノックダウン細胞の間で差はみられず,Arhgap11aは細胞の増殖能には影響を与えないことが明らかになった.一方,Matrigelプレートを用いてin vitroで細胞浸潤アッセイを行ったところ,ノックダウン細胞では,コントロール細胞に比べて有意な浸潤能の低下がみられた.
続いて,Arhgap11aの発現抑制がin vivoにおいてもがん細胞の運動・浸潤能を低下させることを確認するために,ノックダウン細胞をマウスの皮下に移植して,生体イメージング解析により細胞の運動速度を計測した.その結果,in vivoにおいてもノックダウン細胞では運動速度の低下がみられ,Arhgap11aががん細胞の運動能を制御していることが明らかとなった.さらに,血管内に存在するがん細胞が血管外への遊出するようすを観察したところ,ノックダウン細胞では,その数がコントロール細胞と比較して有意に少なかった(図3B).また,がん細胞移植後の腫瘍サイズの変化について経時的に調べた結果,ノックダウン細胞を移植した場合には,コントロール細胞を移植した場合よりも腫瘍サイズの増大が有意に遅延することも明らかになった.以上の結果から,がん細胞の運動能は他組織への浸潤・転移に関わる以外にも,腫瘍サイズの増大にも影響を与えることが示唆された.
5. 骨組織の生体イメージングで明らかになった骨リモデリングの制御機構
1)生体イメージングによる骨組織内細胞の可視化
骨は動物の身体を支えるきわめて重要な組織である.そのため,老朽化してもろくならないように骨は常に新しく生まれ変わる.骨の再構築は,破骨細胞が古い骨を溶かすことで始まる.その後,骨芽細胞が新しい骨を造り,溶かされた部分を完全に補填する.この一連のサイクルが繰り返されることで骨量が維持され,常に新鮮な状態が保たれる.この骨の再構築のことを骨リモデリングと呼ぶ.骨組織内には破骨細胞と骨芽細胞の他にも免疫系細胞や間葉系細胞などが存在しており,これらの細胞もまた破骨細胞や骨芽細胞に作用することで骨リモデリングを精緻に制御していると考えられている.
我々はこれまでに,骨組織の生体イメージング技術を独自に開発し,10年以上にもわたって骨組織内のさまざまな細胞の観察・解析を行ってきた.骨組織内を観察するには,励起光が骨基質を通過し深部に到達することが必須であるが,骨基質に含まれるリン酸カルシウム結晶は励起光を容易に散乱させてしまうため,2光子励起用の長波長レーザーを用いても難しかった.そこで我々は,骨基質が比較的薄い頭頂骨で観察を行うことで,生きた骨組織内を非侵襲的に高解像度で可視化することに成功した.そして,この独自に開発した生体イメージング系を駆使して,生きた骨組織内の破骨細胞,骨芽細胞,免疫系細胞の動態の可視化を実現した(図4).
2)破骨細胞の動態解析により明らかになった骨代謝制御機構
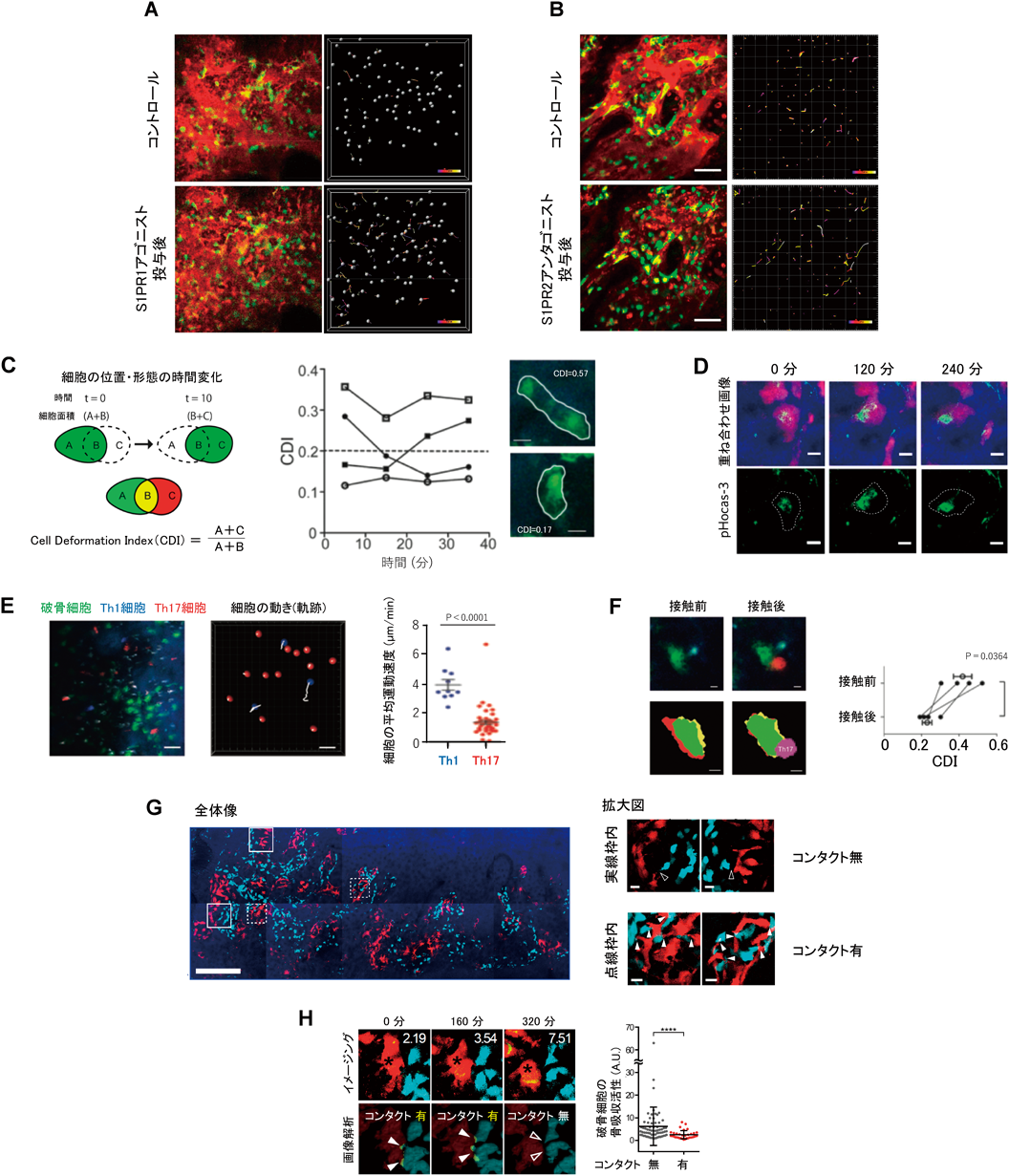
破骨細胞は単球・マクロファージ系の前駆細胞から分化・成熟することで発生し,骨を吸収するという特異な機能を獲得する10).そして,破骨細胞は古い骨を壊しながら骨芽細胞に新しい骨を作るよう指示を与え,新鮮で頑丈な骨構造を再構築させる.この骨リモデリングを正常に維持・管理するには,破骨細胞の数を適切に保つことが重要であり,破骨前駆細胞が骨組織内に適切なタイミングで流入し,適切な場所に移動する必要がある.我々は,生体イメージングを活用した解析により,破骨前駆細胞を骨表面にリクルートするために必要な因子としてスフィンゴシン1-リン酸(S1P)を特定した11).S1Pは骨髄腔内の血中に豊富に存在しており,破骨前駆細胞は細胞膜表面に発現するS1P 1型受容体(S1PR1)を介して,骨組織内に引き寄せられる(図4A).一方,破骨前駆細胞を骨組織内から遠ざける機構も存在することがわかった12).破骨細胞の数が増えすぎると,骨の破壊と形成のバランスが崩れ,時として深刻な事態を招く.たとえば,骨吸収が亢進する病態として骨粗鬆症などがある.このような事態を避けるために,破骨前駆細胞にはS1Pから遠ざかる動きを誘導するS1P 2型受容体(S1PR2)も発現する(図4B).破骨前駆細胞はこれら2種類の受容体を適宜使い分けて骨組織内への出入りを制御し,骨組織内の破骨細胞の数を適切に管理していることが明らかとなった.
さらに,骨表面に存在する成熟破骨細胞に焦点を当てたライブイメージング解析により,成熟破骨細胞の動きや形態変化,さらには機能状態を調べた13).そのためにまず,我々は,破骨細胞の動きとそれに伴う形態変化を評価する指標として,Cell Deformation Index(CDI)を開発した(図4C左).このCDIをそれぞれの破骨細胞に適用して経時的に計測したところ,絶えずCDIを変化させている細胞もいれば,ほとんど変化しない細胞も存在することがわかった(図4C右).また,我々は,破骨細胞がH+ポンプを介して酸を放出することで骨を溶かすことに着目して,この機能を実際に生体内で可視化するため,骨表面のヒドロキシアパタイトに吸着するpH応答性蛍光プローブ(pH-activatable fluorescent probe for osteoclast activity sensing:pHocas-3)を開発した(図4D)14).このプローブは,破骨細胞が酸を出し骨表面が酸性化されると,蛍光がオンになる仕組みになっている.破骨細胞を可視化するマウスにこのプローブを投与し,破骨細胞による酸の放出をライブイメージング解析したところ,破骨細胞による骨吸収活動はCDI,すなわち細胞の動きと相関関係を示すことが明らかになった13).つまり,アメーバ様に動き回っているCDIが高い破骨細胞では酸の放出レベルが低く,逆に,静止しているCDIが低い破骨細胞では,CDIが高い細胞に比べて約4倍以上も酸を放出して活発に骨吸収を行っていることが明らかになった.以上のことから,破骨細胞は常に骨吸収を行っているわけではなく,骨吸収期と休止期を数十分のタイムスパンで絶えず切り替えていることが示唆された.
3)破骨細胞機能を制御する細胞動態ネットワークの解明
骨組織内には多種多様な細胞が存在し,それらが複雑に相互作用をすることで骨組織の恒常性ひいては正常な骨構造が維持されている.我々は,骨組織内のさまざまな細胞を同時に可視化することに成功し,破骨細胞の骨吸収活性が他の細胞によってどのように制御されているかを次々と明らかにしている.
RANKL(receptor activator of nuclear factor kappa-B ligand)は破骨細胞の骨吸収活性を促進する強力な因子として知られる.骨髄内において,骨芽細胞,骨細胞,ストローマ細胞がこのRANKLを発現することが知られており,これらの細胞によるRANKL刺激が破骨細胞の骨吸収活性状態を主に制御していると考えられていた15, 16).その一方で,Tリンパ球をはじめとしたさまざまな免疫系細胞にもRANKLが発現することが見いだされていた17, 18).免疫系細胞は骨髄内にもたくさん存在しているため,免疫系細胞からのRANKL刺激もまた破骨細胞の活性状態に影響することが予想されたが,その詳細は不明であった.そこで,RANKLを発現し関節炎における破骨細胞の活性化に関与することが示唆されていたTh17細胞を中心に,Tリンパ球による破骨細胞の活性化制御について生体イメージング技術を活用して調べた13).その結果,Th1細胞は組織内を自由に動き回っているのに対して,Th17細胞は破骨細胞に接触しほとんど動かないようすが観察された(図4E).さらに詳細な解析を行うことで,Th17細胞はRANKLを介して破骨細胞に接着し,そのRANKL刺激によって破骨細胞の動きを抑制し骨吸収を活性化していることが明らかになった(図4F).
この他にも,同様の生体イメージング解析によって,骨芽細胞が破骨細胞と直接接触する瞬間を捉えることに成功し,骨芽細胞もまた接触を介して破骨細胞の骨吸収活性を制御していることも明らかになった(図4G)19).興味深いことに,骨芽細胞はRANKLを発現するにもかかわらず,骨芽細胞との接触ではTh17細胞との接触とは違って破骨細胞の骨吸収活性を抑制した(図4H).この結果から,骨芽細胞と破骨細胞はRANKL以外の異なる分子を介して接触し,破骨細胞の骨吸収機能を抑制するシグナルを伝達している可能性が示唆される.
以上のように,破骨細胞による骨吸収は周囲のさまざまな細胞との接触を介して制御されており,このような液性因子を介さない直接的な細胞間相互作用もまた骨リモデリングの調節において重要であることが明らかとなった.
1)細胞動態を指標にした薬効評価
以上で紹介した研究により,細胞の動態は細胞機能を反映している可能性が強く示唆された.脂肪組織におけるマクロファージの動態解析では,マクロファージの動きと炎症促進機能が関係していることがわかった.がん細胞の解析では,がん細胞の細胞周期が運動性,異所への浸潤性,さらには腫瘍サイズの増大速度と相関することを見いだした.さらに,破骨細胞の動態解析では,骨表面をはうような破骨細胞の動きが骨吸収機能と逆の相関を示すことを明らかにした.これらの知見をもとに我々は,細胞の動態を指標にして病態治療薬の薬効を評価できると考えた.そこで,骨組織における炎症性病態を例に,破骨細胞や破骨前駆細胞の動態を指標にした薬効評価系の確立を試みた.
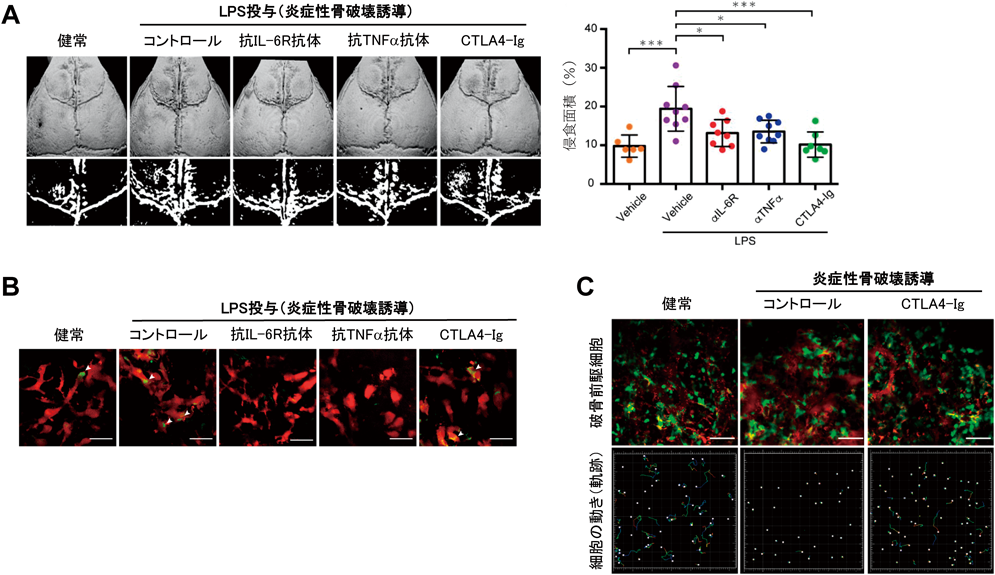
関節リウマチは炎症性骨破壊を来す難治性の自己免疫疾患である.近年,生物学的製剤の研究開発が進み,この新規に開発された治療薬によって関節破壊の進行を抑制し,病状を寛解させることができるようになってきた.その一方で,この製剤が破骨細胞やその前駆細胞に作用して,病態の本質であるこれらの細胞の動態・機能に対してどのような影響を与えるのかは明らかでなかった.そこで,生物学的製剤による関節リウマチ治療を例にして,関節リウマチ治療に有効とされる各種生物学的製剤[抗TNFα抗体,抗IL-6受容体抗体,CTLA4-イムノグロブリン(Ig)融合タンパク質]が破骨細胞や破骨前駆細胞の動態・機能に及ぼす効果を生体イメージング解析により調べた20).
まず,破骨細胞を蛍光標識したマウスの頭頂骨の骨膜下に炎症を惹起するリポ多糖(lipopolysaccharide:LPS)を投与することで,関節リウマチと類似した炎症性骨破壊モデルを確立した.この炎症状況下における破骨細胞の動きを解析したところ,健常な状態に比べて動きが抑制されていた.そして,マイクロCTで骨構造を解析したところ,骨吸収が促進され骨表面が大きく侵食されていることが明らかになった(図5A).この病態モデルマウスに各種生物学的製剤を投与したところ,抗TNFα抗体または抗IL-6受容体抗体を投与した場合とCTLA4-Igを投与した場合で異なる薬効がみられた.まず抗TNFα抗体または抗IL-6受容体抗体を投与した場合には,破骨細胞の運動性が増大し,骨吸収休止期への移行がみられ,骨破壊が抑制されることが確認された(図5A, B).一方で,CTLA4-Igを投与したマウスでは,破骨細胞の動きは依然として小さく,骨吸収は抑えられていないにもかかわらず,骨破壊については改善されていた(図5A, B).さらに各条件下での破骨細胞の総数を比較したところ,CTLA4-Igを投与した場合にのみ総数の減少が認められた.このことから,CTLA4-Igは破骨細胞の分化に影響していると考え,破骨前駆細胞を蛍光標識したマウスを用いて生体イメージング解析を行った.その結果,病態時に破骨前駆細胞の運動能が激しく低下し骨表面に吸着するようすがみられたが,CTLA4-Igを投与することで破骨前駆細胞の運動能が上昇し,骨組織から血管内に入り再還流していくようすが観察された(図5C).
以上の結果から,薬物投与による破骨細胞や破骨前駆細胞の動態変化は薬物治療効果を反映しており,薬物の作用メカニズムを明らかにする手がかりになることが明らかになった.
2)生体イメージングシステムのヒト組織診断への応用
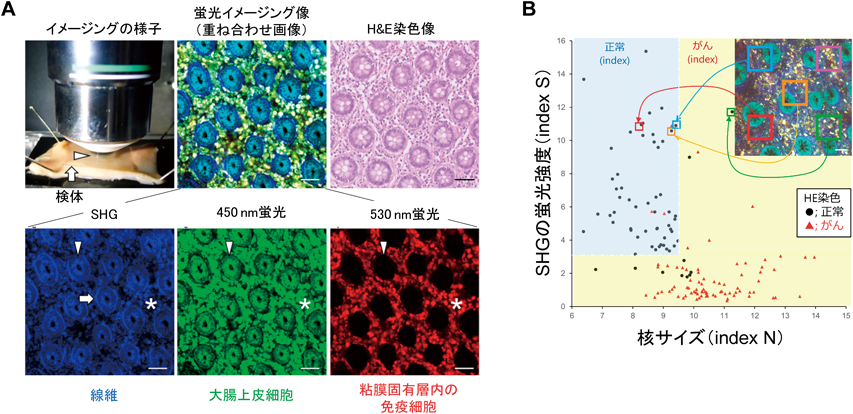
生体イメージング技術を実際のヒトの病態診断に活用することができるようになれば,医療の質が大幅に改善されることが期待される.そこで我々は,生体イメージング技術をヒトの病理診断に展開していくために,大腸がん手術後のヒトがん組織検体を用いて,固定・切片化・染色といった従来の処理工程を行わずに新鮮な組織のまま,がんの病理診断を行える方法を開発した21).この方法では,生体組織内の各種細胞に元来みられる蛍光シグナル(自家蛍光)と,2光子励起により誘起した二次高調波発生(second harmonic generation:SHG)のシグナル(SHG光)を利用することで,大腸組織の特徴を詳細に抽出することができる(図6A).たとえば,腸管上皮細胞は,波長730 nmで励起すると,波長450 nmの自家蛍光として検出される.免疫細胞が多く存在する腸管粘膜固有層は,波長820 nmで励起すると,波長530 nmの自家蛍光として検出される.組織内の線維構造は,波長820 nmで励起すると,波長410 nm(半分の波長)のSHG光として検出することができる.さらに,これらに加えて,上皮細胞の細胞核は蛍光がない,黒く抜けた部分として判別することができる.以上の方法で,正常組織部位とがん組織部位を見比べると,がん化した領域ではSHGシグナルが減少し,細胞核の肥大化がみられた.そこで我々は,正常部位とがん部位を判別する特徴量として,SHGシグナルと細胞核サイズを利用した指標を新たに開発した.そして,この指標を撮影した画像全体に対して算出することで,正常部位とがん部位を定量的に高精度で分類できることが明らかになった(図6B).この技術・方法を応用することで,「切らない生検」として新たな顕微鏡システムが実現し,臨床の現場において患者の身体への負担を減らしつつリアルタイムで高精度な診断が可能になると大きく期待される.
従来のように組織切片を用いた組織学的解析やフローサイトメトリーを用いた細胞解析では,各組織内の種々の細胞の動きや時間経過によって変わりゆく細胞の機能状態を知ることはできなかった.また,破骨細胞が他の細胞と直接接触することで骨吸収活性が変化するように,細胞間相互作用による機能制御の因果関係についても従来のスナップショット解析や生体外に分離した細胞の解析ではほとんど明らかにできなかった.しかし,生体内をありのまま観察できる生体イメージングを用いることで,生理的環境下における種々の細胞の“動き”,“機能”,“相互作用”とこれらの因果関係が手に取るように明らかになることがこれまでの研究により実証されてきた.その一方で,生体イメージングで捉えられる生命現象はまだまだ限られたものであるのも事実である.今後,より多くの,そしてより長期的な生命現象を可視化するためのツールや手法が開発され,多くの研究対象を同時に可視化するための顕微鏡技術が発展することで,より複雑な細胞動態ネットワークを解明できることが強く期待される.
引用文献References
1) Miller, M.J., Safrina, O., Parker, I., & Cahalan, M.D. (2004) Imaging the single cell dynamics of CD4+T cell activation by dendritic cells in lymph nodes. J. Exp. Med., 200, 847–856.
2) Okada, T., Miller, M.J., Parker, I., Krummel, M.F., Neighbors, M., Hartley, S.B., O’Garra, A., Cahalan, M.D., & Cyster, J.G. (2005) Antigen-engaged B cells undergo chemotaxis toward the T zone and form motile conjugates with helper T cells. PLoS Biol., 3, 1047–1061.
3) Nishimura, S., Manabe, I., Nagasaki, M., Seo, K., Yamashita, H., Hosoya, Y., Ohsugi, M., Tobe, K., Kadowaki, T., Nagai, R., et al. (2008) In vivo imaging in mice reveals local cell dynamics and inflammation in obese adipose tissue. J. Clin. Invest., 118, 710–721.
4) Sekimoto, R., Fukuda, S., Maeda, N., Tsushima, Y., Matsuda, K., Mori, T., Nakatsuji, H., Nishizawa, H., Kishida, K., Kikuta, J., et al. (2015) Visualized macrophage dynamics and significance of S100A8 in obese fat. Proc. Natl. Acad. Sci. USA, 112, E2058–E2066.
5) Kanda, H., Tateya, S., Tamori, Y., Kotani, K., Hiasa, K., Kitazawa, R., Kitazawa, S., Miyachi, H., Maeda, S., Egashira, K., et al. (2006) MCP-1 contributes to m. J. Clin. Invest., 116, 1494–1505.
6) Weisberg, S.P., Hunter, D., Huber, R., Lemieux, J., Slaymaker, S., Vaddi, K., Charo, I., Leibel, R.L., & Ferrante, A.W. Jr. (2006) CCR2 modulates inflammatory and metabolic effects of high-fat feeding Find the latest version : CCR2 modulates inflammatory and metabolic effects of high-fat feeding. J. Clin. Invest., 1, 115–124.
7) Thiery, J.P. (2002) Epithelial–mesenchymal transitions in tumour progression. Nat. Rev. Cancer, 2, 442–454.
8) Kagawa, Y., Matsumoto, S., Kamioka, Y., Mimori, K., Naito, Y., Ishii, T., Okuzaki, D., Nishida, N., Maeda, S., Naito, A., et al. (2013) Cell cycle-dependent Rho GTPase activity dynamically regulates cancer cell motility and invasion in vivo. PLoS One, 8, 8.
9) Sakaue-Sawano, A., Kurokawa, H., Morimura, T., Hanyu, A., Hama, H., Osawa, H., Kashiwagi, S., Fukami, K., Miyata, T., Miyoshi, H., et al. (2008) Visualizing Spatiotemporal Dynamics of Multicellular Cell-Cycle Progression. Cell, 132, 487–498.
10) Teitelbaum, S.L. & Ross, F.P. (2003) Genetic regulation of osteoclast development and function. Nat. Rev. Genet., 4, 638–649.
11) Ishii, M., Egen, J.G., Klauschen, F., Meier-Schellersheim, M., Saeki, Y., Vacher, J., Proia, R.L., & Germain, R.N. (2009) Sphingosine-1-phosphate mobilizes osteoclast precursors and regulates bone homeostasis. Nature, 458, 524–528.
12) Ishii, M., Kikuta, J., Shimazu, Y., Meier-Schellersheim, M., & Germain, R.N. (2010) Chemorepulsion by blood S1P regulates osteoclast precursor mobilization and bone remodeling in vivo. J. Exp. Med., 207, 2793–2798.
13) Kikuta, J., Wada, Y., Kowada, T., Wang, Z., Sun-Wada, G.H., Nishiyama, I., Mizukami, S., Maiya, N., Yasuda, H., Kumanogoh, A., et al. (2013) Dynamic visualization of RANKL and Th17-mediated osteoclast function. J. Clin. Invest., 123, 866–873.
14) Maeda, H., Kowada, T., Kikuta, J., Furuya, M., Shirazaki, M., Mizukami, S., Ishii, M., & Kikuchi, K. (2016) Real-Time intravital imaging of pH variation associated with osteoclast activity. Nat. Chem. Biol., 12, 579–585.
15) Nakashima, T., Hayashi, M., Fukunaga, T., Kurata, K., Oh-Hora, M., Feng, J.Q., Bonewald, L.F., Kodama, T., Wutz, A., Wagner, E.F., et al. (2011) Evidence for osteocyte regulation of bone homeostasis through RANKL expression. Nat. Med., 17, 1231–1234.
16) Xiong, J., Onal, M., Jilka, R.L., Weinstein, R.S., Manolagas, S.C., & O’Brien, C.A. (2011) Matrix-embedded cells control osteoclast formation. Nat. Med., 17, 1235–1241.
17) Sato, K., Suematsu, A., Okamoto, K., Yamaguchi, A., Morishita, Y., Kadono, Y., Tanaka, S., Kodama, T., Akira, S., Iwakura, Y., et al. (2006) Th17 functions as an osteoclastogenic helper T cell subset that links T cell activation and bone destruction. J. Exp. Med., 203, 2673–2682.
18) Takayanagi, H., Ogasawara, K., Hida, S., Chiba, T., Murata, S., Sato, K., Takaoka, A., Yokochi, T., Oda, H., Tanaka, K., et al. (2000) T-cell-mediated regulation of osteoclastogenesis by signalling cross-talk between RANKL and IFN-γ. Nature, 408, 600–605.
19) Furuya, M., Kikuta, J., Fujimori, S., Seno, S., Maeda, H., Shirazaki, M., Uenaka, M., Mizuno, H., Iwamoto, Y., Morimoto, A., et al. (2018) Direct cell-cell contact between mature osteoblasts and osteoclasts dynamically controls their functions in vivo. Nat. Commun., 9, 1–12.
20) Matsuura, Y., Kikuta, J., Kishi, Y., Hasegawa, T., Okuzaki, D., Hirano, T., Minoshima, M., Kikuchi, K., Kumanogoh, A., & Ishii, M. (2018) In vivo visualisation of different modes of action of biological DMARDs inhibiting osteoclastic bone resorption. Ann. Rheum. Dis., 77, 1220–1226.
21) Matsui, T., Mizuno, H., Sudo, T., Kikuta, J., Haraguchi, N., Ikeda, J.I., Mizushima, T., Yamamoto, H., Morii, E., Mori, M., et al. (2017) Non-labeling multiphoton excitation microscopy as a novel diagnostic tool for discriminating normal tissue and colorectal cancer lesions. Sci. Rep., 7, 1–9.
著者紹介Author Profile
 宮本 佑(みやもと ゆう)
宮本 佑(みやもと ゆう)大阪大学大学院医学系研究科博士課程.修士(薬科学).
略歴2016年3月慶應義塾大学薬学部薬科学科卒業(指導教授:長谷耕二教授).17年4月より慶應義塾大学大学院に所属しながら大阪大学蛋白質研究所細胞システム研究室に国内留学し,システム生物学に基づく研究手法を習得(指導教授:岡田眞里子教授).18年3月慶應義塾大学大学院薬学研究科修士課程修了.18年4月より大阪大学大学院医学系研究科博士課程(指導教授:石井優教授).
研究テーマ生体イメージング技術とシングルセル解析技術を組み合わせて,生体内で免疫細胞の動態や機能が時空間的にどのように制御されているかを研究しています.
抱負これまでの研究で得られた知見と技術を駆使し,基礎医学の発展に少しでも貢献できるよう精進したいと思っています.
ウェブサイトhttp://www.icb.med.osaka-u.ac.jp/index.html
趣味登山,バックパック・旅行,野球観戦.