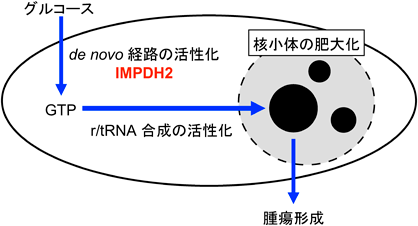
核小体の活性と腫瘍形成を制御するGTP代謝リプログラミングGTP metabolic reprogramming to regulate nucleolar activity and tumorigenesis
東京医科歯科大学難治疾患研究所発生再生生物学分野Department of Developmental and Regenerative Biology, Medical Research Institute, Tokyo Medical and Dental University ◇ 〒113–8510 東京都文京区湯島1–5–45 東京医科歯科大学 M&Dタワー 21階 ◇ 1–5–45 Yushima, Bunkyo-ku, Tokyo 113–8510, Japan