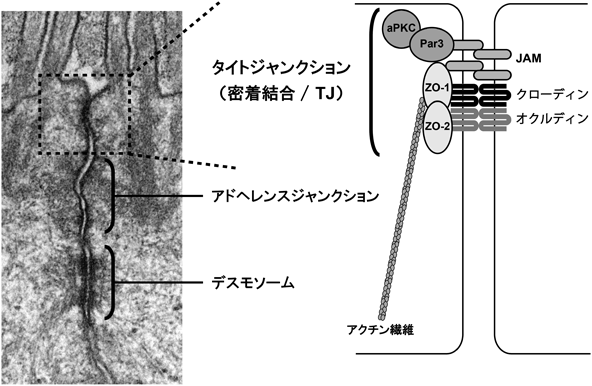
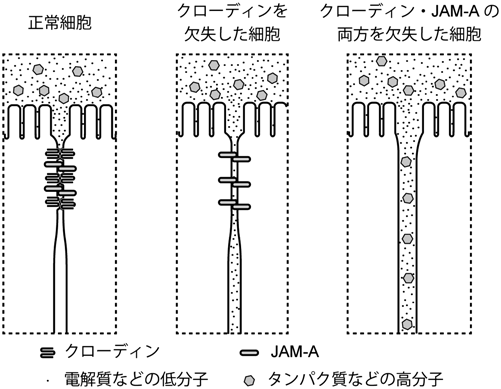
タイトジャンクションの構造・機能連関の新しい視点New perspective of the structure and function of tight junctions
自然科学研究機構生理学研究所細胞構造研究部門Division of Cell Structure, National Institute for Physiological Sciences, National Institute of Natural Sciences ◇ 〒444–8787 愛知県岡崎市明大寺町字東山5–1 ◇ 5–1 Higashiyama, Myodaiji, Okazaki, Aichi 444–8787, Japan