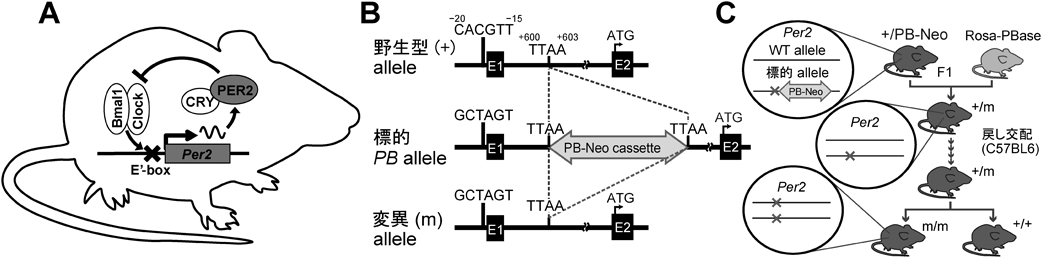
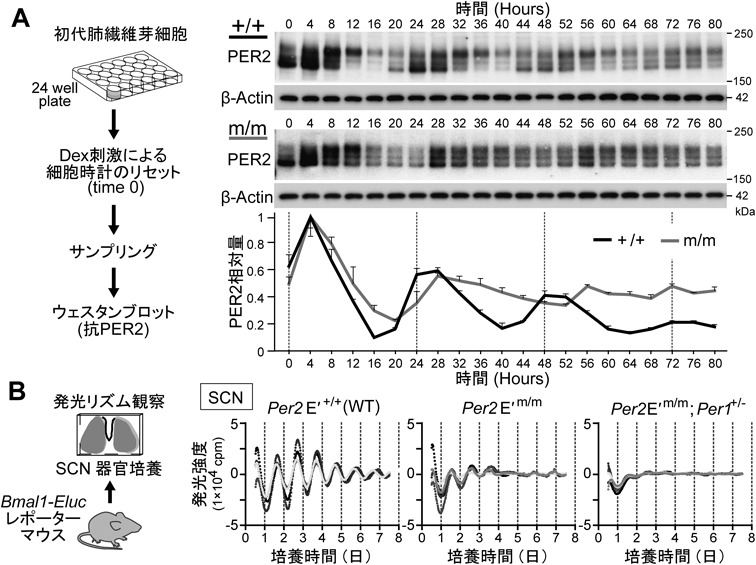
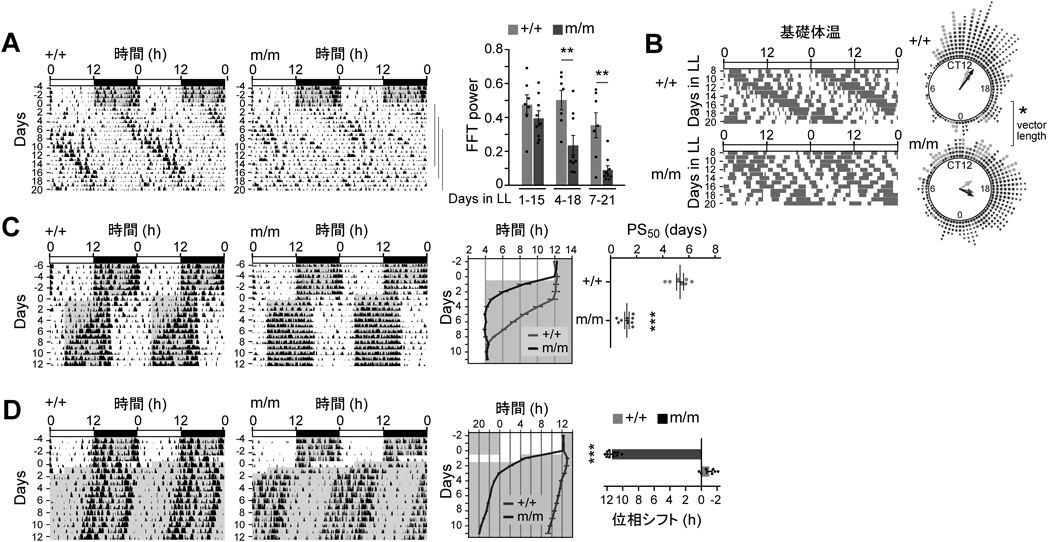
時計遺伝子の転写のシス制御エレメントに点変異を入れると体内時計はどうなるのかImpact of the mutation of the cis-regulatory element of the core clock gene on the body clock
京都大学大学院薬学研究科医薬創成情報科学講座Department of Systems Biology, Graduate School of Pharmaceutical Sciences, Kyoto University ◇ 〒606–8501 京都市左京区吉田下阿達町46–29 ◇ 46–29 Yoshida-Shimoadachi-cho, Sakyo-ku, Kyoto 606–8501, Japan