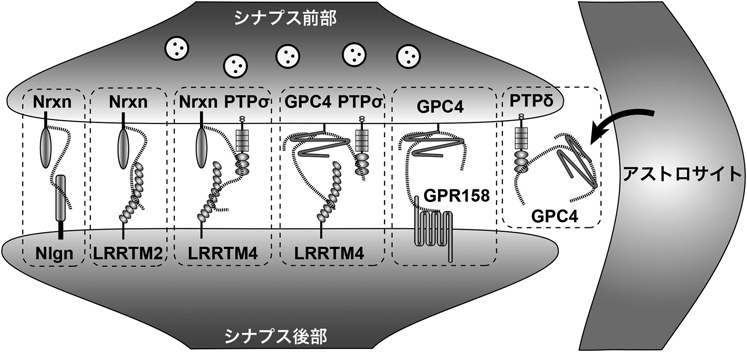
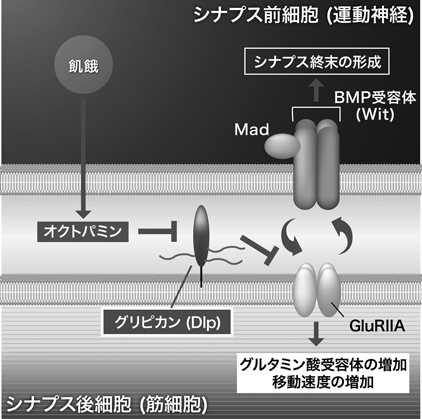
シナプスにおけるグリピカンとニューレキシンのヘパラン硫酸鎖の役割Heparan sulfate chains of glypican and neurexin at the synapse
(公財)東京都医学総合研究所,脳・神経科学研究分野,脳神経回路形成プロジェクトDepartment of Brain and Neurosciences, Tokyo Metropolitan Institute of Medical Science ◇ 〒156–8506 東京都世田谷区上北沢2–1–6 ◇ 2–1–6 Kamikitazawa, Setagaya-ku, Tokyo 156–8506, Japan