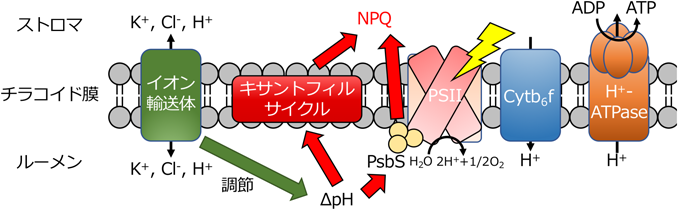
イオン輸送体の役割の一つは,生物がストレスにさらされたときにおける細胞内イオン恒常性や細胞容量の維持である.近年の研究により,植物が光環境の変動に対応するために,イオン輸送体を利用していることがわかっている.植物は光合成の明反応において,光エネルギーを利用した電子伝達を行いNADPHを生産する一方,チラコイド膜を介したプロトン駆動力(proton motive force:PMF)を形成することで,H+-ATPaseを駆動させ,ATPの生産を行う.プロトン駆動力はプロトン濃度勾配(∆pH)と膜電位(∆Ψ)の和で定義され,このバランスにより植物は吸収する光エネルギーを調節している.通常,植物は光エネルギーを利用して光合成産物を作ることから,光が強いほど生育が促進されると考えがちだが,実際のところは,植物は強光を嫌う.光エネルギーが過剰に存在すると,電子伝達系が飽和するとともに,活性酸素種の発生やチラコイド膜内の過剰な酸性化が起こり,光化学系が損傷(光阻害)を受ける.植物は光阻害を避けるため,いくつかの防御反応を用意しており,その一つは非光化学的消光(non-photochemical quenching:NPQ)と呼ばれる光散逸機構である.
NPQは,少なくともプロトン濃度勾配による消光(qE),ステート遷移による消光(qT),光阻害による消光(qI)といった三つに分類することができる.特にqEはNPQの大部分を担っており,その制御機構に注目が集まっている1).qEは,植物が強光にさらされたときにチラコイド膜内に水素イオン(H+)が蓄積されることにより誘導される機構である.qEの誘導にかかわる主な二つの経路が知られている.一つは,キサントフィルサイクルと呼ばれる経路である2).チラコイド膜内が酸性化されると,ビオラキサンチンデエポキシダーゼが活性化され,ビオラキサンチンがゼアキサンチンとなる.ゼアキサンチンとクロロフィルが二量体を形成することで,光エネルギーを反応中心から逃すことができる.もう一つの経路は,チラコイド膜に局在する4回膜貫通膜タンパク質のPsbSを介した経路である3).PsbSはチラコイド膜内腔のpHセンサーとして機能し,チラコイド膜内が酸性化されると光化学系の再構成を行うことで,qEの駆動を行うことが知られている.
光化学系の電子伝達率やNPQは,パルス変調測定光を用いたクロロフィル蛍光の観察を行うことで定量化することが可能である.クロロフィルによって吸収された光エネルギーは,多くが電子伝達に使われるが,使われないエネルギーはNPQとクロロフィル蛍光に分散される.一時的に電子伝達系を電子で飽和させる光を照射したときに,電子伝達に用いられていたエネルギーはすべてクロロフィル蛍光として観察される.そのため,飽和光照射時と飽和光非照射時のクロロフィル蛍光を比較することで,電子伝達率を測定することができる.また,飽和光照射時のクロロフィル蛍光はNPQが大きいほど低下するため,これを利用してNPQの測定も可能である.
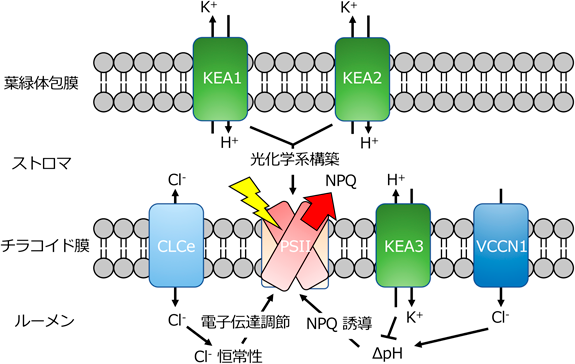
上述したクロロフィル蛍光測定により,チラコイド膜に局在するK+/H+アンチポーター(交換輸送体)ホモログであるKEA3を筆頭に,さまざまなイオン輸送体がNPQの調節を介する植物の光環境応答に貢献していることがわかってきた(図1).本稿では,イオン輸送体による光化学系の調節機構について,これまでわかっていることについて概説する.
2. 葉緑体局在型K+/H+アンチポーターによる光合成制御
1)チラコイド膜局在型K+/H+アンチポーターによるNPQの抑制
植物は,6個のK+排出型交換輸送体(K+ efflux antiporter:KEA)を保持しており,KEA1~KEA3が葉緑体局在型K+/H+アンチポーターである4, 5).
KEA3はチラコイド膜に発現しており,KEA3欠損株(kea3)は野生株と比較して高いNPQを示す.また,この現象は,暗条件から弱光条件への移行,強光条件から弱条件への移行など,外部から得られる光量が変動してから数十秒の間に検出できる.光環境が変動して数分以上経過した後では,kea3株と野生株は同様のNPQを示す.これらの事実から,KEA3は光エネルギー量が変動するときにH+をチラコイド膜外へ排出し,NPQを抑制することで光エネルギーの効率的な吸収に貢献していることを示唆している.また,強光条件ではこの表現型がみられないことから,強光条件でKEA3の活性が抑制されることで,NPQが誘導されている可能性が示唆されている.
では強光条件でKEA3はどのように抑制されているのだろうか? KEA3はそのC末端領域にストロマ側に露出しているKTN(K+ transport nucleotide binding)ドメインを保持している6).KTNドメインは,K+輸送体に広く保存されているドメインで,大腸菌が保持しているK+/H+アンチポーターであるKefCもKTNドメインを保持しており,グルタチオンとNADHが結合することで輸送活性を阻害することが明らかとされている7).KEA3が保持しているKTNドメインの機能は明らかでないが,強光条件でのKEA3の抑制に寄与することが以下の実験結果により示唆されている.KEA3にはKEA3.1, KEA3.2, KEA3.3の3種類のスプライシングバリアントが存在している.KEA3.2が全長の配列をコードするが,KEA3.3から翻訳される配列はKTNドメインを保持していない.KEA3.2を過剰発現させた株は,強光条件から弱光条件への移行時には野生株よりも低いNPQを示すが,強光条件において野生株と同様のNPQとなる.一方,KTNドメインをコードしないKEA3.3を過剰発現させた株では,強光条件でも強光条件から弱光条件への移行時と同様に低いNPQを示す.KTNドメインがストロマ側に露出していることも併せて考察すると,強光条件において光合成明反応により生産されたNADPHもしくはATPによりKEA3のK+/H+交換輸送が抑制されていると推測される6).KEA3によるストロマ(細胞質)へのH+の流出が抑制されることで,チラコイド膜内のルーメンは酸性化され,強光条件において植物はNPQを誘導することができると考えられる.
2)包膜局在型K+/H+アンチポーターによる葉緑体タンパク質の生合成制御
KEA3がチラコイド膜を介した∆pHを制御するが,KEA1とKEA2は葉緑体の包膜に存在している4).KEA1, KEA2の単独欠損株では目立った表現型を示さないが,二重欠損株(kea1kea2)は∆pHの形成が不全となり,NPQを駆動することできないと報告されている.さらに,kea1kea2株では,チラコイド膜の形成が不全となり,クロロフィルや光化学系タンパク質などの量が低下していることが示されている.詳細な局在解析により,KEA2は葉緑体の極に局在している8).葉緑体の極には,チラコイド膜の光化学系タンパク質の合成をつかさどる分子装置が存在している.そのため,KEA2は葉緑体の極のイオン恒常性を調節することで,光化学系タンパク質の構築に寄与していると考えられる.
3)K+/H+アンチポーターの輸送活性の評価
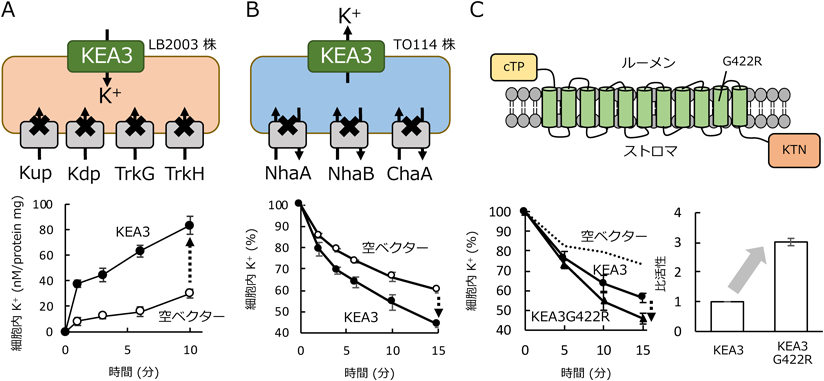
上述したように,KEA1~KEA3が植物葉緑体において重要な役割を果たしていることは生理学的解析により明らかとされてきた.しかし,これらの輸送体の詳細な輸送活性を直接測定した報告はなかった.筆者らは,シロイヌナズナのKEAファミリーに属するすべてのK+/H+アンチポーター(KEA1~KEA6)の輸送活性の評価を行った(図2)9).KEA3は,葉緑体の先祖である藍藻のチラコイド膜に存在するNa+/H+アンチポーターNhaS3のホモログである10).筆者らは,NhaS3の輸送活性測定法を,植物KEA1~KEA6の輸送測定に適用した.大腸菌のK+輸送体(Kup, Kdp, TrkG, TrkH)欠損株を宿主としてKEA1~KEA6をそれぞれ発現させた.K+低濃度培地で生育試験を行った結果,KEA1~KEA6のすべてがその変異株のK+要求性を相補した.また,この大腸菌を用いてK+輸送活性を経時的に実測したところ,KEA1~KEA6は有意に高いK+取り込み活性を示した.次に,大腸菌のNa+(K+)/H+アンチポーター(NhaA, NhaB, ChaA)遺伝子欠損株を宿主細胞として,K+排出活性の測定を行った.その結果,KEA1~KEA3, KEA5は排出輸送活性を示した,しかし,KEA4, KEA6は排出活性を示さなかった.さらに,KEA1~KEA6はNa+取り込み活性も排出活性も持たないことが明らかになった.これらの結果より,KEA1~KEA6はK+を選択的に取り込み,KEA1~KEA3, KEA5はK+を排出する活性を持つことが明らかになった.
KEA3の422番目のグリシンがアルギニンに替わった置換体(distributed proton gradient regulation mutant:dpgr)は,NPQが過剰に抑制されることが報告されている6).さらに,dpgr株ではチラコイド膜を介した∆pH依存的なqEとシトクロムb6fの活性制御が低下していることも明らかにされている11).この結果から,dpgr株は,KEA3の活性が増強されていることが示唆されていた.筆者らは,大腸菌を宿主細胞としたKEA3の輸送活性測定系を用いて,KEA3とKEA3-G422Rの輸送活性を比較した.その結果,KEA3-G422RはKEA3よりも高いK+輸送活性を示した.これらの結果から,dpgrでは,KEA3によるチラコイド膜を介したK+/H+交換活性が高いために,∆pH依存的な光合成制御が起きないことが示された.
3. Cl−透過型イオンチャネルによる光合成制御機構
KEA3以外にも,光合成を制御しているイオン輸送体は複数報告されている.VCCN1(voltage-dependent Cl− channel)はチラコイド膜のCl−を透過する輸送体で光合成の制御に関係する12).植物が暗闇から強光にさらされたとき,VCCN1の欠損株(vccn1)では,野生株と比較してPMFが高いことが示されている.また,VCCN1過剰発現株(oeVCCN1)では,PMFが過剰に低いことが明らかとされている.さらにPMFの内訳をelectrochromic shift測定により測定したところ,vccn1株は野生株と比較して∆Ψが高く∆pHが低い一方で,oeVCCN1株は∆Yが消失して∆pHの割合が増加している.光照射時においてvccn1株ではNPQが低く,oeVCCN1株ではNPQが高くなる.これらの結果を合わせると,VCCN1は植物の光環境が変動したときに,チラコイドルーメンにCl−を輸送して∆Ψを減少させ,∆pHの割合を増やすことでNPQを誘導すると考えられる.
CLCeもVCCN1と同様にチラコイド膜に局在するCl−を透過するイオンチャネルである.CLCe欠損株(clce)では,vccn1と同様に∆Ψが増加し,∆pHが減少する13).一方,vccn1株とは異なり,clce株は野生株と比較して高いもしくは同等のNPQを示す12, 14).この結果は,CLCeがVCCN1と同様に∆pHの制御を介したNPQの誘導を行っていないことを示している.さらにclce株において,光化学系IIからIへの電子伝達速度が上昇していることも報告されている14).これらは,チラコイドルーメンのCl−の恒常性維持によるものであると考察されているが,詳細な機構は明かされていない.
本稿では,植物葉緑体のイオン輸送体による光合成制御について概説した(図3).植物が得られる光エネルギーの量が変動したときに,適切にエネルギーを電子伝達と化学エネルギーの産生に使うためにイオン輸送体がNPQを調節していることが明らかになってきた.今後,さらに遺伝学的や生理的な検討に加えて,実体が未知のイオン輸送体の輸送活性と制御様式の解明が進めば,植物体の光合成効率の調節系の全体像がさらに明らかになると期待される.