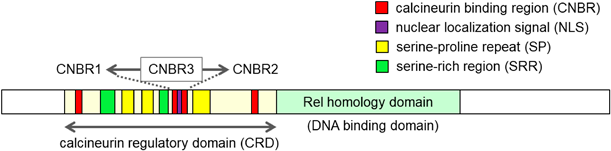
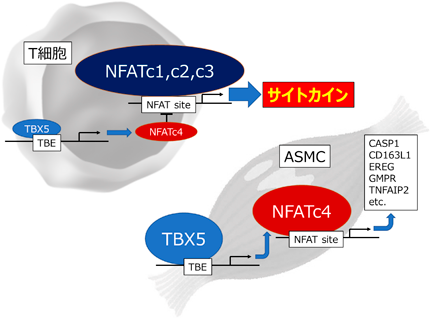
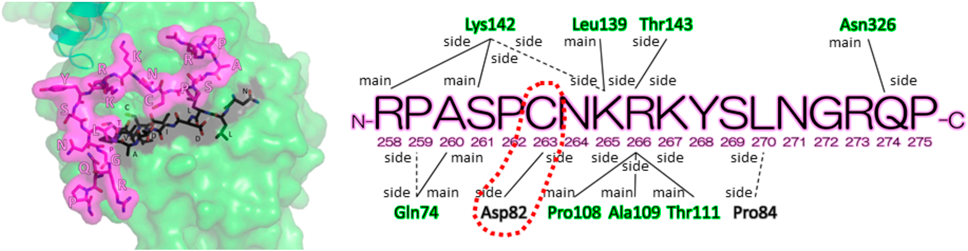
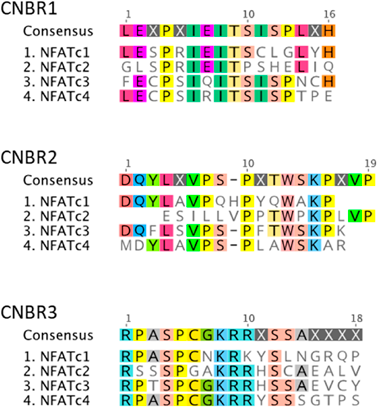
転写因子NFATファミリーにおけるアイソフォーム選択的制御の意義と可能性Usefulness and potential of isoform selective regulation of NFAT family transcription factors
1 公益財団法人 東京都医学総合研究所 花粉症研究室Laboratory of Allergy and Immunology, Tokyo Metropolitan Institute of Medical Science ◇ 〒156–8506 東京都世田谷区上北沢2–1–6 ◇ 2–1–6 Kamikitazawa, Setagaya-ku, Tokyo 156–8506, Japan
2 広島大学 原爆放射線医科学研究所疾患モデル解析研究分野Department of Disease Model, Research Institute of Radiation Biology and Medicine, Hiroshima University ◇ 〒734–8553 広島県広島市南区霞1–2–3 ◇ 1–2–3 Kasumi, Minami-ku, Hiroshima 734–8553, Japan