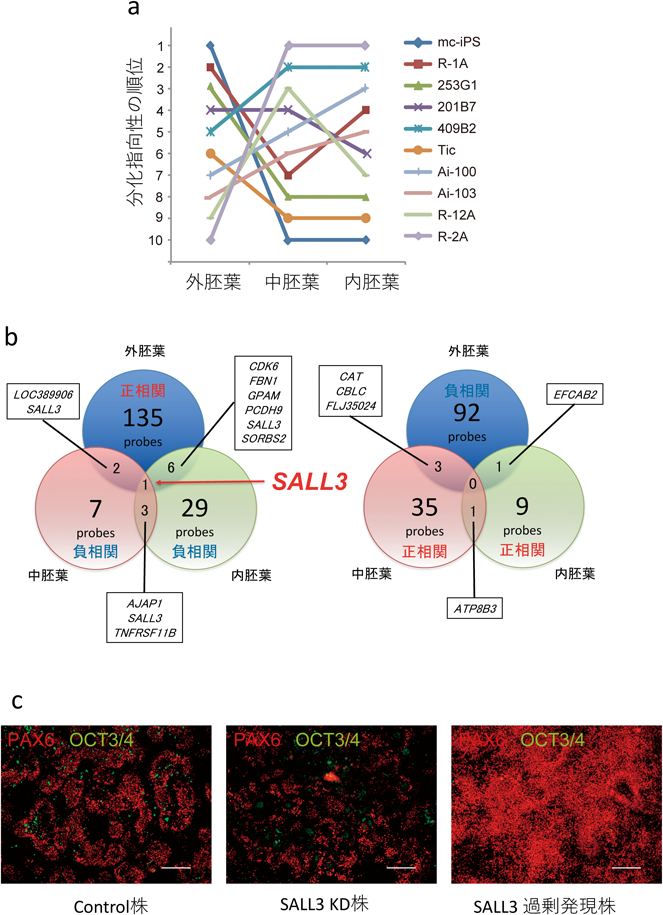
ヒトiPS細胞分化指向性におけるSALL3の機能解析SALL3 regulates propensity of human induced pluripotent stem cells to differentiate into distinct cell lineages
国立医薬品食品衛生研究所 再生・細胞医療製品部National Institute of Health Sciences, Division of Cell-Based Therapeutic Products ◇ 神奈川県川崎市川崎区殿町3–25–26 ◇ 3–25–26 Tonomachi, Kawasaki Ward, Kawasaki City, Kanagawa 210–9501, Japan