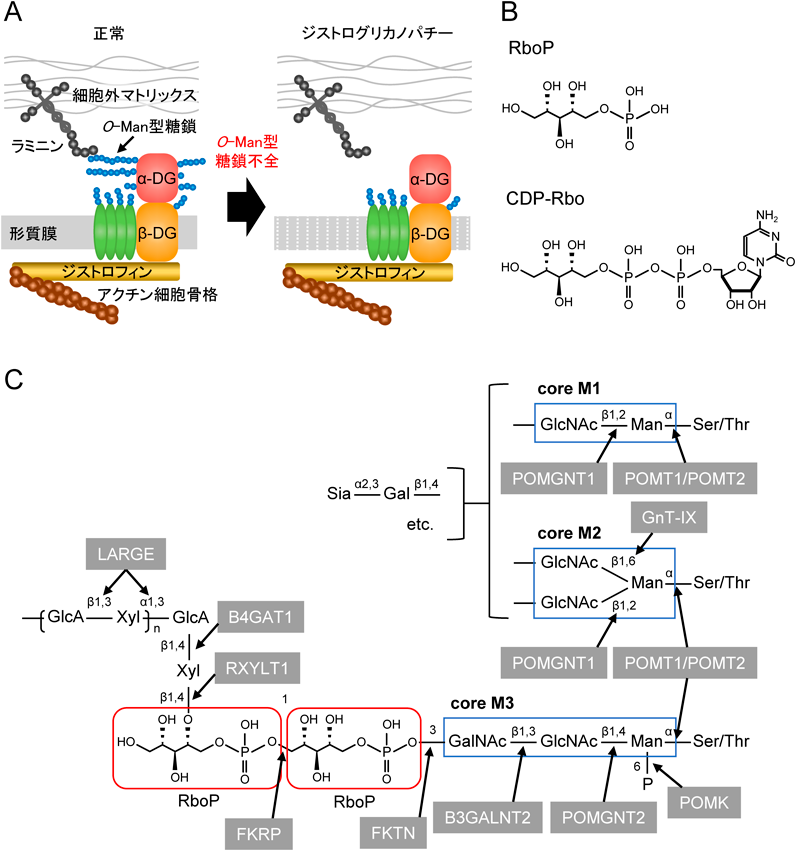
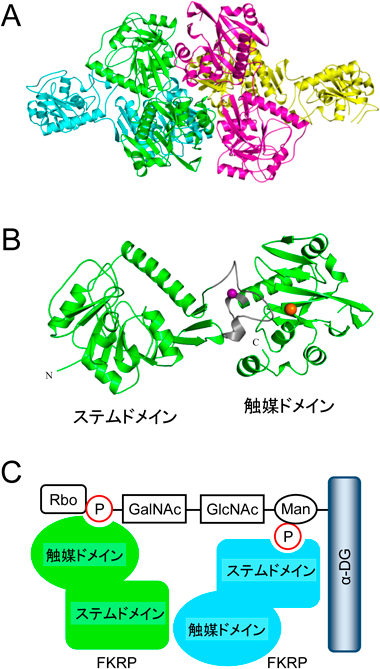
筋ジストロフィー症原因遺伝子産物FKRPによるリビトールリン酸含有糖鎖の合成機構Biosynthetic mechanisms of ribitol phosphate-containing glycan by FKRP, a muscular dystrophy gene product
1 東京都健康長寿医療センター研究所Tokyo Metropolitan Geriatric Hospital and Institute of Gerontology ◇ 〒173–0015 東京都板橋区栄町35–2 ◇ 35–2 Sakaecho, Itabashi-ku, Tokyo 173–0015, Japan
2 高エネルギー加速器研究機構物質構造科学研究所Institute of Materials Structure Science, High Energy Accelerator Research Organization (KEK) ◇ 〒305–0801 茨城県つくば市大穂1–1 ◇ 1–1 Oho, Tsukuba, Ibaraki 305–0801, Japan