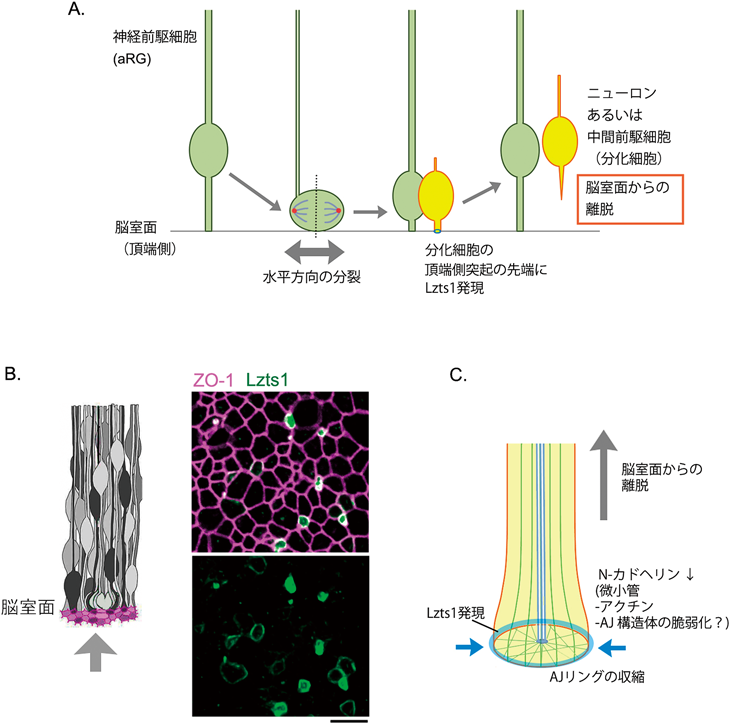
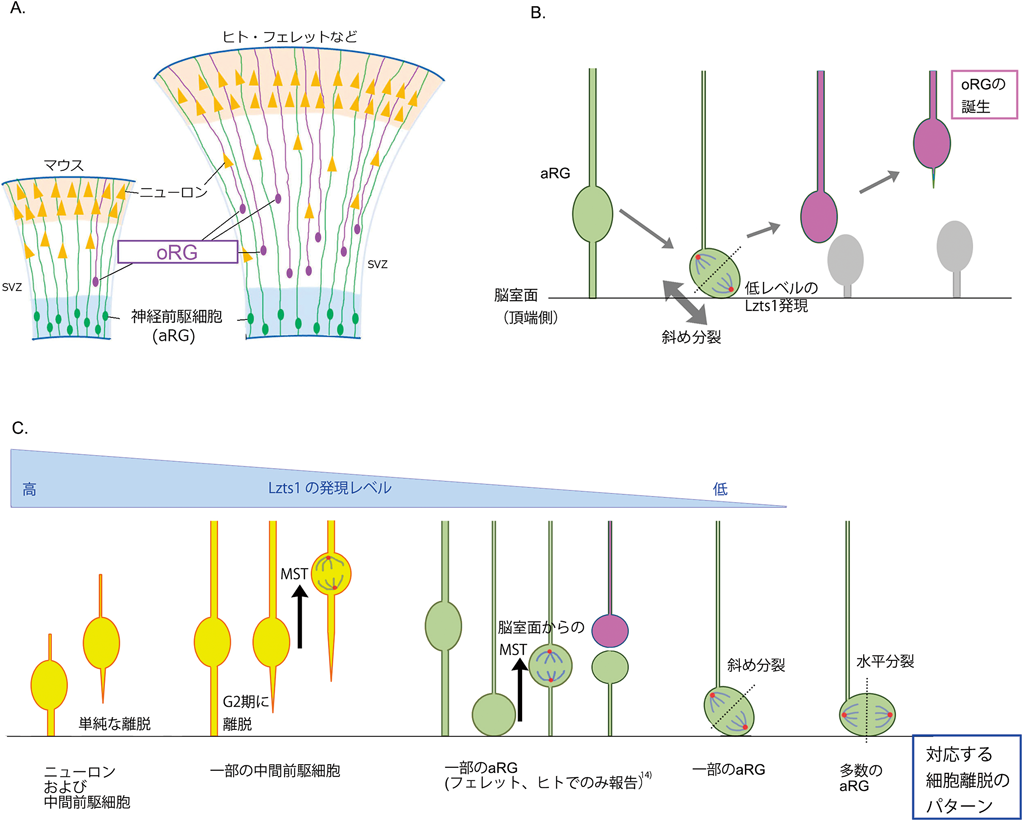
細胞離脱の実行役分子Lzts1による大脳形成制御Lzts1 as a master regulator of neuronal delamination in cerebral development
名古屋大学大学院医学系研究科細胞生物学分野Nagoya University Graduate School of Medicine, Department of Anatomy and Cell Biology ◇ 〒466–8550 名古屋市昭和区鶴舞町65 ◇ 65 Tsurumai-cho, Showa-ku, Nagoya 466–8550, Japan