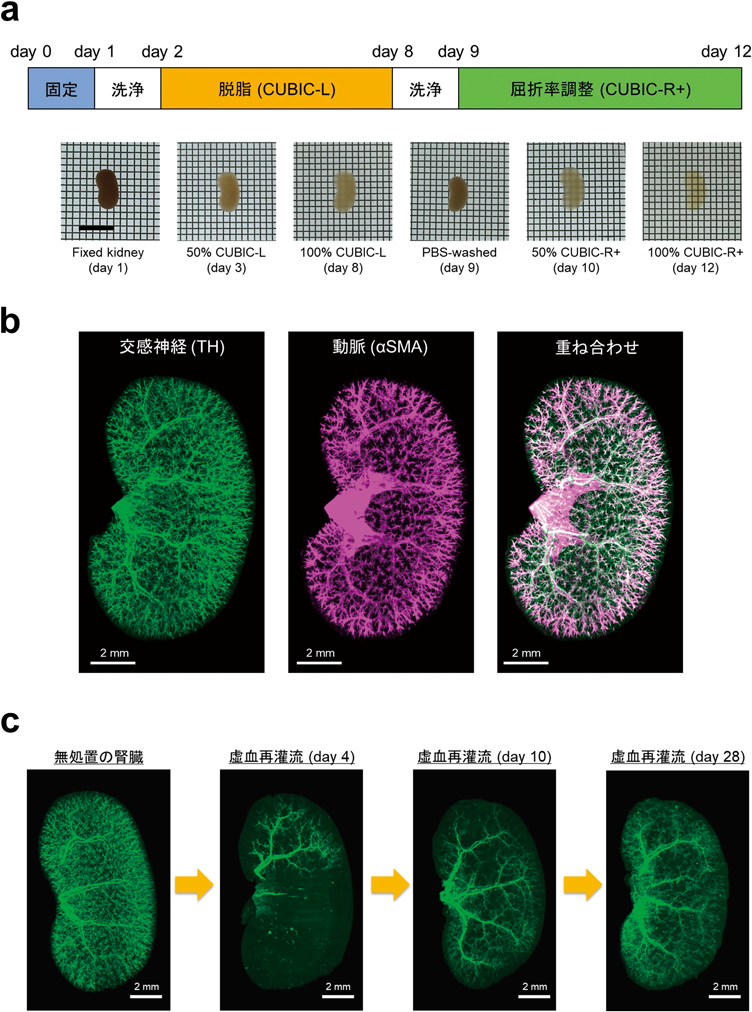
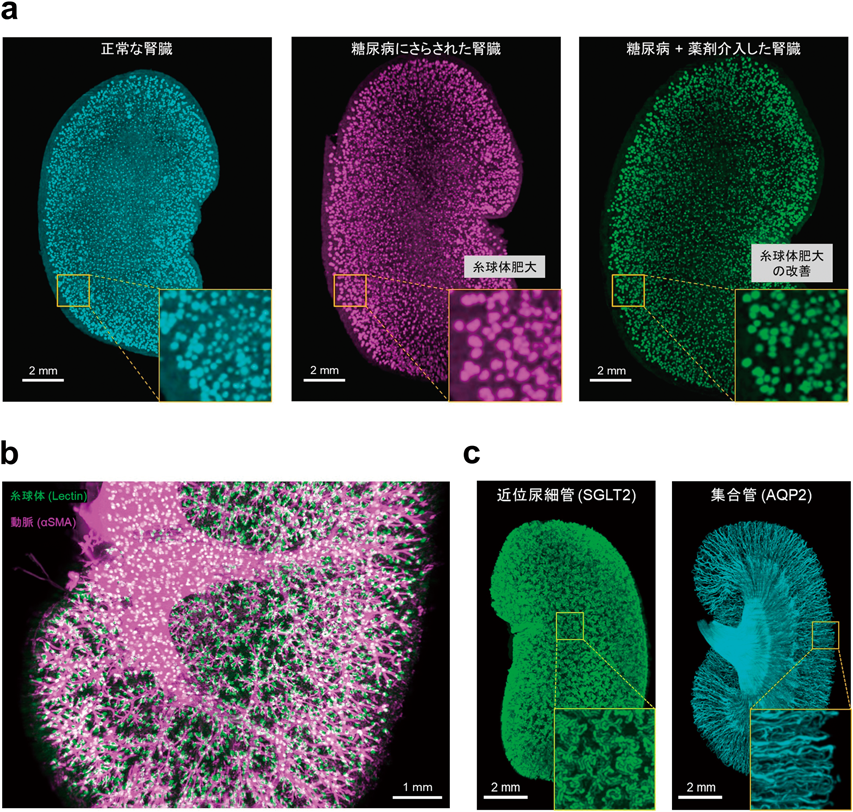
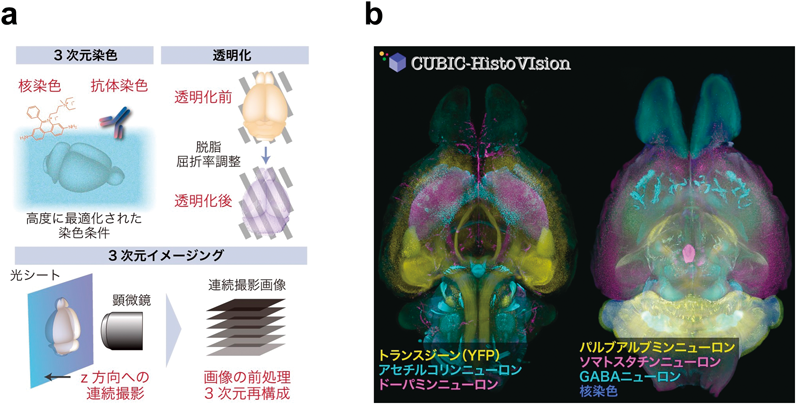
腎臓を視る——組織透明化による腎臓病の3次元病態解析——Tissue clearing-based three-dimensional analysis of kidney disease pathophysiology
1 東京大学大学院医学系研究科・腎臓内科学Division of Nephrology and Endocrinology, The University of Tokyo Graduate School of Medicine ◇ 〒113–8655 東京都文京区本郷7–3–1 ◇ 7–3–1 Bunkyo-ku, Hongo, Tokyo, 113–8655
2 東京大学大学院医学系研究科・システムズ薬理学Department of Systems Pharmacology, The University of Tokyo Graduate School of Medicine ◇ 〒113–8655 東京都文京区本郷7–3–1 ◇ 7–3–1 Bunkyo-ku, Hongo, Tokyo, 113–8655
3 理化学研究所生命機能科学研究センター合成生物学研究チームLaboratory for Synthetic Biology, RIKEN Center for Biosystems Dynamics Research ◇ 〒565–0871 大阪府吹田市山田丘1–3 ◇ 1–3, Yamadaoka, Suita, Osaka, 565–0871