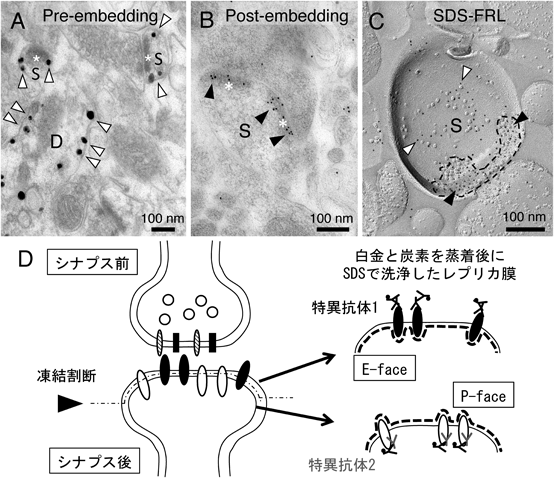
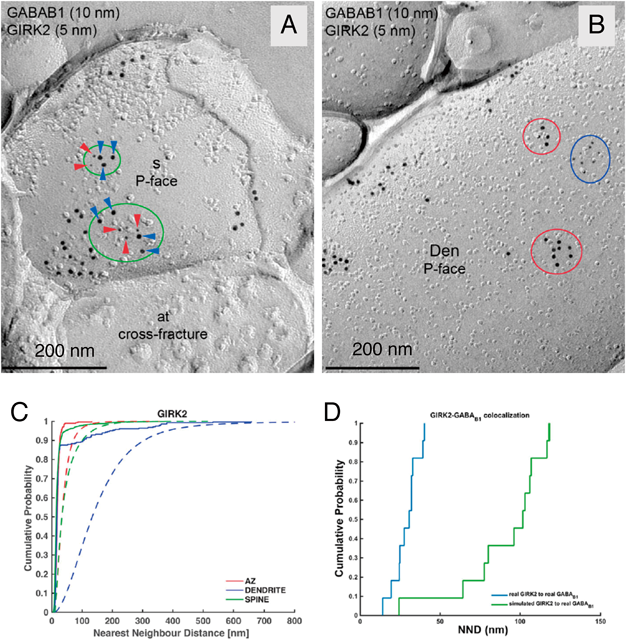
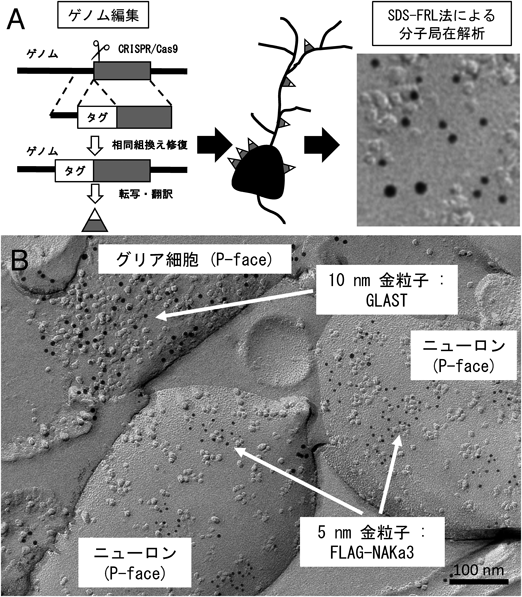
SDS-FRL法を用いたシナプス伝達関連膜分子の定量的局在解析Quantitative localization of neurotransmitter receptors and ion channels on the neuronal plasma membrane by SDS-digested Freeze-fracture Replica Labeling
1 福井大学・医学部・脳形態機能学分野・准教授Assocuate Professor, Division of Brain Structure & Function, Faculty of Medical Science, University of Fukui ◇ 〒910–1193 福井県吉田郡永平寺町松岡下合月23–3 ◇ 23–3 Matsuoka-Shimoaizuki, Eiheiji, Yoshida 910–1193, Japan
2 福井大学・医学部・脳形態機能学分野・教授Profssor, Division of Brain Structure & Function, Faculty of Medical Science, University of Fukui ◇ 〒910–1193 福井県吉田郡永平寺町松岡下合月23–3 ◇ 23–3 Matsuoka-Shimoaizuki, Eiheiji, Yoshida 910–1193, Japan