骨格筋は,人体最大の臓器であり,体重の約40%を占めている.骨格筋は,運動機能を発揮する上で必須の役割を果たしている他,糖代謝やエネルギー産生などの代謝の観点からも重要な働きを担っている.食後の血糖値上昇に伴い,膵臓からインスリンが分泌され,血中グルコースが組織に取り込まれて減少するが,この血中グルコースレベル減少の70~80%は骨格筋による取り込みによって達成されている.また,運動は代謝機能改善に伴う糖尿病の治療効果を有する他,心血管疾患の予防やアルツハイマー病を含む認知症の予防効果を有するなど,さまざまな有益な効果を発揮する.少なくともこれらの効果の一部は,運動に伴い骨格筋や他の組織から分泌される多様な分泌因子によって説明されている.したがって,骨格筋量や骨格筋機能を維持することは,身体活動だけでなく全身の健康を維持する上できわめて重要である.
超高齢社会に突入したわが国において,高齢者の生活の質の改善や健康寿命の延伸は重要な課題である.わが国の総人口に占める高齢者の割合は,2020年9月の時点で28.7%となっている.内閣府の令和元年度版高齢社会白書によると,高齢化率は2025年には30%に達し,20年後の2040年には35%を超えると予想されている.今後,日本人人口が減少することは確実視されているが,高齢者数は今後45年間変わらず,3500万人前後で推移し,75歳以上の後期高齢者に限るとその数は現在よりも増え,2050~2060年には2300~2400万人程度になると推計されている.日本の平均寿命は年々向上している一方,日常的な介護を必要としない自立した生活ができる健康寿命と平均寿命には,男性で9年,女性で12年程度の隔たりがあり,男女とも10年程度は要介護の状態になってしまうのが現状である.
サルコペニアは全身の筋量や筋力の減少が進行する病態で,身体機能障害や生活の質の低下,死のリスクを伴う症候群である.サルコペニアは加齢による一次性サルコペニアと,加齢以外に疾病等の原因がある二次性サルコペニアに区別されている.サルコペニアに伴う運動機能の低下は転倒による骨折の原因ともなっており,骨折に伴う入院はさらなる筋萎縮を招き,寝たきりなどの要介護状態の原因になりうる.一方,筋量は高齢になっても適切な食事と運動によって,維持・増強が十分に期待できるため,食を含む適切な生活習慣によるサルコペニアの予防は健康寿命の延伸にきわめて重要である.
世界的にも多くの先進国で高齢化が進むとことが予想される.骨格筋は全身の健康状態を維持する上で重要であることから,骨格筋の機能維持の分子機序の理解とそれに基づく筋萎縮の予防や治療法の開発は世界的な課題といって過言ではない.臨床的,栄養学的知見よりステロール代謝やそれに関連するメタボライト(代謝産物)が骨格筋機能に重要な役割を果たしていることが明らかになってきている.本稿では,メバロン酸経路を含むステロール代謝やステロールメタボライトを介した骨格筋の恒常性維持機構を中心に概説するとともに,これらを標的とする食品成分の機能解析について紹介する.なお,ステロイドホルモンも重要なステロール代謝産物であり,骨格筋恒常性に重要な役割を果たしているが,食・栄養がテーマの特集であることから,本稿ではステロイドホルモンについて取り上げない.
コレステロールは我々にとって必須の脂質分子であり,生体内で重要な役割を果たす一方,その恒常性異常は種々の先天的および後天的な疾患で認められる1).コレステロールは,生体膜を構成する重要な脂質であり,膜の構造や機能を制御している2).特に,脂質ラフトと呼ばれるコレステロールに富む細胞膜ドメインはシグナル伝達やエンドサイトーシス,細胞運動能などに重要な役割を果たしている.また,コレステロールはステロイドホルモンや胆汁酸,酸化ステロールの前駆体としても機能している.したがって,コレステロール代謝は細胞レベルおよび個体レベルで厳密に調節されている.
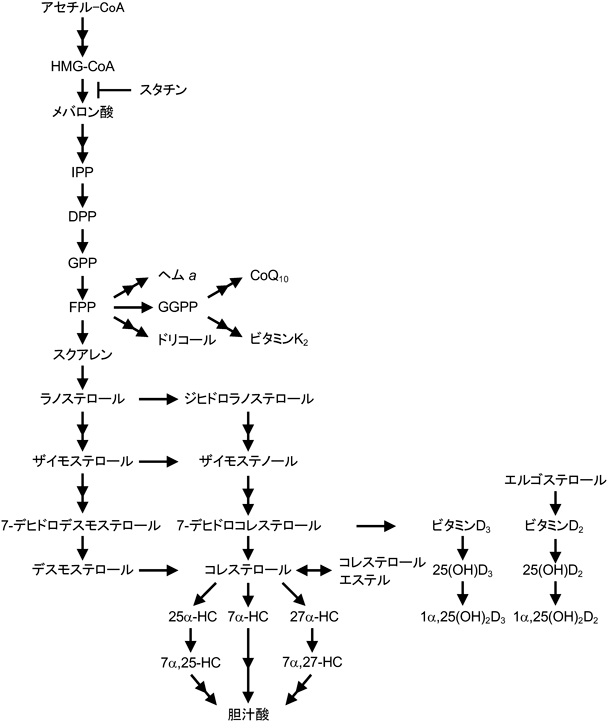
細胞は,コレステロールをde novo合成と細胞外からの取り込みによって獲得する.ヒトの肝臓では,1日あたり約1 gのコレステロールが合成される.コレステロールは非常に複雑かつエネルギーを要する過程を経て合成される.コレステロール合成は,アセチルCoAを出発物質として,30以上の酵素と18 ATPを要する反応である(図1).コレステロール合成は,アセチルCoAとアセトアセチルCoAの縮合によるHMG-CoAの産生から始まる.次いで,HMG-CoAはNADPH依存的にHMG-CoA還元酵素(HMG-CoA reductase:HMGCR)によってメバロン酸に還元される.HMGCR活性は複数の経路で厳密に調節されており,この酵素反応はコレステロール合成の律速段階となっている.メバロン酸は2段階のリン酸化を受け,メバロン酸二リン酸に変換され,さらに,炭素数5のイソペンテニル二リン酸(isopentenyl diphosphate:IPP)に変換される.IPPはイソプレン単位からなるすべてのイソプレノイド化合物の前駆体となる.IPPはジメチルアリル二リン酸(dimethylallyl diphosphate:DPP)に変換され,これにIPPが縮合し,炭素数10のゲラニル二リン酸(geranyl diphosphate:GPP),炭素数15のファルネシル二リン酸(farnesyl diphosphate:FPP)が順に合成され,2分子のFPPから炭素数30のスクアレンが合成される.スクアレンは,コレステロール合成過程で合成される最初のステロールであるラノステロールに変換され,さらに18以上の酵素反応を経てコレステロールへと変換される3).
コレステロール合成過程では,生理的に重要な複数の中間体が合成される(図1).メバロン酸経路で合成されるFPPは,生理活性を有する複数の重要なイソプレノイド化合物の前駆体となっている.FPPはドリコールやヘムの,FPPにIPPが縮合したゲラニルゲラニル二リン酸(geranylgeranyl diphosphate:GGPP)はコエンザイムQ10(CoQ10)やビタミンK2(メナキノン-4)の前駆体でもある(表1).また,FPPやGGPPは,低分子量GTPaseタンパク質などのC末端のシステイン残基に共有結合し,修飾タンパク質の膜への結合に寄与している.さらに,中間体ステロールである7-デヒドロコレステロールは,プロビタミンD3とも呼ばれ,ビタミンDの前駆体としても機能する.
表1 骨格筋で機能する代表的なメバロン酸経路・ステロール代謝産物とその生理活性| メタボライト | 機能・標的 | 骨格筋での役割 |
|---|
| FPP | 低分子量GTPaseなどのファルネシル化 | 低分子量GTPaseの膜アンカリング |
| GGPP | 低分子量GTPaseなどのゲラニルゲラニル化 | 低分子量GTPaseの膜アンカリング |
| ドリコール | 糖鎖供与体基質 | タンパク質のN型糖鎖修飾 |
| ヘムa | シトクロームcオキシダーゼの補欠分子族 | ミトコンドリアでのATP産生 |
| CoQ10(ユビキノン) | 電子伝達系 | ミトコンドリアでのATP産生 |
| コレステロール | ERRαリガンド | 筋障害の抑制 |
| デスモステロール | LXRリガンド | コレステロール・脂肪酸・糖代謝 |
| 25-HC, 27-HC | LXRリガンド | コレステロール・脂肪酸・糖代謝 |
| 1α,25(OH)2D | VDRリガンド | 筋肥大,筋量維持 |
| 胆汁酸 | TGR5リガンド | 筋肥大,筋分化 |
ステロール骨格は,我々の体の中で分解されない.コレステロールは,酸化ステロールやコレステロールエステルに代謝される.酸化ステロールは,コレステロール代謝恒常性を制御する重要なメディエーターとして機能している.肝臓では,CYP7A1によってコレステロールの7位が水酸化された7α-hydroxycholesterol(7α-HC)が胆汁酸の主要な前駆体として産生される.CYP27A1によって産生される27-HCやCholesterol 25-hydroxylase(CH25H)によって産生される25-HCは,CYP7B1によってそれらの7位が水酸化され,それぞれ7α,27-HCと7α,25-HCに変換される.そして,これらの酸化ステロールは多段階の酵素反応を経て,胆汁酸に変換される4)(図1).CYP7A1は肝臓に特異的に発現しており,胆汁酸合成の律速酵素である.
コレステロール合成に関与するほぼすべての酵素遺伝子と細胞外からのコレステロール取り込みを担うlow-density lipoprotein(LDL)受容体の発現は,転写因子Sterol regulatory element-binding protein(SREBP,主にSREBP-1aとSREBP-2)によって制御されている5).2回膜貫通ドメインを有するSREBPは,前駆体としてSREBP cleavage activating protein(SCAP)とInsigと複合体を形成し,小胞体に局在している.小胞体コレステロールレベルが減少すると,SCAPのコンホメーションが変化してInsigが複合体から乖離し,SREBP-SCAP複合体はCOP-II経路によってゴルジ体に輸送される.ゴルジ体に輸送されたSREBPは2種類のプロテアーゼ(Site-1 ProteaseとSite-2 Protease)によって切断を受け,活性型ドメインが細胞質中に放出され,核内に移行し,標的遺伝子の転写を活性化する6).一方,25-HCなどの側鎖に水酸基を持つ酸化ステロールは,Insigのユビキチン化とそれに伴うプロテアソーム分解を抑制し,安定化させることで,SREBP-SCAP複合体を小胞体にとどめ,SREBPの活性化を抑制する7).SREBP活性化は複雑な細胞内コレステロール輸送を介した小胞体コレステロールレベルの調節や酸化ステロールの産生の他,複数のシグナル伝達経路によって制御されているが,その詳細は不明な部分も多い8, 9).
胆汁酸合成の律速酵素であるCYP7A1の発現は,胆汁酸によって負に制御されている.この制御には複数の核内受容体が複雑に関与している.胆汁酸はファルネソイドX受容体(farnesoid X receptor:FXR)の内因性リガンドであり,胆汁酸によって活性化されたFXRは,CYP7A1の転写を活性化する核内受容体LRH-1の活性を抑制する別の核内受容体SHP-1の発現を誘導する10, 11).この複雑なカスケード機構によって,胆汁酸合成は最終産物である胆汁酸によって負のフィードバック制御を受ける.
脂質異常症の代表的な治療薬であるスタチンは,動脈硬化性の心血管イベントのリスクを低減する.スタチンは,コレステロール合成の律速酵素であるHMGCRの阻害剤の総称で,現在のところ,7種類のスタチン(アトルバスタチン,シンバスタチン,ピタバスタチン,フルバスタチン,プラバスタチン,ロスバスタチン,ロバスタチン)が上市されている.最初に開発されたスタチンであるコンパクチンは,三共株式会社(現第一三共株式会社)の遠藤章博士らによって青カビから発見され12),その功績により遠藤章博士は,2008年のラスカー賞(臨床医学研究)や2017年のガードナー国際賞などを受賞されている.スタチンは,主に肝臓におけるコレステロール合成を抑制し,その結果,SREBPの活性化を介したLDL受容体の発現上昇に伴い,血中LDL低下を引き起こす13).心血管疾患に対するスタチンの有用性はきわめて優れている一方,最も重篤な副作用として,横紋筋融解症が知られている14).横紋筋融解症は骨格筋細胞が障害を受けて壊死することで,筋細胞成分であるミオグロブリンが血液中に流出する病態で,重篤な場合,急性腎不全を来し,死に至る場合もある.セリバスタチンは上市されたものの,特にフィブラート系薬剤との併用で重篤な横紋筋融解症が多く発症し,死亡する症例も複数報告されたことから,販売が中止となった.スタチンによるスタチン関連筋症状(statin-associated muscle symptom:SAMS)は,重篤な横紋筋融解症だけでなく,比較的軽微な筋痛等も含まれ,少なくないスタチン服用者にSAMSが認められる15, 16).そのため,SAMSはスタチンの服用を続けられなくなるスタチン不耐の主な原因にもなっており,その発症予防は重要な課題であり,スタチンによる筋毒性の発症機序は活発な研究対象となっている.骨格筋特異的なHMGCR欠損マウスが作製され,横紋筋融解症に似たミオパチーを発症することから,HMGCR阻害がスタチン依存的な筋毒性の主要な原因であることが示されている17).また,骨格筋特異的なHMGCR欠損マウスにメバロン酸を経口投与することで,ミオパチーが回復することから,骨格筋におけるHMGCR活性およびメバロン酸経路代謝産物が筋機能にきわめて重要な役割を果たしていることが示された17).SAMSの発症機序は不明な点も多く残されているが,以下のように複数の分子機構が示唆されている.
筋特異的に発現するE3ユビキチンリガーゼであるAtrogin-1(MAFbx, Fbxo32とも呼ばれる)とMuRF1(TRIM63とも呼ばれる)は筋タンパク質の分解を誘導する主要なユビキチンリガーゼであり,筋萎縮を惹起する重要な分子である18).どちらも骨格筋の筋繊維構成タンパク質や筋分化に関与する転写因子などをユビキチン化し,分解する役割を持つ.培養筋管細胞において,スタチンはAtrogin-1の発現を誘導し,筋萎縮を惹起する.興味深いことに,Atrogin-1欠損マウス由来の筋管細胞では,スタチン依存的な筋萎縮は認められない19).また,スタチン依存的な筋障害はメバロン酸経路メタボライトであるGGPP依存的であることが示されている20).
骨格筋量は,主にタンパク質の合成と分解のバランスによって保たれている.タンパク質合成は主に,Akt-mTORC1シグナルによって正に制御されている.スタチンはAktシグナルを阻害するとともに,タンパク質合成も抑制することが報告されている15).
Aktシグナルによって制御される代表的な転写因子としてFoxOが知られている.AktはFoxOを直接リン酸化することで,その活性を負に制御している.特に,FoxO3はAtrogin-1の発現を誘導するとともに,複数のオートファジー関連因子の発現も誘導し,オートファジーを活性化することで,骨格筋タンパク質の分解を亢進させることが示されている21–23).しかしながら,オートファジーは骨格筋恒常性を維持する上でも重要な役割を果たしており,オートファジーに必須のAtg7を骨格筋特異的に欠失させたマウスでは筋萎縮が生じる24).また,オートファジーがスタチン依存的な筋障害を軽減することも報告されている25).オートファジーには細胞内オルガネラを特異的に分解する選択的オートファジーもあるため,オートファジーの“質”と“量”のバランスが骨格筋の恒常性維持に重要であると考えられるが,その詳細はわかっていない.
さらに,スタチンはミトコンドリア機能を阻害することも報告されている15).スタチンによる筋細胞障害はGGPPによって抑制できるので,GGPP代謝産物であるCoQ10の合成が阻害されることによるものと考えられている.しかしながら,スタチン服用患者へのCoQ10の補充療法が実施されているが,その効果について結論は得られていない16, 26).また,特定のスタチンの代謝産物であるラクトン体がミトコンドリアの複合体IIIを阻害することも報告されている27).
以上のように,メバロン酸経路およびその代謝産物は骨格筋機能にきわめて重要な役割を果たしている.メバロン酸経路の抑制は,骨格筋恒常性に重要なタンパク質の合成と分解のバランスを崩し,筋萎縮を惹起すると考えられ,メバロン酸経路が骨格筋恒常性に重要な役割を果たしていることがわかる.
4. コレステロールおよび酸化ステロールと骨格筋機能
コレステロールはSCAPに結合することでそのコンホメーションを変化させ,SREBPの活性化を負に制御している.一方,コレステロールが直接,転写因子に作用することは最近まで報告がなかった.2016年に核内受容体の一つエストロゲン関連受容体(estrogen-related receptor:ERR)αがコレステロールを内因性リガンドとすることが報告された28).コレステロールは,ERRαのリガンド結合ドメインに結合し,その標的遺伝子の転写を活性化する.興味深いことに,C2C12細胞において,スタチンによるAtrogin-1の発現誘導がコレステロールによって抑制されるだけでなく,ERRαアンタゴニストがAtrogin-1の発現を誘導することが報告された28).また,ERRα欠損マウスでは,筋損傷のマーカーとなる血清クレアチンキナーゼレベルが上昇し,筋損傷が認められる一方,スタチンによるさらなる筋損傷は引き起こされないことが示されている28).以上のことから,骨格筋恒常性において,ERRαおよびその内因性リガンドであるコレステロールも重要な役割を果たしていることが示唆されている.
コレステロール側鎖が水酸化された酸化ステロールは,核内受容体である肝臓X受容体(liver X receptor:LXR)のリガンドである.また,コレステロール中間体のデスモステロールもLXRの内因性リガンドである29).一般にLXRは,末梢組織から肝臓へコレステロールを輸送するコレステロール逆転送系で機能するABCA1やABCG1, apoEの他,脂肪酸代謝に関与する遺伝子の発現を制御するSREBP-1cなどの発現を制御する29).骨格筋では主にLXRβが発現している30).骨格筋特異的なLXR欠損マウスの報告はこれまでにないが,LXRが骨格筋のコレステロールや脂肪酸,糖代謝に重要な役割を果たしていることが示唆されている.LXRの合成リガンドを用いた実験から,LXRはマウス骨格筋やヒトおよびマウス筋管細胞において,SREBP-1cやABCA1などの代表的なLXR標的遺伝子の他,血中グルコースの取り込みに関与する主要なグルコーストランスポーターであるGLUT4や,ミトコンドリア脱共役タンパク質であるuncoupling protein 2(UCP2)やUCP3の発現も活性化することが報告されている30–32).このようにLXRは骨格筋における脂質代謝や糖代謝に重要な役割を果たしていることから,LXRの内因性リガンドである酸化ステロールやデスモステロールがLXRを介して骨格筋の代謝を制御していることは十分に考えられる.
ビタミンDは,ステロール代謝産物の一つであり,コレステロール合成中間体の7-デヒドロコレステロールは,プロビタミンD3とも呼ばれる.また,酵母やカビ,シイタケ等に含まれるエルゴステロールは,プロビタミンD2として知られる.これらのステロールは,紫外線によって9位と10位の間で開裂が起き,プレビタミンDに変換され,さらに異性化によってビタミンD3(コレカルシフェロール)とビタミンD2(エルゴカルシフェロール)へと変換される.これらは,肝臓においてCYP2R1(vitamin D 25-hydroxylase)によって25位が水酸化され,25-ヒドロキシビタミンD(25-hydroxyvitamin D:25(OH)D)となり,さらにCYP27B1によって1位が水酸化され,活性型ビタミンD3もしくは活性型ビタミンD2である1α,25-ジヒドロキシビタミンD3(1α,25-dihydroxyvitamin D3: 1α,25(OH)2D3)もしくは1α,25(OH)2D2に変換される.1α,25(OH)2Dは,核内受容体ビタミンD受容体(vitamin D receptor:VDR)の内因性リガンドであり,そのリガンド結合ドメインに結合し,標的遺伝子の転写を活性化する.
ビタミンD欠乏症ではミオパチーが認められることが古くから知られている.また,疫学的研究から血中25(OH)Dレベルと筋量や筋力の間に正の相関があることや,高齢者においてビタミンD欠乏とサルコペニアに相関関係があることが示されている33).しかしながら,骨格筋に対するビタミンDの直接的な作用については不明な点が残されている.最近,骨格筋特異的なVDR欠損マウスが開発され,このマウスでは筋量や筋力の低下とともに,体脂肪量の増加が認められることが報告された34).また,エレクトロポレーション法による一過的なラット骨格筋へのVDRの過剰発現がタンパク質合成と筋肥大を惹起することが示された35).さらに,ヒト骨格筋細胞において,1α,25(OH)2D3が筋分化マーカーの発現増加やAkt-mTORC1シグナルの増強,タンパク質合成の亢進を引き起こすことが示されている36).これらの報告から活性型ビタミンDおよびVDRは筋量や筋力を正に制御する重要な因子であると考えられる.
肝臓でコレステロールから異化された胆汁酸は,胆汁の主要な構成成分として胆嚢に蓄えられる.胆汁酸は食事に際し胆嚢から十二指腸に分泌され,脂質や脂溶性ビタミン類とミセルを形成することにより,その消化・吸収を助ける役割を担う.その後,胆汁酸の約95%は主に小腸下部において吸収され,門脈を経由して再び肝臓へと取り込まれる.この腸肝循環と呼ばれる胆汁酸輸送サイクルの過程で一部の胆汁酸は肝臓での再吸収を免れるため,食後は血中胆汁酸濃度が一時的に上昇することが知られている37).このような性質から,胆汁酸は単に脂溶性栄養素の消化・吸収を促進するだけでなく,全身に摂食シグナルを伝達するシグナル分子としての一面も併せ持っている.
TGR5は胆汁酸をリガンドとするGタンパク質共役受容体の一種であり,全身に広く発現が認められる38, 39).TGR5に胆汁酸が結合すると,cAMPをセカンドメッセンジャーとしてプロテインキナーゼA(protein kinase A:PKA)の活性化が誘導され,さまざまな代謝プロセスに影響を及ぼす.たとえば,熱産生細胞として知られる褐色脂肪細胞において,TGR5の活性化によりiodothyronine deiodinase 2(Dio2)やUCP1といった熱産生遺伝子の発現が増大し,エネルギー消費を促進することがヒト,マウスで確認されている40, 41).実際,マウスを高脂肪食で長期飼育する際,餌に0.5%の胆汁酸を加えることで体重の増加が顕著に抑制される40).またTGR5合成アゴニストINT-777を投与したマウスでは,本来は余剰エネルギーを蓄積する役割を担う白色脂肪細胞においてもUCP1など複数の熱産生遺伝子の発現上昇を誘導し,熱産生能を有するベージュ細胞へとリモデリングすることも報告されている42).一方,小腸L細胞に発現するTGR5が胆汁酸により刺激されると,消化管ホルモンの一種であるglucagon-like peptide-1(GLP-1)の分泌が促される43, 44).GLP-1は,膵臓に発現するGLP-1受容体に作用することでインスリンの分泌を促進し,これにより過度な血糖値の上昇を抑制する.以上のように,胆汁酸はさまざまな組織に発現するTGR5を介して全身の代謝をコントロールすることが知られており,それゆえTGR5は抗肥満・抗糖尿病のターゲット分子として注目を集めている.
TGR5は上記の組織の他,骨格筋にも発現が認められる.食は骨格筋量を制御する重要な要素であることから,我々はTGR5が食と骨格筋機能を仲介する因子として働く可能性があると考え,遺伝子改変マウスを用いてその検証を行った.その結果,TGR5欠損マウスは野生型(WT)マウスと比較して骨格筋量が6~10%程度減少し,それに応じて筋力も5%以上低下することが示された.さらに骨格筋特異的TGR5トランスジェニック(mTg)マウスを作製し,骨格筋への影響を解析したところ,TGR5-mTgマウスはWTマウスに比べて筋重量が有意に増大していることを見いだした.その増加率は腓腹筋で9.5%,大腿四頭筋で14.6%にも及んだ.また,TGR5-mTgマウスは若齢期(2か月齢)から高齢期(21か月齢)まで一貫して筋力が増大しており,TGR5シグナルの増強が高齢個体の筋力維持にも効果的であることが示された45).
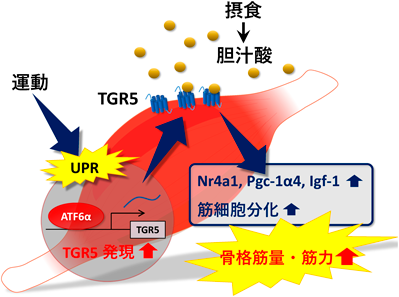
続いてTGR5が筋肥大を誘導する分子メカニズムを明らかにするため,TGR5-mTgマウスに対して胆汁酸を筋肉注射し,主要な筋肥大関連遺伝子の発現を測定した.その結果,胆汁酸投与から3時間以内に筋肥大遺伝子として知られる核内受容体Nr4a1や転写コアクチベーターperoxisome proliferator-activated receptor γ coactivator-1α4(Pgc-1α4)のmRNA発現増大が確認され,胆汁酸投与から8時間後にはこれらのターゲット遺伝子であり骨格筋のタンパク質合成を促すinsulin-like growth factor-1(Igf-1)の発現増大が認められた.転写因子cAMP response element binding protein(CREB)はNr4a1やPgc-1α4の発現を制御する主要な因子であることが知られており,PKAによるリン酸化修飾を受けることで活性化する.TGR5が胆汁酸刺激によりcAMP-PKA経路を活性化することを踏まえると,Nr4a1やPgc-1α4の発現増大は過去の知見とも矛盾しない結果である.また培養骨格筋細胞C2C12を用いた実験からは,TGR5の活性化により筋細胞分化が亢進することも示されている45).したがってTGR5は,Nr4a1やPgc-1α4の発現増大を介した筋タンパク質の合成亢進,そして筋細胞分化促進といった複合的な要因により骨格筋量の増大に寄与すると考えられる.
さらにTGR5の発現制御機構に関して研究を進めたところ,マウスに対しトレッドミル走行運動を負荷することで骨格筋におけるTGR5の発現量が増大することを見いだした.この応答には運動により生じる小胞体ストレス応答(unfolded protein response:UPR)を制御する転写因子activating transcription factor 6α(ATF6α)が不可欠であり,TGR5遺伝子の5′上流領域にATF6α応答配列も見いだしている45).これらのデータは,運動によるTGR5発現亢進と食事による血中胆汁酸濃度の上昇が相乗的に骨格筋肥大を誘導する可能性を示している(図2).
さらに,我々はTGR5が骨格筋エネルギー代謝に及ぼす影響を解析するため,WTとTGR5-mTgマウスを用いて呼気ガス分析を行った.その結果,単位時間あたりのエネルギー消費量に関しては両マウス間で差がなかったが,呼吸交換比はTGR5-mTgマウスにおいて有意な増加を認めた.これはTGR5-mTgマウスがエネルギー源としてグルコースを積極的に利用していることを示している.さらにWTマウスおよびTGR5-mTgマウスを高脂肪食で長期飼育したところ,体重の増加量は両群間で同等であったが,TGR5-mTgマウスはWTマウスと比べて耐糖能試験の成績が良好であった.高脂肪食により生じる耐糖能異常は,骨格筋を含む末梢組織への脂肪蓄積と,それに伴うインスリン抵抗性の発症が主要な原因とされているが,高脂肪食飼育後のWTマウスとTGR5-mTgマウスの骨格筋においてインスリン感受性を比較したところ,有意な差は認められなかった.以上の結果より,骨格筋においてTGR5はインスリン感受性とは無関係にグルコースクリアランスを改善することが示され,その一部には骨格筋の肥大化が影響していると考えられる.
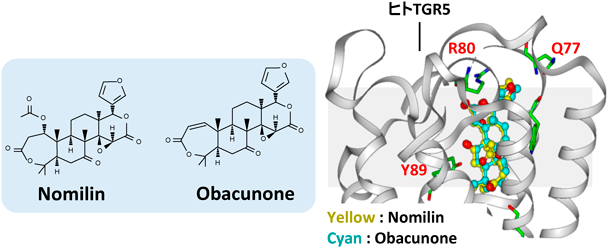
TGR5は熱産生やGLP-1分泌を亢進する働きを担うことから,肥満や糖尿病を予防・治療するための有望な分子標的とされているが,同時に骨格筋量や筋力の増大,そして骨格筋におけるグルコース利用の促進にも寄与することが明らかになった.TGR5アゴニスト活性を有する食品成分は肥満や糖尿病,サルコペニアに対して予防効果を有することが期待されるため,我々を含む多くの研究グループがその探索に取り組んでおり,すでにいくつかの食品成分がTGR5アゴニストとして報告されている.そのなかには植物由来のトリテルペン類が多く含まれており,代表的な例として,NomilinやObacunone, Betulinic acid, Ursolic acid,そしてOleanolic acidなどがあげられる46–48).我々がTGR5アゴニストとして見いだしたNomilinおよびObacunoneは柚子などの柑橘類に多く含まれるリモノイドの一種である.培養細胞を用いたレポーターアッセイの結果,Nomilinは胆汁酸の一種であるケノデオキシコール酸とほぼ同等のTGR5活性化能を有しており,またObacunoneもそれらに匹敵する活性を示した46).我々は,これらの柑橘成分が実際に抗肥満・抗糖尿病効果,あるいは筋肥大効果を発揮することを検証するため,動物実験を実施した.その結果,高脂肪食で飼育したマウスの餌に0.2%のNomilinを加えることで体重の増加が抑制され,同時にインスリン抵抗性が改善することが確認された46).さらに2型糖尿病モデルマウスとして知られるKK-Ayマウスに対し0.1%のObacunoneを含むエサを与えると,空腹時血糖値やHbA1cが低下し,骨格筋重量が有意に増大した49).以上の結果からNomilinやObacunoneは代謝改善効果や筋肥大効果を有しており,少なくともその一部はTGR5のアゴニスト活性が関与していると考えられる.興味深いことに,NomilinやObacunoneが発揮するTGR5アゴニスト活性には動物種差が認められ,これらの柑橘成分はマウスTGR5に比べてヒトTGR5をより強く活性化する.これはヒトTGR5とNomilinあるいはObacunoneが相互作用する際に重要なアミノ酸残基(Q77, R80, Y89)がマウスTGR5において保存されていないことが原因であり(図3)50),これらの食品成分はヒトに対してより強い活性を示すことが期待される.
今後数十年にわたり高齢化がさらに進行することが予想され,「人生100年時代」が叫ばれるわが国において,健康寿命の延伸はきわめて重要な課題である.それゆえ,サルコペニアの予防法や治療法の確立が急がれているものの,現時点で高齢者の筋機能の維持・改善は容易ではない.科学的なエビデンスに基づいた効果的なサルコペニア予防法を確立するためにも,骨格筋の機能維持機構やサルコペニア発症機序の解明に大きな期待が寄せられている.
本稿では,骨格筋の恒常性維持におけるステロール代謝およびそのメタボライトの重要性について概説した.メバロン酸経路を含むステロール代謝経路には骨格筋恒常性に重要な役割を果たしているメタボライトが複数あり,その代謝異常が筋萎縮や筋障害を引き起こすことが明らかになっている.イソプレノイド化合物やビタミンD, TGR5アゴニストは食品成分にも多く含まれており,これらの適切な摂取は,骨格筋恒常性の維持に資すると期待される.しかしながら,ステロール代謝やその代謝産物による骨格筋恒常性の分子機構は不明な点が多く,より詳細な解析が必要である.
また,本稿で取り上げた多くの細胞レベルの知見は,げっ歯類に由来するC2C12細胞株やL6細胞株,初代骨格筋細胞を用いた研究成果であり,ヒト骨格筋細胞を用いた研究は非常に少ない.NomilinやObacunoneのTGR5結合部位のアミノ酸配列がマウスとヒトで保存されていないように,当然,マウスとヒトではアミノ酸配列が異なるタンパク質は非常に多く存在する.医学的視点からだけではなく,食・栄養の視点から骨格筋恒常性について解析し,その成果を基礎から応用へと展開していく上で,ヒト骨格筋細胞を用いた解析はきわめて重要であると考えられる.現在,我々はヒトを想定した骨格筋の機能維持メカニズムの解明とその応用を目指し,ヒトiPS細胞を活用した研究に取り組んでいる.
引用文献References
1) Maxfield, F. & Tabas, I. (2005) Role of cholesterol and lipid organization in disease. Nature, 438, 612–621.
2) Ikonen, E. (2008) Cellular cholesterol trafficking and compartmentalization. Nat. Rev. Mol. Cell Biol., 9, 125–138.
3) Nes, W.D. (2011) Biosynthesis of cholesterol and other sterols. Chem. Rev., 111, 6423–6451.
4) Russell, D.W. (2009) Fifty years of advances in bile acid synthesis and metabolism. J. Lipid Res., 50(Suppl), S120–S125.
5) Horton, J., Goldstein, J., & Brown, M. (2002) SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. J. Clin. Invest., 109, 1125–1131.
6) Brown, M. & Goldstein, J. (2009) Cholesterol feedback: from Schoenheimer’s bottle to Scap’s MELADL. J. Lipid Res., 50(Suppl), S15–S27.
7) Gong, Y., Lee, J., Lee, P., Goldstein, J., Brown, M., & Ye, J. (2006) Sterol-regulated ubiquitination and degradation of Insig-1 creates a convergent mechanism for feedback control of cholesterol synthesis and uptake. Cell Metab., 3, 15–24.
8) Yamauchi, Y. & Rogers, M.A. (2018) Sterol Metabolism and Transport in Atherosclerosis and Cancer. Front. Endocrinol. (Lausanne), 9, 509.
9) Shimano, H. & Sato, R. (2017) SREBP-regulated lipid metabolism: convergent physiology-divergent pathophysiology. Nat. Rev. Endocrinol., 13, 710–730.
10) Goodwin, B., Jones, S.A., Price, R.R., Watson, M.A., McKee, D.D., Moore, L.B., Galardi, C., Wilson, J.G., Lewis, M.C., Roth, M.E., et al. (2000) A regulatory cascade of the nuclear receptors FXR, SHP-1, and LRH-1 represses bile acid biosynthesis. Mol. Cell, 6, 517–526.
11) Lu, T.T., Makishima, M., Repa, J.J., Schoonjans, K., Kerr, T.A., Auwerx, J., & Mangelsdorf, D.J. (2000) Molecular basis for feedback regulation of bile acid synthesis by nuclear receptors. Mol. Cell, 6, 507–515.
12) Endo, A. (2010) A historical perspective on the discovery of statins. Proc. Jpn. Acad., Ser. B, Phys. Biol. Sci., 86, 484–493.
13) Goldstein, J.L. & Brown, M.S. (2015) A century of cholesterol and coronaries: from plaques to genes to statins. Cell, 161, 161–172.
14) Collins, R., Reith, C., Emberson, J., Armitage, J., Baigent, C., Blackwell, L., Blumenthal, R., Danesh, J., Smith, G.D., DeMets, D., et al. (2016) Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet, 388, 2532–2561.
15) Ward, N.C., Watts, G.F., & Eckel, R.H. (2019) Statin Toxicity Mechanistic Insights and Clinical Implications. Circ. Res., 124, 328–350.
16) Thompson, P.D., Panza, G., Zaleski, A., & Taylor, B. (2016) Statin-Associated Side Effects. J. Am. Coll. Cardiol., 67, 2395–2410.
17) Osaki, Y., Nakagawa, Y., Miyahara, S., Iwasaki, H., Ishii, A., Matsuzaka, T., Kobayashi, K., Yatoh, S., Takahashi, A., Yahagi, N., et al. (2015) Skeletal muscle-specific HMG-CoA reductase knockout mice exhibit rhabdomyolysis: A model for statin-induced myopathy. Biochem. Biophys. Res. Commun., 466, 536–540.
18) Bodine, S.C., Latres, E., Baumhueter, S., Lai, V.K.M., Nunez, L., Clarke, B.A., Poueymirou, W.T., Panaro, F.J., Na, E.Q., Dharmarajan, K., et al. (2001) Identification of ubiquitin ligases required for skeletal muscle atrophy. Science, 294, 1704–1708.
19) Hanai, J.I., Cao, P., Tanksale, P., Imamura, S., Koshimizu, E., Zhao, J.H., Kishi, S., Yamashita, M., Phillips, P.S., Sukhatme, V.P., et al. (2007) The muscle-specific ubiquitin ligase atrogin-1/MAFbx mediates statin-induced muscle toxicity. J. Clin. Invest., 117, 3940–3951.
20) Cao, P.R., Hanai, J., Tanksale, P., Imamura, S., Sukhatme, V.P., & Lecker, S.H. (2009) Statin-induced muscle damage and atrogin-1 induction is the result of a geranylgeranylation defect. FASEB J., 23, 2844–2854.
21) Mammucari, C., Milan, G., Romanello, V., Masiero, E., Rudolf, R., Del Piccolo, P., Burden, S.J., Di Lisi, R., Sandri, C., Zhao, J., et al. (2007) FoxO3 controls autophagy in skeletal muscle in vivo. Cell Metab., 6, 458–471.
22) Zhao, J., Brault, J.J., Schild, A., Cao, P., Sandri, M., Schiaffino, S., Lecker, S.H., & Goldberg, A.L. (2007) FoxO3 coordinately activates protein degradation by the Autophagic/Lysosomal and proteasomal pathways in atrophying muscle cells. Cell Metab., 6, 472–483.
23) Sandri, M., Sandri, C., Gilbert, A., Skurk, C., Calabria, E., Picard, A., Walsh, K., Schiaffino, S., Lecker, S.H., & Goldberg, A.L. (2004) Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy. Cell, 117, 399–412.
24) Masiero, E., Agatea, L., Mammucari, C., Blaauw, B., Loro, E., Komatsu, M., Metzger, D., Reggiani, C., Schiaffino, S., & Sandri, M. (2009) Autophagy Is Required to Maintain Muscle Mass. Cell Metab., 10, 507–515.
25) Ramesh, M., Campos, J.C., Lee, P., Song, Y., Hernandez, G., Sin, J., Tucker, K.C., Saadaeijahromi, H., Gurney, M., Ferreira, J.C.B., et al. (2019) Mitophagy protects against statin-mediated skeletal muscle toxicity. FASEB J., 33, 11857–11869.
26) Qu, H., Guo, M., Chai, H., Wang, W.T., Gao, Z.Y., & Shi, D.Z. (2018) Effects of Coenzyme Q10 on Statin-Induced Myopathy: An Updated Meta-Analysis of Randomized Controlled Trials. J. Am. Heart Assoc., 7, 7.
27) Schirris, T.J.J., Renkema, G.H., Ritschel, T., Voermans, N.C., Bilos, A., van Engelen, B.G.M., Brandt, U., Koopman, W.J.H., Beyrath, J.D., Rodenburg, R.J., et al. (2015) Statin-Induced Myopathy Is Associated with Mitochondrial Complex III Inhibition. Cell Metab., 22, 399–407.
28) Wei, W., Schwaid, A.G., Wang, X.Q., Wang, X.D., Chen, S.L., Chu, Q., Saghatelian, A., & Wan, Y.H. (2016) Ligand Activation of ERR alpha by Cholesterol Mediates Statin and Bisphosphonate Effects. Cell Metab., 23, 479–491.
29) Wang, B. & Tontonoz, P. (2018) Liver X receptors in lipid signalling and membrane homeostasis. Nat. Rev. Endocrinol., 14, 452–463.
30) Hessvik, N.P., Boekschoten, M.V., Baltzersen, M.A., Kersten, S., Xu, X., Andersen, H., Rustan, A.C., & Thoresen, G.H. (2010) LXR beta is the dominant LXR subtype in skeletal muscle regulating lipogenesis and cholesterol efflux. Am J Physiol-Endoc M, 298, E602–E613.
31) Muscat, G.E.O., Wagner, B.L., Hou, J.Z., Tangirala, R.K., Bischoff, E.D., Rohde, P., Petrowski, M., Li, J.L., Shao, G., Macondray, G., et al. (2002) Regulation of cholesterol homeostasis and lipid metabolism in skeletal muscle by liver X receptors. J. Biol. Chem., 277, 40722–40728.
32) Archer, A., Laurencikiene, J., Ahmed, O., Steffensen, K.R., Parini, P., Gustafsson, J.A., & Korach-Andre, M. (2014) Skeletal muscle as a target of LXR agonist after long-term treatment: focus on lipid homeostasis. Am J Physiol-Endoc M, 306, E494–E502.
33) Girgis, C.M., Clifton-Bligh, R.J., Hamrick, M.W., Holick, M.F., & Gunton, J.E. (2013) The roles of vitamin D in skeletal muscle: form, function, and metabolism. Endocr. Rev., 34, 33–83.
34) Girgis, C.M., Cha, K.M., So, B., Tsang, M., Chen, J., Houweling, P.J., Schindeler, A., Stokes, R., Swarbrick, M.M., Evesson, F.J., et al. (2019) Mice with myocyte deletion of vitamin D receptor have sarcopenia and impaired muscle function. J. Cachexia Sarcopenia Muscle, 10, 1228–1240.
35) Bass, J.J., Nakhuda, A., Deane, C.S., Brook, M.S., Wilkinson, D.J., Phillips, B.E., Philp, A., Tarum, J., Kadi, F., Andersen, D., et al. (2020) Overexpression of the vitamin D receptor (VDR) induces skeletal muscle hypertrophy. Mol. Metab., 42, 101059.
36) Romeu Montenegro, K., Carlessi, R., Cruzat, V., & Newsholme, P. (2019) Effects of vitamin D on primary human skeletal muscle cell proliferation, differentiation, protein synthesis and bioenergetics. J. Steroid Biochem. Mol. Biol., 193, 105423.
37) Schalm, S.W., LaRusso, N.F., Hofmann, A.F., Hoffman, N.E., van Berge-Henegouwen, G.P., & Korman, M.G. (1978) Diurnal serum levels of primary conjugated bile acids. Assessment by specific radioimmunoassays for conjugates of cholic and chenodeoxycholic acid. Gut, 19, 1006–1014.
38) Kawamata, Y., Fujii, R., Hosoya, M., Harada, M., Yoshida, H., Miwa, M., Fukusumi, S., Habata, Y., Itoh, T., Shintani, Y., et al. (2003) A G protein-coupled receptor responsive to bile acids. J. Biol. Chem., 278, 9435–9440.
39) Maruyama, T., Miyamoto, Y., Nakamura, T., Tamai, Y., Okada, H., Sugiyama, E., Itadani, H., & Tanaka, K. (2002) Identification of membrane-type receptor for bile acids (M-BAR). Biochem. Biophys. Res. Commun., 298, 714–719.
40) Watanabe, M., Houten, S.M., Mataki, C., Christoffolete, M.A., Kim, B.W., Sato, H., Messaddeq, N., Harney, J.W., Ezaki, O., Kodama, T., et al. (2006) Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation. Nature, 439, 484–489.
41) Broeders, E.P., Nascimento, E.B., Havekes, B., Brans, B., Roumans, K.H., Tailleux, A., Schaart, G., Kouach, M., Charton, J., Deprez, B., et al. (2015) The Bile Acid Chenodeoxycholic Acid Increases Human Brown Adipose Tissue Activity. Cell Metab., 22, 418–426.
42) Velazquez-Villegas, L.A., Perino, A., Lemos, V., Zietak, M., Nomura, M., Pols, T.W.H., & Schoonjans, K. (2018) TGR5 signalling promotes mitochondrial fission and beige remodelling of white adipose tissue. Nat. Commun., 9, 245.
43) Katsuma, S., Hirasawa, A., & Tsujimoto, G. (2005) Bile acids promote glucagon-like peptide-1 secretion through TGR5 in a murine enteroendocrine cell line STC-1. Biochem. Biophys. Res. Commun., 329, 386–390.
44) Thomas, C., Gioiello, A., Noriega, L., Strehle, A., Oury, J., Rizzo, G., Macchiarulo, A., Yamamoto, H., Mataki, C., Pruzanski, M., et al. (2009) TGR5-mediated bile acid sensing controls glucose homeostasis. Cell Metab., 10, 167–177.
45) Sasaki, T., Kuboyama, A., Mita, M., Murata, S., Shimizu, M., Inoue, J., Mori, K., & Sato, R. (2018) The exercise-inducible bile acid receptor Tgr5 improves skeletal muscle function in mice. J. Biol. Chem., 293, 10322–10332.
46) Ono, E., Inoue, J., Hashidume, T., Shimizu, M., & Sato, R. (2011) Anti-obesity and anti-hyperglycemic effects of the dietary citrus limonoid nomilin in mice fed a high-fat diet. Biochem. Biophys. Res. Commun., 410, 677–681.
47) Genet, C., Strehle, A., Schmidt, C., Boudjelal, G., Lobstein, A., Schoonjans, K., Souchet, M., Auwerx, J., Saladin, R., & Wagner, A. (2010) Structure–activity relationship study of betulinic acid, a novel and selective TGR5 agonist, and its synthetic derivatives: potential impact in diabetes. J. Med. Chem., 53, 178–190.
48) Sato, H., Genet, C., Strehle, A., Thomas, C., Lobstein, A., Wagner, A., Mioskowski, C., Auwerx, J., & Saladin, R. (2007) Anti-hyperglycemic activity of a TGR5 agonist isolated from Olea europaea. Biochem. Biophys. Res. Commun., 362, 793–798.
49) Horiba, T., Katsukawa, M., Mita, M., & Sato, R. (2015) Dietary obacunone supplementation stimulates muscle hypertrophy, and suppresses hyperglycemia and obesity through the TGR5 and PPARgamma pathway. Biochem. Biophys. Res. Commun., 463, 846–852.
50) Sasaki, T., Mita, M., Ikari, N., Kuboyama, A., Hashimoto, S., Kaneko, T., Ishiguro, M., Shimizu, M., Inoue, J., & Sato, R. (2017) Identification of key amino acid residues in the hTGR5-nomilin interaction and construction of its binding model. PLoS One, 12, e0179226.
著者紹介Author Profile
 山内 祥生(やまうち よしお)
山内 祥生(やまうち よしお)東京大学大学院農学生命科学研究科応用生命化学専攻准教授.博士(医学).
略歴2000年日本学術振興会特別研究員.03年名古屋市立大学大学院医学研究科博士課程修了.同年Dartmouth Medical School博士研究員.06年日本学術振興会特別研究員.同年熊本大学医学薬学研究部助手.07年名古屋大学大学院医学系研究科助教,講師.16年東京大学大学院農学生命科学研究科特任准教授.19年より現職.
研究テーマと抱負多種多様なステロールの構造や機能,進化に興味を持っている.ステロール輸送,代謝制御,膜機能,細胞機能の連関の解明を目指しており,これらの研究を通じて医・食に共通する課題の克服に食の視点から貢献できればと考えている.
ウェブサイトhttp://www.park.itc.u-tokyo.ac.jp/food-biochem/
趣味低山登山とその後の温泉,サッカー観戦,音楽鑑賞.
 佐々木 崇(ささき たかし)
佐々木 崇(ささき たかし)東京大学大学院農学生命科学研究科応用生命化学専攻特任助教.博士(農学).
略歴2010年東北大学農学部卒業.12年東京大学大学院農学生命科学研究科修士課程修了.15年同研究科博士課程修了.同研究科博士研究員を経て16年より現職.
研究テーマと抱負骨格筋が担う運動器としての役割,そして代謝器官としての役割を分子レベルで解明し,これをコントロールすることを目指している.現在は食が骨格筋に及ぼす影響に注目した研究を展開中.
趣味街歩き.
 佐藤 隆一郎(さとう りゅういちろう)
佐藤 隆一郎(さとう りゅういちろう)東京大学大学院農学生命科学研究科応用生命化学専攻教授.
その他については本誌86巻3号(2014),p.366をご参照ください.