生活習慣病という表現を見聞きしない日はないといってよいほどだが,非感染性疾患(noncommunicable disease:NCD)という表現についてはいかがだろうか.私は数年間,コーデックス委員会の栄養・特殊用途食品部会や食品表示部会に参加する機会をいただき,国際食品規格の策定等を間近に見聞きすることができた.当初は会議の進捗を把握することもおぼつかない有様で,NCDといわれて即座には理解できなかったが,しばらく身を置いているとNCDという言葉を当たり前に感じられるようになってきた.
そもそもNCDは,心血管疾患・がん・慢性呼吸器疾患・糖尿病を含み,ヒトの健康維持において世界的な脅威となっている1)ことから,その予防と管理に関する行動計画が世界保健機関(WHO)によりまとめられ,2008~2013年のアクションプランに盛り込まれた2).このNCDのリスク低減のための栄養参照量(nutrition reference value:NRV)はNRV-NCDとして,特にNCDに関わるビタミンやミネラルなどの栄養素で策定されている3).日本でいうところの生活習慣病は1990年代中旬から使われ出した表現で,主に脳卒中・がん・心臓病を含み,それ以前には成人病といわれていたものである.
これらを踏まえると,NCDとは,生活習慣病に慢性呼吸器疾患を加えたものと考えてよさそうである.WHOによる当初のアクションプランには,NCD共通の危険因子として喫煙,アルコールの乱用,不健康な食事,運動不足および環境発がん物質があげられている.生活習慣病を予防する方策としては,アルコール,塩分,飽和脂肪,遊離糖の摂取を控えることや,運動の推進が推奨された.その後に策定された2013–2020アクションプラン4)でも引き続きNCDに関する取り組みが記されている.とりわけ肥満の予防・改善について重点が置かれ,これらが世界的な懸案であることがわかる.
肥満が関与する疾患は多様で,その中には脂肪肝もある.body mass index(BMI)の脂肪肝に対するオッズ比は6程度という報告がある5).アルコール摂取歴がないにもかかわらず,肝組織がアルコール性肝疾患に類似した脂肪肝炎は非アルコール性脂肪性肝炎(non-alcoholic steatohepatitis:NASH)と呼ばれ,炎症を示さない単純性脂肪肝(non-alcoholic fatty liver:NAFL)を含めて非アルコール性脂肪性肝疾患(non-alcoholic fatty liver disease:NAFLD)に分類される.これらの脂肪肝の鑑別については最終的には生検による組織学解析に委ねられる.現在,NAFLDという表記が定着した感はあるが,NASHを含め,その定義についてのコンセンサスが必ずしも得られていないとの指摘もある6).一方で,ウイルス性やアルコール性の脂肪肝を含めて代謝異常としての脂肪肝を代謝関連脂肪肝疾患(metabolic associated fatty liver disease)として総合的に見直す機運が高まりつつある7).最近のシステマティックレビューでは,脂肪肝の4割は非肥満であるとの報告がなされ,脂肪肝発症において肥満によらない代謝異常が無視できないことが示唆された8).アジア人の場合には脂肪肝でもBMIがそれほど高くないという報告9)は,肝脂質蓄積に関する代謝の人種差を示唆している.
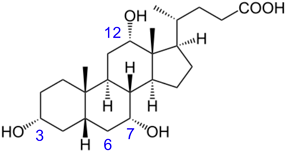
胆汁酸に関して,研究の歴史的経緯10),分析11),消化管での腸内細菌による代謝12),生理作用およびその機構13),疾患との関連14)などについて多くの総説があるのでそれらを参照いただきたい.胆汁酸は,肝臓においてコレステロールから作られる両親媒性分子であり,脂質の吸収に寄与する.ヒトの肝臓で作られる一次胆汁酸として,12α水酸基を有するコール酸(図1)とそれを持たないケノデオキシコール酸がある.12α水酸化胆汁酸(12α-hydroxylated bile acid:12αOH BA)と非12αOH BAの主な分子種を表1に示した.ラットやマウスなどの齧歯類では,ケノデオキシコール酸からミュリコール酸を合成する経路があり,cytochrome P450 2C70がこの反応に関わることが示されている15).結果としてラットやマウスでは,ヒトに比べて胆汁酸代謝がより複雑になる14).
表1 主な胆汁酸の一般名と系統名| 一般名 | 系統名 |
|---|
| 12α水酸化胆汁酸(12αOH BA) | |
| コール酸 | 5β-cholanic acid-3α,7α,12α-triol |
| デオキシコール酸 | 5β-cholanic acid-3α,12α-diol |
| ウルソコール酸 | 5β-cholanic acid-3α,7β,12α-triol |
| 7-オキソ-デオキシコール酸 | 5β-cholanic acid-3α,12α-diol-7-one |
| 12-オキソ-リトコール酸 | 5β-cholanic acid-3α-ol-12-one |
| 3-オキソ-12α-ヒドロキシ-5β-コラン酸 | 5β-cholanic acid-12α-ol-3-one |
| 非12α水酸化胆汁酸(非12αOH BA) | |
| ケノデオキシコール酸 | 5β-cholanic acid-3α,7α-diol |
| α-ミュリコール酸 | 5β-cholanic acid-3α,6β,7α-triol |
| β-ミュリコール酸 | 5β-cholanic acid-3α,6β,7β-triol |
| ω-ミュリコール酸 | 5β-cholanic acid-3α,6α,7β-triol |
| ヒオコール酸 | 5β-cholanic acid-3α,6α,7α-triol |
| ヒオデオキシコール酸 | 5β-cholanic acid-3α,6α-diol |
| ウルソデオキシコール酸 | 5β-cholanic acid-3α,7β-diol |
| リトコール酸 | 5β-cholanic acid-3α-ol |
| 7-オキソ-リトコール酸 | 5β-cholanic acid-3α-ol-7-one |
| 構造および推察される代謝経路に基づき,12αOH BAおよび非12αOH BAのグループ分けを行った.12αOH BAでの一次胆汁酸はコール酸,非12αOH BAでの一次胆汁酸はケノデオキシコール酸(齧歯類ではα-およびβ-ミュリコール酸を含む). |
肝臓から分泌される胆汁酸の大部分はタウリンあるいはグリシンで抱合化される.この抱合化の経路としては,それぞれコール酸やケノデオキシコール酸のC27前駆体である3α,7α,12α-トリヒドロキシ-5β-コレスタン酸や3α,7α-ジヒドロキシ-5β-コレスタン酸をコエンザイムA(CoA)誘導体とした後,そのCoA部分を遊離の胆汁酸とせずにタウリンあるいはグリシンと置き換える経路16)がある一方,遊離の胆汁酸を抱合化する経路も存在する17).これらのことは,抱合型胆汁酸の合成経路として2通りの経路があることを示している.すなわち,胆汁酸生合成のときに遊離胆汁酸を経ずに抱合型胆汁酸として合成する経路と,腸肝循環された胆汁酸をリサイクルする場合に遊離の胆汁酸を再抱合する経路である.
主に抱合型胆汁酸として胆嚢に蓄えられた胆汁酸は,食事摂取に伴う胆嚢収縮によって十二指腸内に分泌される.胆汁酸の中でも抱合型胆汁酸は比較的水溶性で,そのまま細胞膜を通り抜ける可能性が低い10)ことから消化管腔内にとどまることができて食事脂質やビタミンはもちろん,食後服用する薬剤などで疎水性分子の吸収に寄与すると考えられる.以前からヒトやマウスには胆嚢があるのに,ラットには胆嚢がないことが不思議だったが,マウスでは発生途中のしかるべき時期に前腸組織の胆嚢ができる部位でのSOX17の発現がある.一方,これが起こらないラットでは結果として胆嚢欠損に至ることが示された18).
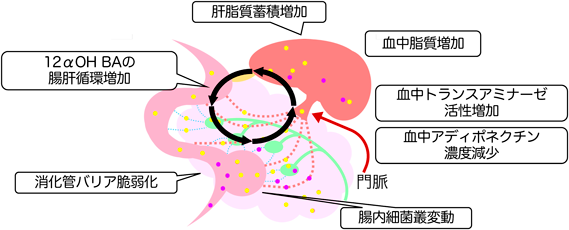
そもそも胆嚢欠損は胆汁・胆汁酸の分泌に影響を及ぼすのだろうか.胆嚢切除マウスでは,胆汁酸分泌が増大すること19, 20)が示されており,胆嚢がない場合には胆汁の流れを増すことで補うように適応すると考えられる.麻酔下でラットの総胆管にカニュレーションを施して胆汁を回収した際の体重あたりの胆汁分泌速度21)は,マウスでの同様な実験データ22)とほぼ同等であることから,胆汁そのものの基礎分泌には大きな違いはない.さらに,コール酸をラットの食事に添加すると胆汁の流速と胆汁酸濃度がいずれも増加する21)ことから,ラットでは肝臓での胆汁酸の貯留が増えると早々に消化管内に胆汁酸を放出するものと推察される.胆嚢を持たない動物はウマ,シカやクジラなど多様で,進化における自然選択や個体サイズ等との関連があるとも考えにくく,胆嚢の欠損が胆汁分泌の機能的な障害とはなりえないとの解釈があるのもうなずける23).消化管内に分泌された胆汁酸が回腸部位で再吸収されて門脈経由で肝臓に戻る,いわゆる腸肝循環(図2)を考慮すれば,ラットでは胆汁酸を滞留させることなく消化管・門脈・肝臓を介して胆汁酸を常に循環させることで腸肝循環での胆汁酸レベルを維持すると考えることもできる.
胆汁酸分子種は多様であり,以下に示す受容体として,ファルネソイドX受容体24),プレグナンX受容体25),ビタミンD受容体26),TGR5/GPBAR127),スフィンゴシン1-リン酸受容体228)や,ムスカリンM3受容体29)が報告されている.胆汁酸受容体に及ぼす作用は胆汁酸分子種に依存し,ある胆汁酸分子が特定の受容体のアゴニストとして作用したとしても,他の受容体のアンタゴニストとして作用する場合も推察される.これらの研究の発展にはめざましいものがあるが,胆汁酸分子と受容体それぞれの多様性を考慮すると,多様な胆汁酸分子種による調節の複雑さが想定される.そもそもリガンドとしての胆汁酸分子がそれぞれどのように体内を流れ,代謝によりどのように変動するのか,対象とする臓器・細胞の環境ではどの分子種が多いのかなど,把握すべきことは多い.これらのことを正確に評価するには,体内の部位ごとに胆汁酸分子種の濃度を個別に定量する必要に迫られる.
現在,胆汁酸の組成分析にはガスクロマトグラフィー(gas chromatography:GC)あるいは液体クロマトグラフィー(liquid chromatography:LC)で分離して質量分析で検出する方法が普及している11).このうちGC分析では前処理として揮発可能な誘導体にする処理が必要になるが,LC分析ではその必要はない.胆汁酸を測定すべき生体成分として,肝臓などの臓器や,消化管内容物や糞便あるいは胆汁や血液など,その性状は多岐にわたる.胆汁酸は両親媒性であるとはいえ,分子種により比較的疎水的なものから親水的なものまで多様である.そのため我々は,各試料の凍結乾燥粉末からの抽出とし,多様な夾雑物から胆汁酸成分をより分けるための前処理として固相抽出した後に,LC/MSを用いて30種類程度の胆汁酸分子種を一斉分析する方法30, 31)を用いている.現状では,質量分析器の分解能がよくなり,内部標準に用いる分子種や検出法の選択を併せることで,さらに精度の高い関連化合物の分析が可能になっている.
我々が構築した方法で,ラットにおける胆汁酸代謝を評価したところ,消化管内での脱抱合や大腸での二次胆汁酸への変換だけでなく,体内のさまざまな部位での各胆汁酸分子の量的関係を詳細に評価できた30)ことから,この方法を用いて高脂肪食摂取ラットの胆汁酸代謝解析を行った32, 33).高脂肪食では飼料単位重量あたりのエネルギー量が相対的に多いため摂食量の低下が起こるものの,摂取する総エネルギー量としては多くなるという状態がしばしば観察される.一方で,摂取エネルギー量が大きくなれば,アセチルCoAの供給が増え,コレステロールや胆汁酸などのステロール合成が亢進することに不思議はない.
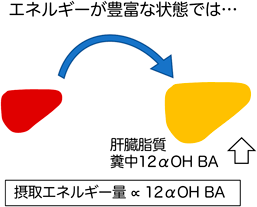
実際,高脂肪食摂取では糞中胆汁酸排泄が増加することを確認したが,個別の分子種解析により,より早期に12αOH BAの糞中排泄が有意な増加を示すことを見いだした32).糞中12αOH BA濃度は耐糖能試験での血中グルコース変動と正の相関があるばかりか,総エネルギー摂取量とも正の相関を示した.これらのことは,12αOH BAが摂取エネルギー履歴を反映することを示している.また,高脂肪食での糞中12αOH BA濃度はかなり正確に肝臓での脂質蓄積を反映することを見いだした(図3)33).この12αOH BA濃度と肝脂質蓄積の関係は,糞だけでなく肝臓・門脈血の12αOH BA濃度でも観察された.しかしながら,体循環血の12αOH BA濃度は肝脂質蓄積との有意な相関は観察されなかった.このことは,体循環血の胆汁酸組成・濃度が必ずしも門脈血や肝臓などでの当該胆汁酸濃度を反映しないことを示している.実際,門脈血の12αOH BA濃度は体循環血に比べ10倍程度高い濃度で存在し,高脂肪食摂取ラットの門脈血では12αOH BA濃度がコントロールに比べ1.5倍に増えた一方,体循環血でそのような増加は観察されなかった33).胆汁うっ滞などによる著しい胆汁酸濃度増加であれば,体循環血での胆汁酸濃度上昇も検出できるものと推察される.しかし,もともと門脈血と体循環血では胆汁酸濃度に大きな差があり,食事に対する変動が必ずしも同じではないことから,体循環血を用いて生理的な腸肝循環関連組織での胆汁酸環境の変動を鋭敏に検出することは難しいと考えられる.
高脂肪食を摂取させると胆汁および小腸内容物の胆汁酸として,タウロコール酸が選択的に増加すること,盲腸以降の大腸および糞では,デオキシコール酸の増加が顕著であることを見いだした32).しかし,同じ飼育条件で肝臓でのタウロコール酸濃度がコントロールに比べて有意に高いわけではない33)ことから,胆嚢を持たないラットでは高脂肪食の摂取により増大したタウロコール酸を胆汁に乗せてすばやく排出するものと推察した.我々は代謝経路を踏まえた構造の類似性をもとに,表のように12αOH BAと非12αOH BAを分類している(表1).タウロコール酸,コール酸,デオキシコール酸はいずれも12αOH BAである.一方,齧歯類における非12αOH BAの代表格であるミュリコール酸は,上部消化管よりも大腸以下の下部消化管においてその存在比率が増した.高脂肪食の摂取により,大腸以降では12αOH BAの二次胆汁酸であるデオキシコール酸が増えるものの,ミュリコール酸の合計値としてはそれを超える値が得られた32, 34).また,回腸下部で胆汁酸の吸収に関与するナトリウム依存性の胆汁酸トランスポーターはミュリコール酸よりタウロコール酸を取り込みやすい35)ことから,非12αOH BAは腸肝循環に乗りにくく排泄されやすい一方,12αOH BAは腸肝循環に乗りやすいと考えられる.エネルギー過多や高脂肪食摂取では,腸肝循環されやすい12αOH BAを積極的に作り出すものと推察できる.
ラットでは,高脂肪・高ショ糖食でもほぼ同様の胆汁酸代謝となり34),高脂肪食摂取によりcytochrome P450 family 7 subfamily A member 1(CYP8B1)の遺伝子発現が増加すること33)を見いだした.一方で,脂肪肝患者や高脂肪食による脂肪肝マウスでは,非12αOH BAの合成に関わるsteroidogenic acute regulatory protein(STAR)の発現が低下すること36)が報告されている.これらのことは,経路は異なるものの肥満や高脂肪食摂取では,胆汁酸組成が12αOH BAに偏ることを示している.高脂肪食を摂取させると,糞中でのデオキシコール酸は著しく増加するものの,門脈血中で遊離のデオキシコール酸濃度は必ずしも増加しなかった33).ラットでは,灌流させたデオキシコール酸が水酸基を一つ加えた形のコール酸に変換される37).すなわち,腸内細菌が二次胆汁酸にしたものを,再度一次胆汁酸に戻す能力があることになる.このことから,ラットではデオキシコール酸が門脈に流入したとしても肝臓に到達した途端にコール酸に変換されてしまうと推察される.いずれにしても摂取エネルギー過剰での腸肝循環関連組織における胆汁酸の実態は,二次胆汁酸に変換される前のコール酸あるいはタウロコール酸,すなわち12αOH BAが主体である.摂取エネルギー増大により個体が栄養過多となる場合に,腸肝循環関連組織である肝臓・胆管・小腸管腔・門脈を12αOH BAが多量にめぐり続けると推察された.
7. ラットにおける12α水酸化胆汁酸添加飼料による肝脂質蓄積
これまで述べたような栄養過多での胆汁酸環境,すなわち12αOH BAの増大が何かの症状を引き起こすか興味が持たれた.そこで,12αOH BAの一次胆汁酸であるコール酸を餌に添加するという実験を行った.胆汁酸を試料に添加する方法はこれまでに頻繁に使われている.たとえば,食事コレステロールを増やす実験で,コレステロールとともにコール酸を飼料に添加することで,コレステロールが体内に吸収されやすい環境を作るために使われる38).それ以外に,コール酸を単独で飼料に添加することで胆管細胞の増殖誘導39)や肝再生の誘導40),あるいは胆汁うっ滞のモデルとして使われる場合もある41).すでに使い古され,きわめて当たり前な印象を持たれる実験系ではあるが,我々がこの実験系を用いる目的は栄養過多状態の12αOH BAの挙動をコール酸添加食で模倣することにある.そこで,基本的な組成の飼料中のコール酸添加濃度を変え,ラットでの胆汁酸の体内代謝を評価することで,栄養過多における12αOH BA代謝を模倣するための最適なコール酸添加量を探索した.コレステロール吸収の補助のため汎用される濃度(2 g/kg飼料)では糞中コール酸が多量に検出された.このことは,栄養過多での糞中12αOH BAとして主体であるはずのデオキシコール酸に変換されず,一次胆汁酸としてのコール酸がそのまま糞へ排泄される割合が高いことが示された.さらに減らして0.1 g/kg飼料程度にすると,今度は12αOH BAの増加があまり見込めない状態となった.飼料へのコール酸添加量を0.5 g/kg飼料とすると,糞中では二次胆汁酸であるデオキシコール酸が主体となること42),上部消化管や門脈・肝臓ではコール酸またはタウロコール酸が主体となること43)を確認し,栄養過多での12αOH BA代謝を良好に模倣した状態であることが推察された.以後,このコール酸添加量で実験を行うこととした.
上記のコール酸添加条件による10日程度の飼育で,下部消化管でのデオキシコール酸濃度の増加に伴い,盲腸内腸内細菌叢としてはBacteroidetesの減少とともにFirmicutesの増加が起こり,肥満すなわち栄養過多での腸内細菌層に酷似する状況に変動した42).さらに長期間の飼育を行ったところ,摂食量や体重にはまったく違いがみられなかった一方,その後の解析では興味深い現象(図2)が次々と観察された43).腸内細菌叢変動もさることながら,最も目を引いたのは肝臓での脂質蓄積であった.コール酸を添加することで肝臓の重量が少々増えることは,コール酸の肝細胞増殖作用40)を考慮すれば想定の範囲内である.しかし,コール酸摂取ラットの肝臓は白色を帯び,肝臓トリグリセリド濃度が40%ほど増加したことから,肝脂質蓄積が裏づけられた43).さらに肝臓組織の解析では,小滴性ではあるものの脂質蓄積した肝細胞の頻度がコール酸摂取で増加し,一方で炎症や線維化の兆候はまったく観察されなかった.加えて,体循環血でのトリグリセリドや脂肪酸濃度の上昇,トランスアミナーゼ活性の上昇,アディポネクチン濃度の減少が観察された.
コール酸はコレステロールの異化産物であり,胆汁酸が増えればその代謝経路はネガティブフィードバックで抑制される14).そこで,ステロール代謝関連酵素などの遺伝子発現解析を行った.コレステロールや胆汁酸の合成において律速因子と考えられる3-ヒドロキシ-3-メチルグルタリルCoA還元酵素やcytochrome P450 family 7 subfamily A member 1(CYP7A1)の遺伝子発現にはいずれも有意差はみられなかったことから,これらの経路は必ずしも抑制されていないと考えられる.これらのことは,コール酸の添加量が汎用される添加量38–40)より相対的に低い値であることと無関係ではないだろう.実際,各種のミュリコール酸を含む非12αOH BAの糞中濃度がコール酸摂取ラットで増加したという結果は,胆汁酸の合成が進行していることを示している.つまり,コール酸の負荷量がそれほど大きくないために,これらのネガティブフィードバック経路を強力に作動するには至らないものと推察された.
コレステロールから胆汁酸に至る経路の中間代謝物は酸化コレステロールである.肝臓での酸化コレステロール分析の結果,4β-ヒドロキシコレステロール(4β-hydroxycholesterol:4βOH)の濃度上昇が最も大きく,その他いくつかの酸化コレステロールの濃度も増加する結果が得られた.4βOHは肝臓X受容体(liver X receptor)のアゴニストとして作用44)し,脂質合成の制御因子であるsterol regulatory element-binding protein(SREBP1)の発現を媒介する45)ことが知られている.コール酸摂取状態では肝臓のSREBP1遺伝子の発現が一貫して亢進することを見いだしており,脂肪酸合成酵素の発現も増加する傾向を観察している43).詳細なメカニズムについては今後の検討課題だが,これらのことは栄養過多で生じる12αOH BAの増加が脂肪酸合成を介して脂肪肝に関わることを示すものとして興味深い.それでも,これがただの軽微な肝脂質蓄積で,炎症や線維化の兆候もみられないなら特段の問題はないと考えることもできる.
単純性脂肪肝にセカンドヒットとしての酸化ストレスや炎症などが加わることで症状の悪化が進行するという2ヒットあるいは多段階ヒットという考え方がある46).そこで,コール酸による肝脂質蓄積後にセカンドヒットを模倣してグラム陰性細菌の細胞壁成分であるリポ多糖を投与することで生じる体循環血でのトランスアミナーゼ活性の増加を評価したところ,コール酸摂取ラットではトランスアミナーゼ活性の増加がコントロールに比べて著しく高くなるという結果を得た43).このことから,コール酸による脂肪肝が軽微とはいえ,その後の環境次第では,症状がより悪化しやすいことが示された.
実験動物における食事誘導性の非アルコール性脂肪肝モデルとして,メチオニンやコリンの欠乏,高脂肪食や高フルクトース食を用いたモデルがある38, 47).メチオニンやコリン欠乏は,肥満にはならずに肝臓で炎症や線維化が引き起こされ,かなり重篤な症状を呈するモデルである.高脂肪食による脂肪肝症状はそれほど重篤ではないものの,脂肪組織重量の増加による肥満に加え肝臓脂質蓄積と炎症が観察される.高フルクトース食でも肝脂質蓄積に伴う炎症に脂肪組織重量の増加が伴う48, 49).我々の用いたコール酸添加飼料は0.5 g/kg飼料で,10数週間飼育しても摂食量や体重増加に違いがない.各種栄養成分の供給に偏りがないため,考慮すべき項目を限定できて解析が容易であることが特徴としてあげられるとともに,肥満にならずに炎症や線維化を伴わない肝脂質蓄積状態を示すことが興味深い点である.これは非肥満型の単純性の肝脂質蓄積として今までなかった初期NAFLモデルと位置づけることもできよう.さらにこの実験系は,脂肪肝の立ち上がりで12αOH BAの関与が重要であることを示唆している.実際,アルコール性脂肪肝においても胆汁酸合成が亢進する50)ので,腸肝循環での12αOH BA濃度の増加が推察される.このような他の脂肪肝モデルを含めた比較解析により,単なる肝臓での脂質蓄積からどのように症状が悪化するのか,その機構解明に役立つものと期待される.
ヒトでの早期の脂肪肝に腸肝循環での12αOH BAが関与するかを検証することはこれからの課題である.高脂肪食の摂取により糞便での12αOH BA濃度が増加することがヒト実験でも示された51).高脂肪食や摂取エネルギー過多ではないが,健常者のヒト糞便サンプルを用いた我々の解析では,12αOH BA濃度が3 µmol/g程度検出されるのに対し,非12αOH BA濃度はその半分程度の数値であった52).一方,このときの血清では,12αOH BA濃度は3 µM弱であるに対し,非12αOH BA濃度はそれを超える4 µM超となる結果を得た.これらの結果は,ヒトの消化管内でもかなりの量の12αOH BAが存在することを示している.加えて,ヒトにおいても消化管内の胆汁酸環境を体循環血の胆汁酸データから読みとることが難しいこともわかる.脂肪肝関連の指標とともに,胆汁あるいは門脈血の胆汁酸組成分析データが得られれば,ヒトにおける12αOH BAの脂肪肝発症における寄与を示すことができるものと推察される.
代謝物解析を進める中で,動物種の選択は重要な問題である.コール酸による肝脂質蓄積はラットを用いて見いだした現象である.糞中の12αOH BA/非12αOH BA比率が,ラットの糞では通常1をかなり下回り0.5程度であるが,高脂肪食ではほぼ1程度まで増加する.これらはマウスでも同程度である.一方,門脈血で同じ解析を行うと,通常飼育のラットでは12αOH BA/非12αOH BA比が4程度の高い値で,高脂肪食の摂取ではその数値が6程度まで上昇する.しかし,マウスの門脈血では糞での数値と同じ0.5弱と低いレベルで,高脂肪食でも1程度にとどまる.これらのことは,マウス門脈血での12αOH BA濃度がラットに比べて低いこと,すなわち門脈血を通る12αOH BAがラットに比べて極端に少ないことを示しており,胆汁酸トランスポーターの性質や発現を含めた胆汁酸の腸肝循環キャパシティーが動物種により異なることが考えられる.したがって,ラットと同様にコール酸の当該量を摂取させても,腸肝循環での12αOH BA濃度を高めるのは難しいと推察された.一方,マウスでは,遺伝子改変によるアプローチで肝脂質蓄積における12αOH BAの重要性が示されている.12αOH BA合成をつかさどるCYP8B1をマウスの肝臓に強制発現させた実験で,肝臓でのSREBP1の遺伝子発現増加と肝脂質蓄積亢進が観察され53),CYP8B1遺伝子の欠損では高脂肪食で誘導される肝脂質蓄積が抑制される54).さらに,非12αOH BAの合成に関わるSTARの発現を肝臓で強制的に増加させると,高脂肪食による脂肪肝が改善すること36)が報告された.これらのことは,マウスにおいても12αOH BAの増加が肝臓での脂質蓄積に関与することを示唆している.
実験を進める上でのハンドリングや抽出・分析などさまざまなステップで誤差はつきものである.分析の結果,数値のバラツキが大きいために本来見たかった当該処理によるパラメーターの有意差がとれないという経験をお持ちの方は多いだろう.ヒトと違って飼育環境を制御しやすい実験動物であっても,個体差は避けて通れない.遺伝的背景が比較的そろっている近交系の方がパラメーターのバラツキは少なく収まる55)はずで,実験動物の浪費を避ける意味でも重要である.我々は肝臓における中性脂質濃度をいくつかのラット系統で比較したところ,近交系の方が非近交系に比べて肝臓脂質の変動係数(平均値あたりの標準偏差)が低い値に抑えられる,すなわちバラツキが少ないことを確認できた56).また,動物の浪費を避けるという観点で実験をすると,一度の実験でできるだけたくさんの項目を分析したくなるものである.ここで問題となるのはこれらのパラメーターどうしの関係である.1対1の関係であれば単回帰でよいが,単回帰の図をたくさん並べてその中から意味のある関係や疾患発症における寄与度を探すのは難しい.こういう場合の解決策の一つとして多変量解析があり,主成分分析や重回帰分析等を併用することで,重要なパラメーターの変動を説明するための経路とそれらの寄与をある程度絞ることができる.各実験操作において,できるだけ誤差を少なくする取り組みをするのはもちろんであるが,用いる動物種の遺伝的背景や,データ処理の方法を考慮することで,効率よく意味のある結果を導き出すための取り組みも無視できないように思う.
食べ物にアクセスしやすい環境で長時間の絶食状態となるリスクは低いと思われるが,長い歴史の中ではごく最近の出来事ではないだろうか.それ以前,あるいは野生動物であれば,次の食べ物にありつくまでの時間は規定できず,その保証もない.摂取したエネルギーをコレステロールとしてしまうと,体内でエネルギーとして取り出すことはもはや不可能である.もちろん,コレステロールは生体の維持に不可欠で合成する必要があり,それが多くできれば胆汁酸合成にも使うことができて,脂質,すなわちエネルギーが濃縮された栄養素の吸収に寄与する.一度合成した12αOH BAをむだにしないためには,消化管内に分泌した胆汁酸を回収する必要があり,それは胆汁酸が腸肝循環される意義の一つであろう.腸肝循環がなければ,動物はエネルギーとして使えない胆汁酸を常に作り続ける必要に迫られる.このように考えれば,12αOH BAが(必ずしも栄養過剰ではない)体内での栄養の豊富さを示す情報と捉えることができる.
12αOH BAは腸肝循環されやすいため,特にその場にある組織にとっては栄養が豊富にあることを示す情報として利用可能である.この情報をうまく使えるとすれば,摂取した栄養素が豊富なうちにそれらをコンパクトなエネルギー蓄積形態である脂質に変えて蓄えようとする働きが腸肝循環関連組織で起こっても不思議はなく,代謝の中枢である肝臓が真っ先にエネルギー貯留に舵を切る意義は十分にある.栄養過多による12αOH BAの増大が体循環を介して全身に及びにくいことを考慮すれば,脂肪組織にほとんど影響を及ぼさず,肝臓にほぼ限局した脂質蓄積が起こることも理解できる.
我々は,栄養過多で起こる代謝物解析を通じて,12αOH BAが肝臓での脂質蓄積に関与することについて,ラットを用いたきわめて単純な実験系で見いだした.このことは動物の生存戦略の一つと考えられるとともに,飽食の時代には疾患の入り口になるとも推察される.同じような現象がヒトでも起こりうるかについては,今後の研究を待つ必要がある.仮にヒトでも同様だとすれば,食の多様性が広がる現在においては,これらのことを踏まえた食素材の選択が可能になるかもしれない.
謝辞Acknowledgments
研究に実施にあたり,多くの共同研究者の皆様にご協力いただきました.この場を借りて感謝申し上げます.
引用文献References
1) World Health Organization. (2008) 2008–2013 Action plan for the global strategy for the prevention and control of noncommunicable diseases. WHO Document Production Services, Geneva, Switzerland.
2) Alwan, A. (2011) Global status report on noncommunicable diseases 2010. World Health Organization. WHO Press, Geneva, Switzerland.
3) 石見佳子,笠岡(坪山)宜代(2017)栄養表示のための栄養参照量の国際比較.栄養学雑誌,75, 39–46.
4) World Health Organization. (2013) Global action plan for the prevention and control of noncommunicable diseases 2013–2020. WHO Document Production Services, Geneva, Switzerland.
5) Kojima, S., Watanabe, N., Numata, M., Ogawa, T., & Matsuzaki, S. (2003) Increase in the prevalence of fatty liver in Japan over the past 12 years: Analysis of clinical background. J. Gastroenterol., 38, 954–961.
6) 日本肝臓学会(2015)NASH・NAFLDの診療ガイド,pp. 2–7,文光堂.
7) Eslam, M., Sanyal, A.J., George, J., Sanyal, A., Neuschwander-Tetri, B., Tiribelli, C., Kleiner, D.E., Brunt, E., Bugianesi, E., Yki-Järvinen, H., et al.; International Consensus Panel. (2020) MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology, 158, 1999–2014.
8) Ye, Q., Zou, B., Yeo, Y.H., Li, J., Huang, D.Q., Wu, Y., Yang, H., Liu, C., Kam, L.Y., Tan, X.X.E., et al. (2020) Global prevalence, incidence, and outcomes of non-obese or lean non-alcoholic fatty liver disease: A systematic review and meta-analysis. Lancet Gastroenterol. Hepatol., 5, 739–752.
9) Weston, S.R., Leyden, W., Murphy, R., Bass, N.M., Bell, B.P., Manos, M.M., & Terrault, N.A. (2005) Racial and ethnic distribution of nonalcoholic fatty liver in persons with newly diagnosed chronic liver disease. Hepatology, 41, 372–379.
10) Hofmann, A.F. & Hagey, L.R. (2014) Key discoveries in bile acid chemistry and biology and their clinical applications: History of the last eight decades. J. Lipid Res., 55, 1553–1595.
11) Griffiths, W.J. & Sjövall, J. (2010) Bile acids: Analysis in biological fluids and tissues. J. Lipid Res., 51, 23–41.
12) Ridlon, J.M., Kang, D.J., & Hylemon, P.B. (2006) Bile salt biotransformations by human intestinal bacteria. J. Lipid Res., 47, 241–259.
13) de Aguiar Vallim, T.Q., Tarling, E.J., & Edwards, P.A. (2013) Pleiotropic roles of bile acids in metabolism. Cell Metab., 17, 657–669.
14) Chiang, J.Y.L. & Ferrell, J.M. (2018) Bile acid metabolism in liver pathobiology. Gene Expr., 18, 71–87.
15) Takahashi, S., Fukami, T., Masuo, Y., Brocker, C.N., Xie, C., Krausz, K.W., Wolf, C.R., Henderson, C.J., & Gonzalez, F.J. (2016) Cyp2c70 is responsible for the species difference in bile acid metabolism between mice and humans. J. Lipid Res., 57, 2130–2137.
16) Styles, N.A., Falany, J.L., Barnes, S., & Falany, C.N. (2007) Quantification and regulation of the subcellular distribution of bile acid coenzyme A:amino acid N-acyltransferase activity in rat liver. J. Lipid Res., 48, 1305–1315.
17) Mihalik, S.J., Steinberg, S.J., Pei, Z., Park, J., Kim, D.G., Heinzer, A.K., Dacremont, G., Wanders, R.J., Cuebas, D.A., Smith, K.D., et al. (2002) Participation of two members of the very long-chain acyl-CoA synthetase family in bile acid synthesis and recycling. J. Biol. Chem., 277, 24771–24779.
18) Higashiyama, H., Uemura, M., Igarashi, H., Kurohmaru, M., Kanai-Azuma, M., & Kanai, Y. (2018) Anatomy and development of the extrahepatic biliary system in mouse and rat: A perspective on the evolutionary loss of the gallbladder. J. Anat., 232, 134–145.
19) Amigo, L., Husche, C., Zanlungo, S., Lütjohann, D., Arrese, M., Miquel, J.F., Rigotti, A., & Nervi, F. (2011) Cholecystectomy increases hepatic triglyceride content and very-low-density lipoproteins production in mice. Liver Int., 31, 52–64.
20) Cortés, V., Amigo, L., Zanlungo, S., Galgani, J., Robledo, F., Arrese, M., Bozinovic, F., & Nervi, F. (2015) Metabolic effects of cholecystectomy: Gallbladder ablation increases basal metabolic rate through G-protein coupled bile acid receptor Gpbar1-dependent mechanisms in mice. PLoS One, 10, e0118478.
21) Hagio, M., Shimizu, H., Joe, G.H., Takatsuki, M., Shiwaku, M., Xu, H., Lee, J.Y., Fujii, N., Fukiya, S., Hara, H., et al. (2015) Diet supplementation with cholic acid promotes intestinal epithelial proliferation in rats exposed to γ-radiation. Toxicol. Lett., 232, 246–252.
22) Selwyn, F.P., Csanaky, I.L., Zhang, Y., & Klaassen, C.D. (2015) Importance of large intestine in regulating bile acids and glucagon-like peptide-1 in germ-free mice. Drug Metab. Dispos., 43, 1544–1556.
23) Kruepunga, N., Hakvoort, T.B.M., Hikspoors, J.P.J.M., Köhler, S.E., & Lamers, W.H. (2019) Anatomy of rodent and human livers: What are the differences? Biochim. Biophys. Acta Mol. Basis Dis., 1865, 869–878.
24) Makishima, M., Okamoto, A.Y., Repa, J.J., Tu, H., Learned, R.M., Luk, A., Hull, M.V., Lustig, K.D., Mangelsdorf, D.J., & Shan, B. (1999) Identification of a nuclear receptor for bile acids. Science, 284, 1362–1365.
25) Staudinger, J.L., Goodwin, B., Jones, S.A., Hawkins-Brown, D., MacKenzie, K.I., LaTour, A., Liu, Y., Klaassen, C.D., Brown, K.K., Reinhard, J., et al. (2001) The nuclear receptor PXR is a lithocholic acid sensor that protects against liver toxicity. Proc. Natl. Acad. Sci. USA, 98, 3369–3374.
26) Makishima, M., Lu, T.T., Xie, W., Whitfield, G.K., Domoto, H., Evans, R.M., Haussler, M.R., & Mangelsdorf, D.J. (2002) Vitamin D receptor as an intestinal bile acid sensor. Science, 296, 1313–1316.
27) Kawamata, Y., Fujii, R., Hosoya, M., Harada, M., Yoshida, H., Miwa, M., Fukusumi, S., Habata, Y., Itoh, T., Shintani, Y., et al. (2003) A G protein-coupled receptor responsive to bile acids. J. Biol. Chem., 278, 9435–9440.
28) Studer, E., Zhou, X., Zhao, R., Wang, Y., Takabe, K., Nagahashi, M., Pandak, W.M., Dent, P., Spiegel, S., Shi, R., et al. (2012) Conjugated bile acids activate the sphingosine-1-phosphate receptor 2 in primary rodent hepatocytes. Hepatology, 55, 267–276.
29) Cheng, K. & Raufman, J.-P. (2005) Bile acid-induced proliferation of a human colon cancer cell line is mediated by transactivation of epidermal growth factor receptors. Biochem. Pharmacol., 70, 1035–1047.
30) Hagio, M., Matsumoto, M., Fukushima, M., Hara, H., & Ishizuka, S. (2009) Improved analysis of bile acids in tissues and intestinal contents of rats using LC/ESI-MS. J. Lipid Res., 50, 173–180.
31) Hagio, M., Matsumoto, M., & Ishizuka, S. (2011) Bile acid analysis in various biological samples using ultra performance liquid chromatography/electrospray ionization-mass spectrometry (UPLC/ESI-MS). Methods Mol. Biol., 708, 119–129.
32) Yoshitsugu, R., Kikuchi, K., Iwaya, H., Fujii, N., Hori, S., Lee, D.G., & Ishizuka, S. (2019) Alteration of bile acid metabolism by a high-fat diet is associated with plasma transaminase activities and glucose intolerance in rats. J. Nutr. Sci. Vitaminol. (Tokyo), 65, 45–51.
33) Hori, S., Abe, T., Lee, D.G., Fukiya, S., Yokota, A., Aso, N., Shirouchi, B., Sato, M., & Ishizuka, S. (2020) Association between 12α-hydroxylated bile acids and hepatic steatosis in rats fed a high-fat diet. J. Nutr. Biochem., 83, 108412.
34) Yoshitsugu, R., Kikuchi, K., Hori, S., Iwaya, H., Hagio, M., Shimizu, H., Hira, T., & Ishizuka, S. (2020) Correlation between 12α-hydroxylated bile acids and insulin secretion during glucose tolerance tests in rats fed a high-fat and high-sucrose diet. Lipids Health Dis., 19, 9.
35) Kramer, W., Stengelin, S., Baringhaus, K.-H., Enhsen, A., Heuer, H., Becker, W., Corsiero, D., Girbig, F., Noll, R., & Weyland, C. (1999) Substrate specificity of the ileal and the hepatic Na+/bile acid cotransporters of the rabbit. I. Transport studies with membrane vesicles and cell lines expressing the cloned transporters. J. Lipid Res., 40, 1604–1617.
36) Qiu, Y., Sui, X., Zhan, Y., Xu, C., Li, X., Ning, Y., Zhi, X., & Yin, L. (2017) Steroidogenic acute regulatory protein (StAR) overexpression attenuates HFD-induced hepatic steatosis and insulin resistance. Biochim. Biophys. Acta Mol. Basis Dis., 1863, 978–990.
37) Jensen, R.T., Davis, R.A., & Kern, F. Jr. (1977) Increased sulfation and decreased 7α-hydroxylation of deoxycholic acid in ethinyl estradiol-induced cholestasis in rats. Gastroenterology, 73, 314–320.
38) Ibrahim, S.H., Hirsova, P., Malhi, H., & Gores, G.J. (2016) Animal models of nonalcoholic steatohepatitis: Eat, delete, and inflame. Dig. Dis. Sci., 61, 1325–1336.
39) Reich, M., Deutschmann, K., Sommerfeld, A., Klindt, C., Kluge, S., Kubitz, R., Ullmer, C., Knoefel, W.T., Herebian, D., Mayatepek, E., et al. (2016) TGR5 is essential for bile acid-dependent cholangiocyte proliferation in vivo and in vitro. Gut, 65, 487–501.
40) Huang, W., Ma, K., Zhang, J., Qatanani, M., Cuvillier, J., Liu, J., Dong, B., Huang, X., & Moore, D.D. (2006) Nuclear receptor-dependent bile acid signaling is required for normal liver regeneration. Science, 312, 233–236.
41) Van Nieuwkerk, C.M.J., Elferink, R.P.J.O., Groen, A.K., Ottenhoff, R., Tytgat, G.N.J., Dingemans, K.P., Van Den Bergh Weerman, M.A., & Offerhaus, G.J.A. (1996) Effects of Ursodeoxycholate and cholate feeding on liver disease in FVB mice with a disrupted mdr2 P-glycoprotein gene. Gastroenterology, 111, 165–171.
42) Islam, K.B.M.S., Fukiya, S., Hagio, M., Fujii, N., Ishizuka, S., Ooka, T., Ogura, Y., Hayashi, T., & Yokota, A. (2011) Bile acid is a host factor that regulates the composition of the cecal microbiota in rats. Gastroenterology, 141, 1773–1781.
43) Lee, J.-Y., Shimizu, H., Hagio, M., Fukiya, S., Watanabe, M., Tanaka, Y., Joe, G.-H., Iwaya, H., Yoshitsugu, R., Kikuchi, K., et al. (2020) 12α-hydroxylated bile acid induces hepatic steatosis with dysbiosis in rats. Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1865, 158811.
44) Janowski, B.A., Willy, P.J., Devi, T.R., Falck, J.R., & Mangelsdorf, D.J. (1996) An oxysterol signalling pathway mediated by the nuclear receptor LXRα. Nature, 383, 728–731.
45) Shimano, H., Horton, J.D., Shimomura, I., Hammer, R.E., Brown, M.S., & Goldstein, J.L. (1997) Isoform 1c of sterol regulatory element binding protein is less active than isoform 1a in livers of transgenic mice and in cultured cells. J. Clin. Invest., 99, 846–854.
46) Buzzetti, E., Pinzani, M., & Tsochatzis, E.A. (2016) The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD). Metabolism, 65, 1038–1048.
47) Febbraio, M.A., Reibe, S., Shalapour, S., Ooi, G.J., Watt, M.J., & Karin, M. (2019) Preclinical models for studying NASH-driven HCC: How useful are they? Cell Metab., 29, 18–26.
48) Maithilikarpagaselvi, N., Sridhar, M.G., Swaminathan, R.P., Sripradha, R., & Badhe, B. (2016) Curcumin inhibits hyperlipidemia and hepatic fat accumulation in high-fructose-fed male Wistar rats. Pharm. Biol., 54, 2857–2863.
49) Do, M.H., Lee, E., Oh, M.J., Kim, Y., & Park, H.Y. (2018) High-glucose or -fructose diet cause changes of the gut microbiota and metabolic disorders in mice without body weight change. Nutrients, 10, 761.
50) Xie, G., Zhong, W., Li, H., Li, Q., Qiu, Y., Zheng, X., Chen, H., Zhao, X., Zhang, S., Zhou, Z., et al. (2013) Alteration of bile acid metabolism in the rat induced by chronic ethanol consumption. FASEB J., 27, 3583–3593.
51) Wan, Y., Yuan, J., Li, J., Li, H., Zhang, J., Tang, J., Ni, Y., Huang, T., Wang, F., Zhao, F., et al. (2020) Unconjugated and secondary bile acid profiles in response to higher-fat, lower-carbohydrate diet and associated with related gut microbiota: A 6-month randomized controlled-feeding trial. Clin. Nutr., 39, 395–404.
52) Hashimoto, N., Matsui, I., Ishizuka, S., Inoue, K., Matsumoto, A., Shimada, K., Hori, S., Lee, D.G., Yasuda, S., Katsuma, Y., et al. (2020) Lithocholic acid increases intestinal phosphate and calcium absorption in a vitamin D receptor dependent but transcellular pathway independent manner. Kidney Int., 97, 1164–1180.
53) Pathak, P. & Chiang, J.Y.L. (2019) Sterol 12α-hydroxylase aggravates dyslipidemia byactivating the ceramide/mTORC1/SREBP-1C pathway via FGF21 and FGF15. Gene Expr., 19, 161–173.
54) Bertaggia, E., Jensen, K.K., Castro-Perez, J., Xu, Y., Di Paolo, G., Chan, R.B., Wang, L., & Haeusler, R.A. (2017) Cyp8b1 ablation prevents Western diet-induced weight gain and hepatic steatosis because of impaired fat absorption. Am. J. Physiol. Endocrinol. Metab., 313, E121–E133.
55) Festing, M.F. (2010) Inbred strains should replace outbred stocks in toxicology, safety testing, and drug development. Toxicol. Pathol., 38, 681–690.
56) Shimoda, T., Hori, S., Maegawa, K., Takeuchi, A., Lee, Y., Joe, G.H., Tanaka, Y., Shimizu, H., & Ishizuka, S. (2020) A low coefficient of variation in hepatic triglyceride concentration in an inbred rat strain. Lipids Health Dis., 19, 137.
著者紹介Author Profile
 石塚 敏(いしづか さとし)
石塚 敏(いしづか さとし)北海道大学大学院農学研究院教授.博士(農学).
略歴東京都生まれ.1991年北海道大学農学部卒業.93年同大学院農学研究科修士課程修了.北海道大学農学部助手,講師,准教授を経て,2019年より現職.
研究テーマと抱負代謝物を通して,食習慣が関わる疾患の成り立ち,疾患発症の予防に寄与する食の作用点の解明を目指している.
ウェブサイトhttp://lab.agr.hokudai.ac.jp/nutrbiochem/
趣味食品加工,昼寝.