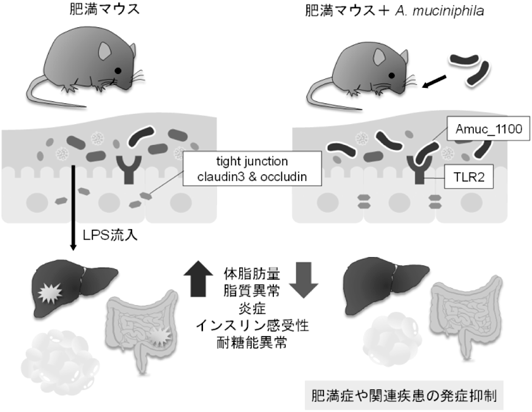
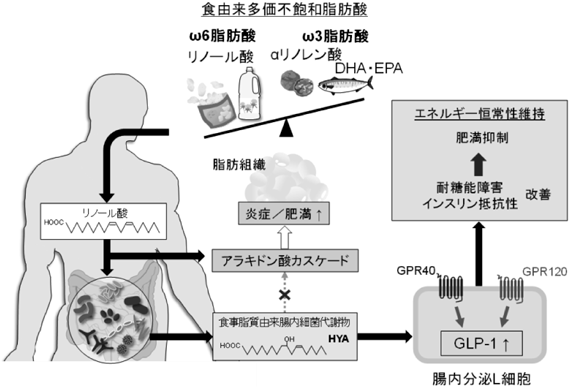
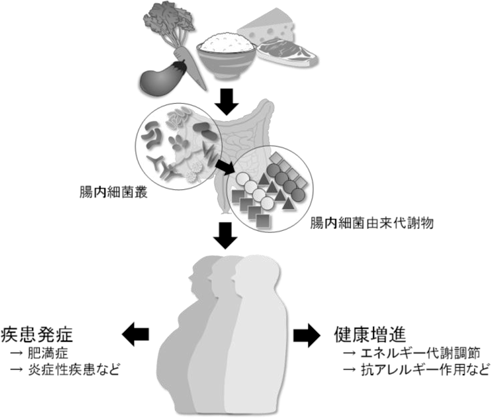
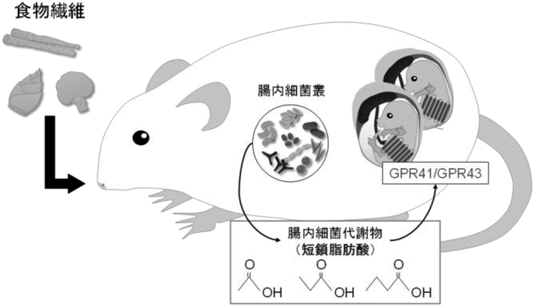
食と腸内細菌による宿主の代謝制御Host metabolic regulation via diet and gut microbiota
1 東京農工大学大学院農学研究院Graduate School of Agriculture, Tokyo University of Agriculture and Technology ◇ 〒183–8509 東京都府中市幸町3–5–8 ◇ 3–5–8 Saiwai-cho, Fuchu-shi, Tokyo 183–8509, Japan
2 京都大学大学院生命科学研究科Graduate School of Biostudies, Kyoto University ◇ 〒606–8501 京都府京都市左京区吉田近衛町 ◇ Yoshida-Konoecho, Sakyo-ku, Kyoto-shi, Kyoto 606–8501, Japan