生物の一生は,成長や老化に伴うさまざまな段階により構成され,生物は各段階において量的あるいは質的な特徴(形質)を示す.幼い個体が成体まで成長するのに要する日数や成体に達する割合,子孫を残す生殖能力,加齢に伴う特定の病気の発症率,そして寿命などが形質の例としてあげられる1).個体間や集団間に生じる形質の違いを定量的に表現し,その原因を分子反応系のレベルで理解することが求められている.そのために,ゲノム全体にわたって体系だった遺伝学的アプローチが適用できる一握りの生物種が,「モデル生物」として選ばれている.そして一定の遺伝学的背景を持つ系統を出発点として,遺伝子型間の差と形質の違いとの因果関係を検証するアプローチが,日常的に採用されてきた.
一方で,個々の生物種は,実験室の環境とは大きく異なる自然界において,進化の過程で多様な形質を獲得している.その中には,モデル生物にはみられない振る舞いをする「非モデル生物」が多く存在する.既存のモデル生物とは異なる形質を示すそれらの動物を実験室で飼育し,モデル生物の形質と比較するアプローチも注目されている2–4).当初,非モデル生物は個体の形態進化や遺伝子の有無に着目した研究に用いられることが多かった.近年では,次世代シークエンス解析技術の発達などにより,冬眠のような生理学的,あるいは共生のような個体間相互作用の観点からも,研究材料として注目されている5).
遺伝子型に加えて,環境要因も個体の一生に大きな影響を与えることがすでに示されており,その主要因の一つが栄養である6–8).各動物は多様な栄養環境と相互作用しながら,それぞれの食性を獲得してきた.本稿ではまず,ショウジョウバエ近縁種の中のうち,さまざまな物を食べることのできる広食性種と,特定の物のみを食べる狭食性種とを対比させることで,広食性種が持つ栄養環境への柔軟な適応機構を明らかにした研究を紹介する9).次に,低栄養環境である洞窟に適応した淡水魚の複数の個体群が,摂食量,脂肪の蓄積,インスリン応答性などの形質に多様性を示すことを報告した一連の論文を紹介する10–12).これらの研究からみえてきた知見を基に,今後,非モデル生物をどのようにいっそう有効に活用するかを議論する.
2. ショウジョウバエ近縁種間の適応能力の差を生む炭水化物応答機構
1)ショウジョウバエ近縁種にみられる食性の違い
キイロショウジョウバエ(Drosophila melanogaster)は,先駆的な遺伝学的アプローチが絶え間なく開発されている代表的なモデル生物の一つである.ヒトを含む哺乳類と比較すると,機能的に同等な器官やホルモンなど,多臓器連関の基盤となる多くの制御因子が保存されている13, 14).そのため,栄養環境への適応機構を研究する系としても注目されており,餌中の栄養成分が,幹細胞の増殖15, 16),ボディーサイズ17, 18),寿命19)などに与える影響が研究され,動物種間で保存された原理の解明につながっている.
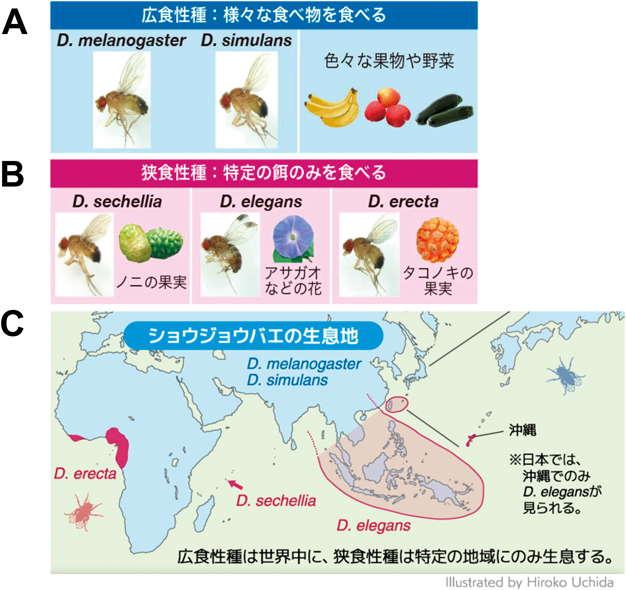
D. melanogasterは自然界では全世界の人家近くに生息し,発酵したさまざまな果物や野菜を食べる広食性種である(図1A, C)3).一方で,その近縁種には,Drosophila sechelliaのように限られた地域にのみ生息し,発酵した特定の植物だけを食べる狭食性種も存在する(図1B, C)3, 20).狭食性種が特定の植物の果実を好んだり,その果実に含まれる毒に耐性を持つ仕組みについては,嗅覚や味覚受容の違いなどから研究されてきた21, 22).一方で,広食性種がどのようにしてさまざまな栄養環境に柔軟に応答し,適応を実現しているかについては不明な点が残されていた.そこで,我々は,ゲノム情報が解読されているショウジョウバエ近縁種のうち,広食性2種(D. melanogasterとDrosophila simulans)と狭食性3種(D. sechellia, Drosophila erecta,およびDrosophila elegans)に着目した(図1A, B).そして,これらの近縁種間での栄養環境に対する適応能力の差を見いだし,遺伝子発現および代謝産物を対象とするマルチオミクス解析を行うことで,広食性種がより多様な栄養環境に適応できるメカニズムの解明を目指した9).
2)成長期における栄養バランスへの適応能力は近縁種間で大きく異なる
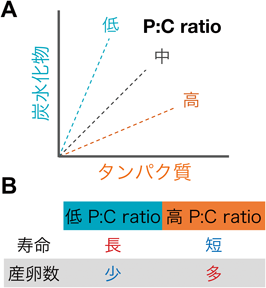
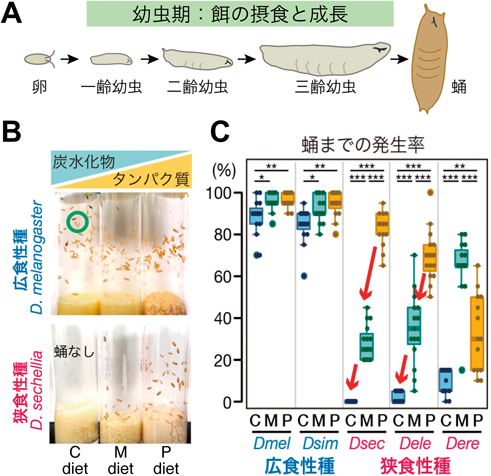
栄養環境の違いを捉えるためには,どのような餌を用意し,適応能力をどのように評価すればよいのだろうか.我々が注目したのが,食餌中の栄養素のうち,タンパク質(Protein)と炭水化物(Carbohydrate)の比率(P:C ratio)で栄養バランスを変化させる方法である(図2A).先行研究ではこの比の違いが,昆虫から哺乳類までにおいて寿命や生殖能力などの形質に大きな影響を与えることが示されている(図2B)23–25).そこで我々は,同一カロリーで栄養バランスが異なる3種類の餌(炭水化物の比率が高い餌,中程度の餌,逆にタンパク質の比率が高い餌)を作製した.そして,各ショウジョウバエ種の孵化直後の幼虫をそれぞれの餌で飼育し,次の発生段階である蛹にまで成長できた個体の割合(発生率)を指標に,栄養バランスに対する適応能力を比較した(図3A).
その結果,広食性2種はどの餌においても多くの個体が蛹にまで成長できるのに対し,狭食性の3種はいずれも,炭水化物の比率が高い餌では成長できないことを見いだした(図3B, C).特に,狭食性種のD. sechelliaとD. elegansは,餌中の炭水化物の比率が高くなるにつれて,蛹までの発生率が顕著に低下した.一方,狭食性種D. erectaの発生率は上記の狭食性2種とも異なり,P:C ratioが中程度の餌において発生率が最も高かった.以上の結果から,広食性種は異なる栄養バランスに広く適応できるのに対し,狭食性種は適応できる栄養バランスの幅が狭く,狭食性種間でも最適とする餌条件が異なることがわかった.
なお,少なくとも狭食性種D. sechelliaの幼虫は,3種類の実験室餌を同程度に摂食していたので,この種にみられる炭水化物の比率が高い餌への適応不全は,餌の好みの違いが原因ではない.また,広食性種D. melanogasterと狭食性種D. sechelliaに共生する微生物の違いが,適応能力の差に寄与している可能性を検討したところ,否定的な結果が得られている.
3)栄養バランスへの適応能力と自然界での食性との関係
次に,種間の適応能力の違いが,餌中のどの栄養成分が鍵となって生じたのかを検討した.栄養バランスへの適応能力と自然界での食性との関係を調べるため,実験に用いた近縁5種の幼虫が野外で食べている餌の成分を,実際に採取してgas chromatography-mass spectrometry(GC-MS)を用いて分析したり,文献情報に基づいたりして比較した.その結果,広食性種が野外で食べる餌には高炭水化物食(リンゴやバナナなど)から低炭水化物食(トマトやズッキーニなど)まで幅があることがわかった.一方で,狭食性種D. sechelliaの餌であるノニの果実やD. elegansの餌であるアサガオなどの花は,どちらも低炭水化物食であることを見いだした.
以上の結果から,自然界と実験室環境の両方において,広食性種は餌中の高炭水化物に高い適応能力を示すことが明らかになった.その一方で,上記の狭食性2種では,食餌中の炭水化物の比率の増加に適切に応答するメカニズムが働いていない可能性が考えられた.
4)種間の適応能力の差を生む炭水化物への応答機構
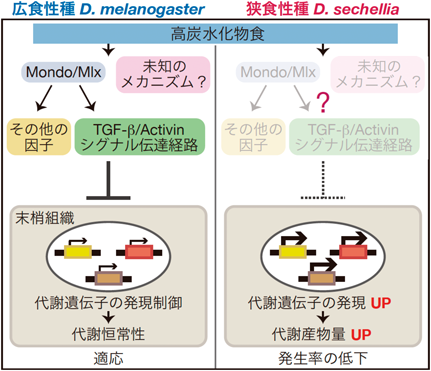
それでは,狭食性種では働かない炭水化物への応答機構とは何だろうか.我々が研究を始めた当時,広食性種D. melanogasterでは,全身性のTGF-β/Activinシグナル伝達経路が,炭水化物への応答機構として働くことが報告された26–28).摂取した炭水化物に応答して,脂肪組織からActivinホモログの一つであるDawdle(Daw)が分泌され,末梢組織でのTGF-β/Activinシグナル伝達経路を活性化する.たとえば,腸細胞においては多糖の消化酵素などの遺伝子発現が抑制される26).
そこで,D. melanogasterのdawdle遺伝子変異体(daw変異体)の幼虫が,我々が用いている3種類の実験室餌に適応できるかを調べた.興味深いことに,daw変異体は広食性種にも関わらず,狭食性種D. sechelliaやD. elegansと同様に,餌中の炭水化物の比率の増加に伴い発生率の低下を示した.さらに,幼虫期のどの段階で致死になるかを調べた結果,daw変異体はD. sechelliaと同じく一齢幼虫で致死となる個体が多いことがわかった.このことから,以降は,主にD. sechelliaとdaw変異体の表現型の類似性に着目して解析を進めた.
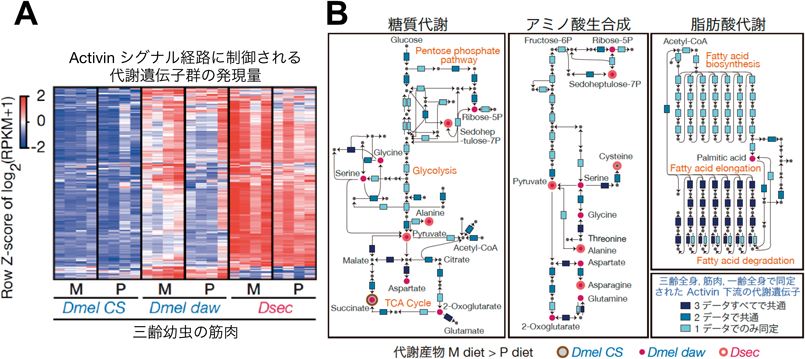
まず,広食性種の野生型とdaw変異体,そして近縁種についてRNA-seq解析を行い,異なる栄養バランスに対する遺伝子発現変動を網羅的に比較した.その結果,広食性種の野生型では,筋肉,腸,脂肪組織などの各組織で,200以上ものさまざまな代謝酵素遺伝子の発現量が,食餌間で大きく変動しないように調節されていることがわかった(図4AのDmel CS).これに対してdaw変異体や狭食性種D. sechelliaではこのような制御が働かず,発生率が低下する高炭水化物条件下では,代謝酵素遺伝子群の発現量が上昇していた(図4AのDmel dawとDsec).
遺伝子発現変動解析に加えてGC-MSを用いたメタボローム解析を行ったところ,広食性種の野生型では,検出された98の代謝産物の大半が食餌間で量は変動せず,代謝の恒常性が維持されていた.対照的にdaw変異体や狭食性種D. sechelliaでは,高炭水化物条件下でそれぞれ54個と33個の代謝産物の量が増加していた.しかも,D. sechelliaで増加した33個の代謝産物のうち27個が,daw変異体で増加した代謝産物と重複していた.増加した代謝産物には,糖質代謝だけでなくアミノ酸代謝や脂肪酸代謝など,さまざまな代謝経路の中間代謝産物が含まれていた(図4B).
以上のように,我々は,ショウジョウバエ広食性種と狭食性種間での,栄養バランスの異なる餌に対する適応能力の差や,遺伝子発現量および代謝産物量の制御に顕著な違いを見いだした.そして,広食性種では,TGF- β/Activinシグナル伝達経路を含む炭水化物応答機構が機能して代謝の恒常性が維持されているのに対して,狭食性種のD. sechelliaは,進化の過程でこの機構を失っている可能性が強く示唆された(図5).
5)狭食性種D. sechelliaのゲノム上の原因遺伝子座を特定する試み
TGF-β/Activinシグナル伝達経路を構成する主要な遺伝子は,広食性種と狭食性種のどちらのゲノムにも保存され,転写されている.それでは,D. sechelliaは,このシグナル伝達経路に属するいずれの遺伝子の機能を失い,高炭水化物食への応答制御や適応能力を失ったのだろうか.この問いに答えるために,広食性種D. melanogasterのdaw変異体に加えて,TGF-β/Activinシグナル伝達経路を構成する他の遺伝子の変異体も用いて,各変異体と,狭食性種D. sechelliaとの雑種個体を作出し,雑種個体が高炭水化物食に適応できるかどうかを検討した.その結果,D. sechelliaが示す高炭水化物食への適応不全は,このシグナル伝達経路に属する既知の1遺伝子の機能欠損では説明できないことが示唆された.加えて,D. sechelliaとdaw変異体との間で高炭水化物食への適応能力や生体応答に異なる点も複数あることから,狭食性種D. sechelliaではTGF- β/Activinシグナル伝達経路だけでなく,広食性種の野生型には存在する未同定の炭水化物応答機構も働いていない可能性が示唆されている(図5).これらの結果は,モデル生物D. melanogasterを用いた今後の栄養適応の研究に新たな指針を提供するものといえる.広食性種D. simulansと狭食性種D. sechelliaとの雑種個体を用いた研究により,高糖食への耐性を得るのに十分なD. simulansのゲノム領域が同定されており29),このゲノム領域に,我々が見いだした炭水化物応答機構に関与する遺伝子が含まれているかについては,今後の検討が必要である.
6)成体における栄養環境の影響の種間比較
以上の研究では,成長段階である幼虫期の成長と蛹の発生に与える栄養バランスの影響を検証した.それでは,それぞれの種の成虫の寿命は,成虫期の餌の栄養バランスによってどのような影響を受けるのだろうか.我々は炭水化物の比率が中程度の餌とタンパク質の比率が高い餌の2種類を用いて,各種の寿命を測定した30).その結果,オスについては予想どおりの結果となった.すなわち,炭水化物応答機構を持つ広食性種D. melanogasterは,餌間で寿命の差はほとんどないのに対して,応答機構が機能しない狭食性種D. sechelliaとD. elegansについては,炭水化物の比率が高い餌ではより短命になった.これらの種のオスの成虫が,幼虫期での応答と同じく,炭水化物の比率が高い餌では代謝の恒常性を失っているかどうかは,今後検討する必要がある.一方,メスについてはより複雑な結果になったが,これは餌に含まれるタンパク質の比率に応じてメスの生殖能力(産卵数)が種ごとに異なる程度に調節され,それが寿命に影響したためと解釈している30).
1)洞窟魚メキシカンテトラの個体群
実験室と比べて,洞窟はきわめて特異な環境である(図6A).暗黒であるため光合成による一次生産を欠いており,食物は乏しく低栄養な環境と分類されている.洞窟に生息する生物は,雨季に起きる氾濫によって河川から洞窟に流れ込んでくる栄養成分などに依存して,種を存続させている.一生を通して洞窟に生息する淡水魚類はobligatory cavefishと呼ばれ,200種以上が報告されている.これらの種の多くは,眼の退化や色素の消失などの形態上の形質を示し,発生や進化の観点から研究されている31, 32).たとえば,眼の退化の原因は,胚発生の中でも原腸胚初期にさかのぼり,シュペーマンオーガナイザーの細胞の再配列過程にあるとの仮説が提唱されている33).
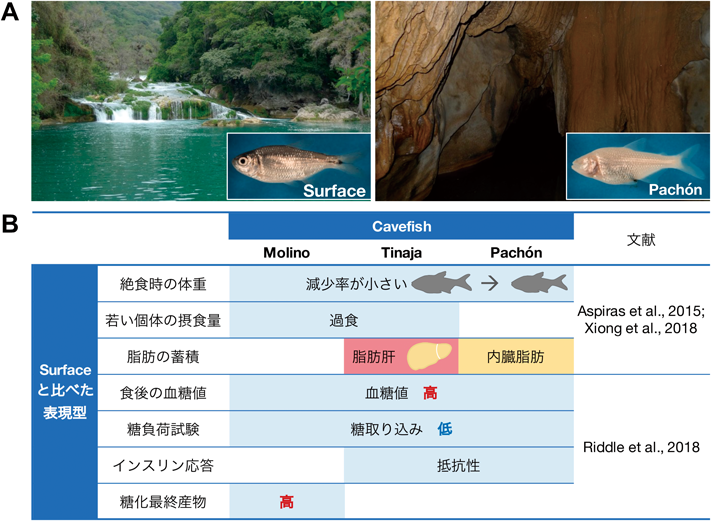
Obligatory cavefishの中でも,特に,メキシカンテトラ(Astyanax mexicanus)が研究に用いられてきた.その理由としては,この種が,河川に生息する両眼を保持した個体群(図6A左)と,眼の退化など明らかに異なる形質を示す洞窟生息群(図6A右)からなること,そして両者の間や異なる洞窟群の間での交配により,次世代が誕生することなどがあげられる.メキシコ国内のMolino, Tinaja,そしてPachónの各地域の洞窟から採取された個体群は,互いに別々に進化したと考えられており,それぞれの群は採取地名で呼ばれている.また,Molinoについては,同一の祖先から進化した河川生息群が現存しており,surface fishと呼ばれ表現型解析における対照として用いられている34).
2)飢餓耐性を示す三つの洞窟生息群のうちTinajaが示す「脂肪肝表現型」
洞窟生息群は限られた栄養環境に適応していることから,surface fishに比べて飢餓条件により耐性を示すことが予想された.実際,2か月間の絶食によりsurface fishの体重は30%減少するが,三つの洞窟生息群のいずれでも,体重の減少率はsurface fishのおよそ半分にとどまっていた(図6B)10).
一方で,洞窟生息群は餌を過剰に与えられると,その期間中は過食をして,代謝産物を身体に貯蔵させるのではないかと予想された.実際に若い個体を用いて摂食量を測定したところ,surface fishに比べて,TinajaやMolinoは約2倍の餌を摂取した一方で,対照的にPachónは過食しなかった(図6B).さらに,餌が過剰な条件下ではTinajaのみ,多量の中性脂肪が肝臓に蓄積される脂肪肝様の表現型(脂肪肝表現型)を呈することがわかった(図6B).
以上の結果から,三つの洞窟生息群は互いに独立に進化した結果,餌が過剰な環境では異なる生理学的な応答を示すと想像できる.そして各々の個体群について,いくつもの興味深い疑問が議論されている.①Tinajaでの脂肪肝表現型に寄与する原因遺伝子と,その変異は何か.表裏の疑問として,Molinoでは過食しつつもなぜ脂肪肝表現型を示さないのか.②Tinajaは富栄養下において脂肪肝を抱えながらも,寿命や健康状態には他の個体群と顕著な差はみられない.一方,ヒトでは,大量の脂質が肝臓に蓄積する非アルコール性脂肪性肝疾患は,肝炎を引き起こし,さらには肝細胞がんへと進行する35).Tinajaではそのような症状が生じることなく肝臓に脂肪を貯蔵させるメカニズムを獲得しているのだろうか.③さらにPachónに目を転じれば,この個体群は十分な餌がある条件下で過食することなく,どのように絶食に対抗して体重の減少を抑えているのだろうか.Pachónは他の個体群よりも早い発生時期から内臓脂肪を蓄積することが報告されており,これは過食に依存することなく絶食時の生存を可能にするこの群特有の応答らしい12).ヒトにおいて内臓脂肪の蓄積はさまざまな代謝異常のリスクを高めるため,内臓脂肪組織の発生を制御するメカニズムの解明は重要な課題である36, 37).Pachónと他の群を対比した解析がこの解明に貢献することが期待される.
3)高血糖を示す洞窟生息群でのインスリン応答性と個体成長に与える影響
前述の研究では飢餓耐性を出発点としたのに対して,血糖調節に着目した研究も報告されている11).三つの洞窟生息群はいずれも,surface fishと比べて食後の血糖値が高い(図6B).そして,糖負荷実験から,血糖を取り込む機能がsurface fishより低下していることがわかり,さらに,TinajaとPachónについては,その原因がインスリン抵抗性にあることが示された(図6B).これら二つの個体群が示すインスリン抵抗性の原因は,それぞれの個体群のインスリン受容体遺伝子のミスセンス変異が原因であった.インスリンは成長に必要なホルモンの一つであり,筆者らはさらに,この変異が個体成長に与える影響についても調べている.哺乳類では,インスリン受容体の機能喪失で発育遅延が生じるが,魚類ではこの変異により体重や体長が増加しており,これらの違いがどのようなメカニズムで生じているかは現時点で不明である.
さらに,本研究では,洞窟生息群の血糖値が高いことから,糖化最終産物(advanced glycation endoproducts:AGEs38))の量が上昇している可能性について検証している.AGEsは糖尿病に伴う心血管疾患や老化と密接に関連する.surface fishと比べて,TinajaとPachónではAGEs量は上昇しておらず,血糖値が高くてもAGEs量を抑える仕組みを獲得していることが示唆された.一方,Molinoでは,surface fishや他の洞窟生息群と比べておよそ50%増加していた(図6B).MolinoではAGEs増量の有害な影響が認められるのか,今後の詳細な解析が待たれる.
4)洞窟生息群では個体機能は低下していない
以上のように,洞窟生息群は自由摂食条件下で飼育すると,臓器レベルあるいは代謝産物レベルで,surface fishとは異なる応答を示す(図6B).その応答のいずれもが,ヒトの疾患やモデル生物を用いた研究では個体にとって有害とされている.しかし,TinajaとPachónの老化に伴う生殖能力の低下を調べたところ,surface fishと差がなかった.さらに,背の湾曲などの外見上の兆候から判断して,surface fishよりもむしろ老化の進行は遅れている11).したがって,生活史に関する形質については,現時点の報告では洞窟生息群の個体機能は低下していないらしい.
ヒトの疾患を想定してモデル生物を用いる研究においては,変異を導入するか食餌に介入して,個体機能をまず低下させる(個体を病的にさせる)アプローチが定石となっている.メキシカンテトラのような非モデル生物を用いた研究は,モデル生物を用いた研究からだけでは推し量れない,栄養環境への適応メカニズムを発見できる可能性を示している.
以上に述べたように,「狭食性種」あるいは「洞窟に生息する個体群」と一口にいっても,種や群ごとに形質は実にさまざまである.我々が用いた狭食性種の一つD. erectaの栄養バランスへの適応能力は,他の狭食性種のいずれとも異なる(図3C)9).D. erectaの幼虫は,炭水化物の比率が高い餌だけでなく,タンパク質の比率が高い餌にも適応できず,中程度の比率の餌で発生率が最適となった.D. erectaがタンパク質の比率が高い餌に適応できない原因は何だろうか.これは生物種間比較により発掘された新しい問題であり,高タンパク質食に適応できないD. melanogasterの変異体の分離・解析を通して,栄養適応の分野における新たな発見につながるかもしれない.
非モデル生物が示す特徴的な形質の獲得を理解する上で,各生物の生態学的な情報は,まだまだ不足している.メキシカンテトラが洞窟内で何を餌としているかは研究が始まったばかりであり,洞窟がどの程度「貧栄養」環境なのかについても検討され始めている39, 40).また,ショウジョウバエの広食性種は四季に応じて野外での餌が変わると想像される.しかし,モデル生物であるD. melanogasterでさえ,どこでどのように越冬しているかなどの生活史に関しては,まだ不明な点が多い41).紙面の都合で詳細は割愛するが,トゲウオの一種で,淡水域でも生息できるイトヨ(Gasterosteus aculeatus)と,淡水域では生存できない近縁種ニホンイトヨ(Gasterosteus nipponicus)の比較解析から,ドコサヘキサエン酸(docosahexaenoic acid:DHA)生合成経路において不飽和化を触媒する酵素の一つをコードする遺伝子Fads2が,淡水域で生存できるかどうかを決める重要な因子となることが見いだされた42).この研究においては,二つの種の野外での餌に関する検討などから,後者の飼育に必要な餌の成分がDHAであることを突き止めたことがブレークスルーとなっている.
かつては,非モデル生物特有の形質と,遺伝子機能との因果関係を検証する解析手法が限られていたが,今後は,ゲノム編集などの技術が,非モデル生物にも続々と適用されていくだろう.実際,本稿で取り上げた狭食性種D. sechelliaや,過熟する前の果物に好んで産卵する害虫として知られているDrosophila suzukiiについては,トランスジェニック動物や変異体が作製され,それぞれに特徴的な形質を支える嗅覚システムが明らかにされた43, 44).
今回取り上げたように,非モデル生物の栄養環境への応答が多様であることは,ヒトにおいても,肥満や糖尿病などの罹りやすさや栄養環境への適応が,人種や個体間で異なることを連想させる45, 46).非モデル生物を巻き込んだ比較研究が,ヒトの人種または個体間の違いを解く鍵となるかもしれない.そうなれば,「食・栄養とヒトの健康」をキーワードに生物種の多様性研究の重要性がいっそう後押しされ,学術全体へのインパクトもより大きくなるだろう.