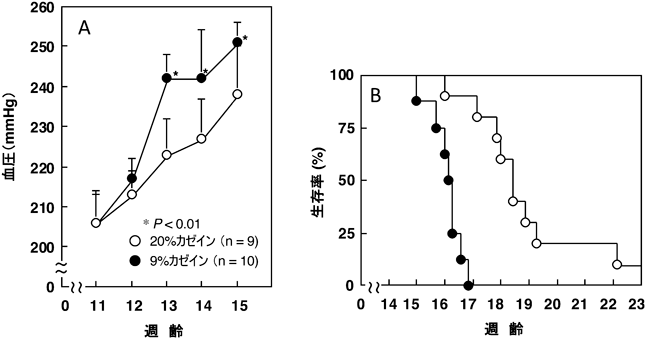
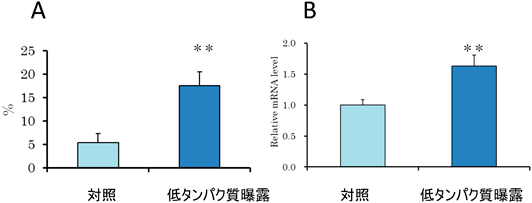
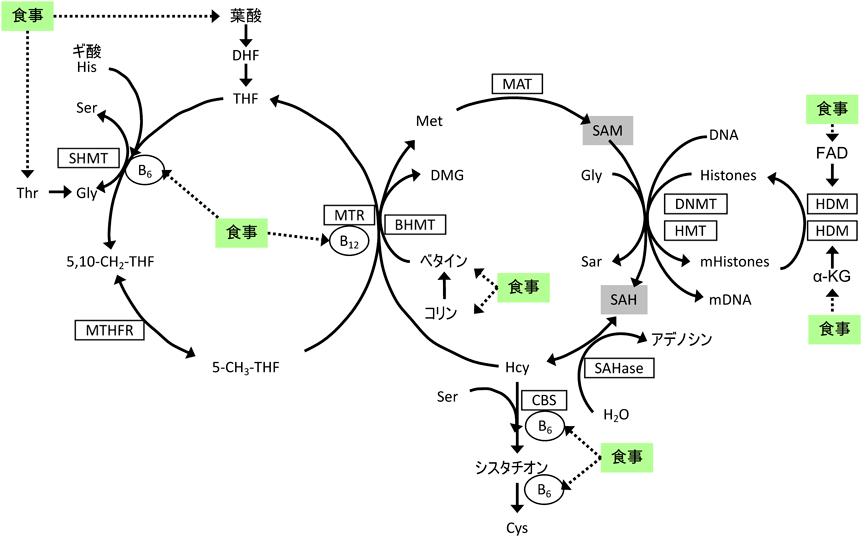
胎児期の栄養が生活習慣病の発症に及ぼす影響のエピゲノム解析Epigenomic study of the effect of nutrition during fetal stage on the later onset of life style-related diseases
東京大学大学院農学生命科学研究科Graduate School of Agricultural and Life Sciences, The University of Tokyo ◇ 〒113–8657 東京都文京区弥生1–1–1 ◇ 1–1–1 Yayoi, Bunkyo-ku, Tokyo 113–8657, Japan